正交试验优化超声波辅助提取果蔬中赤霉素GA3残留量的测定条件
2020-02-22王健任雪梅丁晓雯
王健,任雪梅,丁晓雯
(1.山东省食品药品检验研究院,山东济南250102;2.西南大学食品科学学院,重庆400715)
赤霉素GA3(gibberellic acid)又名赤霉酸、九二O、奇宝,是一种生物活性高、应用广泛的植物激素类农药。1926 年,日本科学家黑泽英一在研究水稻“恶苗病”时发现感染赤霉菌(Gibberella fujikuroi)的水稻植株会出现疯长现象,后来经分离鉴定这种活性物质被命名为赤霉素[1-2]。迄今为止,已先后鉴定出136 种结构明确的赤霉素GA1~GA136,其中GA3的生物活性最高、应用最广泛。赤霉素作为植物生长调节剂已被广泛应用于农业生产中,在促进细胞分裂和伸长、种子萌发、茎秆伸长、根的生长及开花、果实发育以及提高植物耐逆性等方面发挥着重要作用[3-5]。
国内外研究表明,赤霉素GA3急性毒性较低,对大鼠具有一定的遗传毒性[6]、神经毒性[7]及生殖毒性[8],可引起肝脏损伤[9],甚至诱发肿瘤的形成[10-11]。对于赤霉素GA3的残留限量问题世界各国未达成一致结论,日本肯定列表规定的赤霉素GA3最高残留限量(maximum residue limit,MRL)为 0.2 mg/kg[12],我国还未制定赤霉素的残留限量标准,因此检测该物质在农产品与食品中的残留量,对了解它对农产品的污染情况、保护消费者健康具有积极意义。
目前测定赤霉素的前处理方法主要有液-液萃取[13-14]、固相萃取[15-17]、基质分散固相萃取[18-20],此外还有超声波辅助提取[21]、大孔吸附树脂[22]等方法。部分测定方法前处理操作步骤繁琐,不适合农残的快速检测,而国标方法GB 23200.21-2016《食品安全国家标准水果中赤霉酸残留量的测定液相色谱-质谱/质谱法》[23]仅适用于水果中赤霉素残留量的测定。本研究采用超声波提取-固相萃取-液相色谱法检测果蔬中赤霉素GA3的残留量,目的是简化前处理步骤,提高赤霉素的提取效率,为保障农产品质量安全提供参考。
1 材料与方法
1.1 材料与试剂
黑豆芽、梨、苹果、葡萄、黄瓜:重庆市北碚区A 超市;李子、番茄、黄豆芽:重庆市北碚区B 超市;圣女果、生菜、青椒:重庆市北碚区C 市场。其中单因素试验、正交试验、验证试验、精密度试验采用黑豆芽;加标回收试验、样品测定采用黄豆芽。
赤霉素GA3标准品(纯度95%):上海源叶生物科技有限公司;甲醇(分析纯)、甲酸(色谱纯):成都市科龙化工试剂厂;甲醇(色谱纯):天津市四友精细化学品有限公司;0.45 μm 有机系微孔滤膜:广州华载试剂耗材公司;C18固相萃取小柱(3 mL,200 mg):北京超能传奇公司。
1.2 仪器设备
LC-20A 型高效液相色谱仪(配二极管阵列检测器)、SHIMADZU C18色谱柱(4.6 mm×250 mm,5 μm):日本SHIMADZU 公司;KQ5200DB 型超声波清洗器:昆山市超声仪器有限公司;SHZ-Ⅲ型循环水真空泵:上海亚荣生化仪器厂;HGC-36A 型氮吹仪:天津市恒奥科技有限公司。
1.3 试验方法
1.3.1 赤霉素GA3标准曲线的绘制
标准溶液的配制:用甲醇作溶剂,配制0.1 mg/mL赤霉素GA3标准储备液,避光保存于4 ℃冰箱中,有效期3 个月。将赤霉素GA3标准储备液用甲醇稀释成浓度依次为 0.0、10.0、20.0、30.0、40.0、50.0、60.0、70.0、80.0、90.0、100.0 μg/mL 的标准工作液,避光保存于 4 ℃冰箱中,有效期1 个月。
色谱条件[24]:SHIMADZU C18色谱柱(5 μm,4.6 mm×250 mm),甲醇-0.15%甲酸水溶液(55 ∶45,体积比)作流动相,流速为0.6 mL/min,柱温为40 ℃,进样量为5.0 μL,检测波长为 206 nm。
在上述色谱条件下,对各浓度的赤霉素GA3标准工作液进行测定。以赤霉素GA3的浓度(μg/mL)为横坐标,峰面积为纵坐标绘制赤霉素GA3标准曲线,并求出回归方程。
1.3.2 样品的前处理
参照文献[25],称取捣碎后的样品10 g 左右于100 mL 蓝盖玻瓶中,加入 20 mL 甲醇-水(80 ∶20,体积比)溶液,超声波提取30 min,布氏漏斗抽滤,取1.0 mL滤液于45℃氮吹至近干,用5%甲醇溶液定容至1.0 mL,过C18固相萃取小柱(小柱使用前分别用1 mL 甲醇和1 mL 纯水活化),用 3 mL 甲醇-水(40 ∶60,体积比)洗脱。收集洗脱液于45 ℃氮吹至近干,用甲醇(色谱纯)定容至1.0 mL,过0.45 μm 滤膜,供液相色谱分析。通过标准曲线回归方程查出测定液中赤霉素GA3的浓度,计算样品中赤霉素GA3的含量。计算公式如下:

式中:X 为样品中赤霉素的含量,mg/kg;C 为样品测定液中赤霉素的含量,μg/mL;F 为稀释倍数;m 为样品质量,g。
1.3.3 影响样品前处理的单因素试验
以黑豆芽作为试验样本,根据预试验结果,选取超声时间 30 min、超声功率 160 W、料液比 1 ∶2(g/mL)及甲醇浓度80%为基本条件,改变其中一个条件,固定其他条件以考察这4 个因素对黑豆芽中赤霉素GA3提取量的影响,确定最佳试验条件。其中超声时间分别设为 10、20、30、40、50 min,超声功率分别设为 96、112、128、144、160 W,料液比分别设为 1 ∶1、1 ∶2、1 ∶3、1 ∶4、1 ∶5(g/mL),甲醇浓度分别设为 60%、70%、80%、90%、100%。
1.3.4 正交试验优化
根据单因素试验结果,对超声时间、超声功率、料液比、甲醇浓度这4 个因素进行四因素三水平的正交试验进一步优化前处理条件,并根据正交试验得出的优化条件进行验证试验。L9(34)正交试验因素水平表的设置见表1。
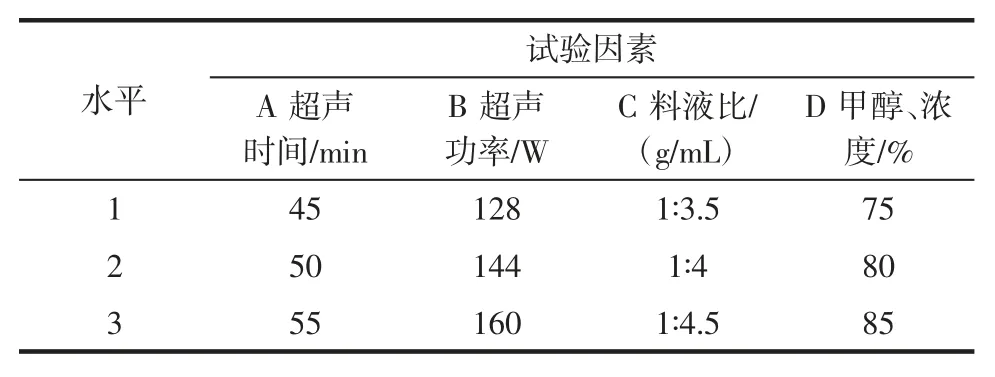
表1 正交试验因素水平表Table 1 Factors and their coded levels used in the orthogonal array design
1.3.5 精密度及加标回收试验
用正交试验得到的最优条件对样品进行提取,提取液重复测定6 次,计算浓度的相对标准偏差即精密度;在所测样品中加入一定量的赤霉素标准品,计算回收率。
1.3.6 市售果蔬中赤霉素GA3残留量的检测
采用正交试验优化后的样品前处理条件对梨等5 种水果及番茄等5 种蔬菜中的赤霉素GA3进行提取纯化,并利用液相色谱法测定其残留量。在各样品中分别添加0.1、0.5、1.0 mg 赤霉素GA3标准品,分别计算低、中、高3 个水平的加标回收率及相对标准偏差。
1.3.7 数据处理
每次试验均重复操作3 次以上,结果用平均值±标准偏差表示。采用SPSS 16.0 统计软件进行显著性分析(最小显著性差异法)。采用Origin 8.0 软件进行绘图。
2 结果与分析
2.1 赤霉素GA3的标准曲线、线性范围及检出限
在试验方法给定的色谱条件下,测定并计算得到赤霉素GA3标准曲线的线性回归方程为,相关系数r=0.999 8。该标准曲线的线性范围为0~100 μg/mL,检出限(S/N=3)为0.5 μg/mL。赤霉素GA3(95%)标准曲线、标准溶液(40 μg/mL)色谱图分别见图 1、图2。
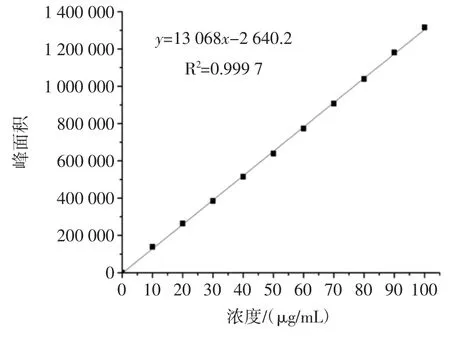
图1 赤霉素GA3(95%)标准曲线Fig.1 Standard curve of gibberellic acid(95%)

图2 赤霉素GA3 标准溶液(40 μg/mL)色谱图Fig.2 Chromatogram of gibberellic acid standard solution(40 μg/mL)
2.2 样品前处理条件的优化
超声波辅助提取技术利用超声效应使提取液充分渗透到样品匀浆中,具有提取温度低、耗时短、效率高等特点,适用于各种动、植物有效成分的提取[26]。固相萃取技术利用固体吸附剂对不同组分吸附能力的差异而达到分离待测组分的目的,是一种有效的样品前处理方法。对于提取剂的选择,考虑到样品基质为含水量较多的水果蔬菜,应选择与水互溶的有机溶剂作为提取剂。参照文献[25]的试验结论,60%甲醇溶液提取效果较差,纯甲醇提取时易发生乳化现象,因此选用80%甲醇溶液作为提取剂。本试验采用超声波提取、固相萃取相结合的方法对豆芽中赤霉素GA3进行提取纯化,优化提取条件,以达到更好的提取效果。
2.2.1 超声时间对赤霉素GA3提取量的影响
称取一定量捣碎的黑豆芽样品,加入80%甲醇溶液,于超声功率 160 W、料液比 1 ∶2(g/mL)的条件下超声处理不同的时间,然后抽滤、过C18固相萃取小柱,进液相色谱分析,得到不同超声时间对黑豆芽中赤霉素GA3测定值的影响,试验结果见图3。
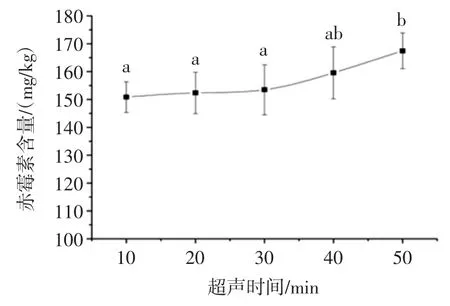
图3 超声时间对赤霉素GA3 提取量的影响Fig.3 Effect of ultrasound time on the amount of gibberellic acid
由图3 可以看出,当超声时间在40 min 以内,赤霉素GA3的提取量增加差异不显著,当超声时间超过40 min,赤霉素GA3的提取量与其他时间的提取量存在显著性差异。结果表明,超声时间的延长有助于溶剂提取样品中的赤霉素GA3,但是考虑到省时的原则,超声时间选择50 min。
2.2.2 超声功率对赤霉素GA3提取量的影响
称取一定量捣碎的黑豆芽样品加入80%甲醇溶液,在不同的超声功率下维持料液比1 ∶2(g/mL)、超声时间30 min 处理样品,然后抽滤、过C18固相萃取小柱,进液相色谱分析,得到不同超声功率对黑豆芽中赤霉素GA3测定值的影响,试验结果见图4。

图4 超声功率对赤霉素GA3 提取量的影响Fig.4 Effect of ultrasonic power on the amount of gibberellic acid
由图4 可以看出,当超声功率为144 W 时,赤霉素GA3的提取量达到最大值,且128、144 W 的超声功率对赤霉素GA3的提取量与其他功率相比存在显著性差异;当超声功率超过144 W,由于超声波可能对赤霉素GA3有一定的分解,导致赤霉素GA3的提取量显著降低。因此,超声功率选择144 W。
2.2.3 料液比对赤霉素GA3提取量的影响
称取一定量捣碎的黑豆芽样品加入不同体积的80%甲醇溶液,在超声时间30 min、超声功率160 W的条件下提取样品,然后抽滤、过C18固相萃取小柱,进液相色谱分析,得到不同料液比对黑豆芽中赤霉素GA3测定值的影响,试验结果见图5。

图5 料液比对赤霉素GA3 提取量的影响Fig.5 Effect of solid-liquid ratio on the amount of gibberellic acid
由图 5 可知,当料液比为 1 ∶4(g/mL)时,样品中赤霉素 GA3的提取量达到最高,且 1 ∶4、1 ∶5(g/mL)的料液比对赤霉素GA3的提取量与其他比例存在显著性差异。因此,料液比选择 1 ∶4、1 ∶5(g/mL)较合适。基于少用有机溶剂的原则,选择料液比为1 ∶4(g/mL)。
2.2.4 甲醇浓度对赤霉素GA3提取量的影响
称取一定量捣碎的黑豆芽样品加入不同浓度的甲醇溶液,在超声时间30 min、超声功率160 W、料液比 1 ∶2(g/mL)的条件下提取样品,然后抽滤、过 C18固相萃取小柱,进液相色谱分析,得到不同浓度的甲醇溶液对黑豆芽中赤霉素GA3测定值的影响,试验结果见图6。
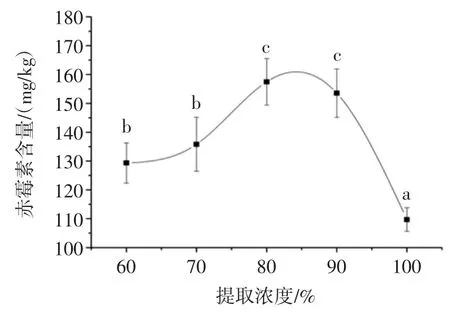
图6 甲醇浓度对赤霉素GA3 提取量的影响Fig.6 Effect of methanol concentration on the amount of gibberellic acid
由图6 可知,当甲醇浓度为80%时,样品中赤霉素GA3的提取量达到最高,且80%、90%甲醇溶液对样品中赤霉素GA3的提取量显著高于其他浓度甲醇溶液。因此,甲醇浓度选择80%、90%较合适。基于少用有机溶剂的原则,选择甲醇浓度为80%。
综合单因素试验结果,超声波处理样品提取赤霉素GA3较适宜的条件是超声时间50 min、超声功率144 W、料液比 1 ∶4(g/mL)、甲醇浓度 80%。
2.3 正交试验确定赤霉素GA3提取的最佳条件
在单因素试验结果基础上,根据L9(34)正交试验因素水平表的设计进行正交试验,结果见表2。
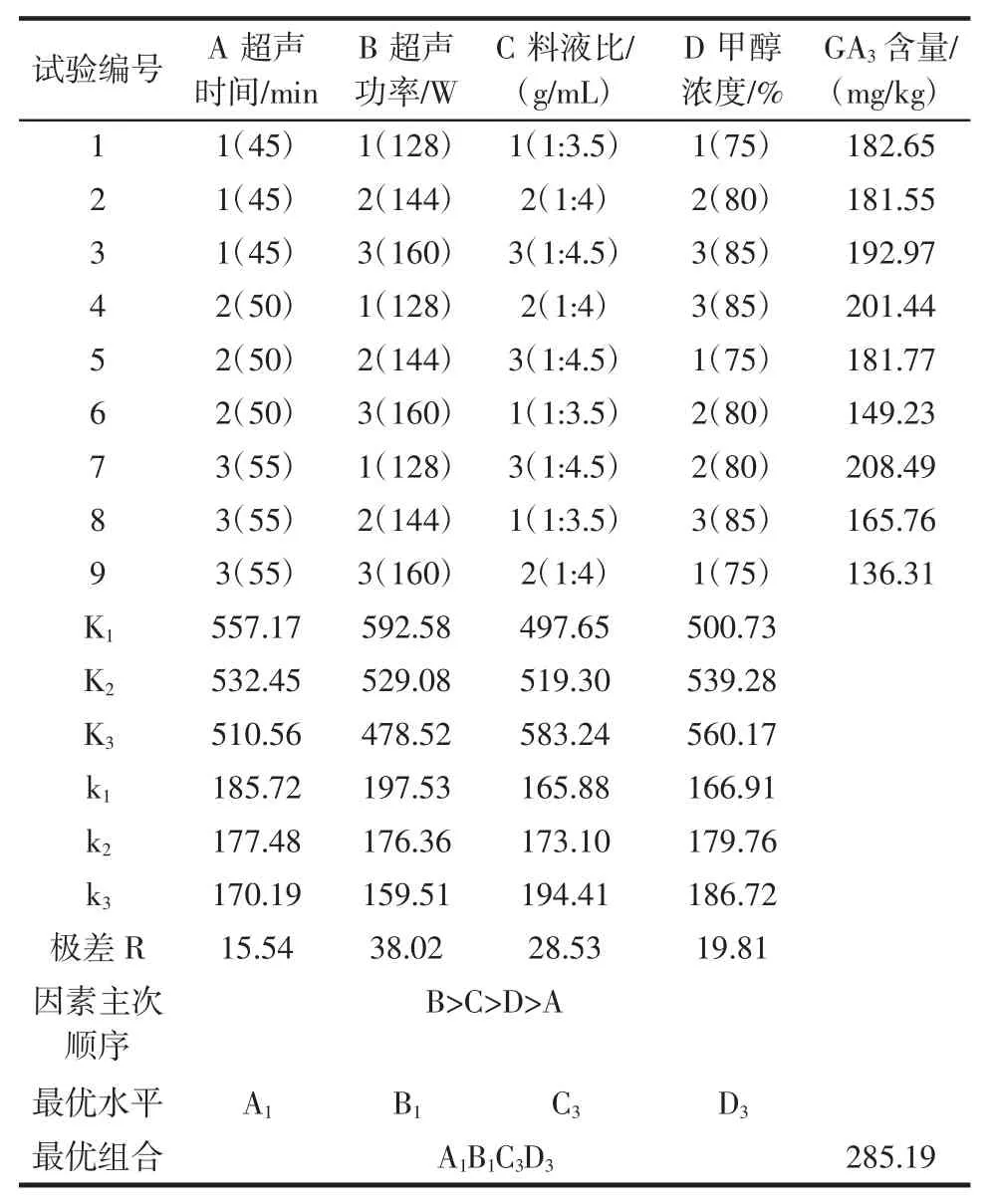
表2 正交试验结果Table 2 Results of orthogonal array
极差R 的大小可衡量因素的主次,极差大表明该因素对试验的产生与结果影响大,即此因素重要;极差小表明该因素较次要。由表2 的极差分析结果可知,各试验因素对赤霉素GA3测定含量影响的主次顺序为B>C>D>A,即超声功率>料液比>甲醇浓度>超声时间;最佳提取条件为A1B1C3D3,即超声时间45 min、超声功率128 W、料液比1 ∶4.5(g/mL)、甲醇浓度85%。
采用优化后的超声波提取条件,经固相萃取纯化,高效液相色谱法检测黑豆芽样品中赤霉素GA3,得到测定值为285.19 mg/kg,明显高于正交试验的最优组(第7 组)的208.49 mg/kg。
因此,测定样品中赤霉素GA3的超声波提取的最优条件是超声时间45 min、超声功率128 W、料液比1 ∶4.5(g/mL)、甲醇浓度 85%。
2.4 方法的精密度和准确度
精密度反映分析方法或测量系统存在的随机误差,是衡量方法可靠性的一项重要指标。黑豆芽样品精密度试验结果如表3 所示,其中SD 为标准差(standard deviation),RSD 为相对标准偏差(relative standard deviation)。
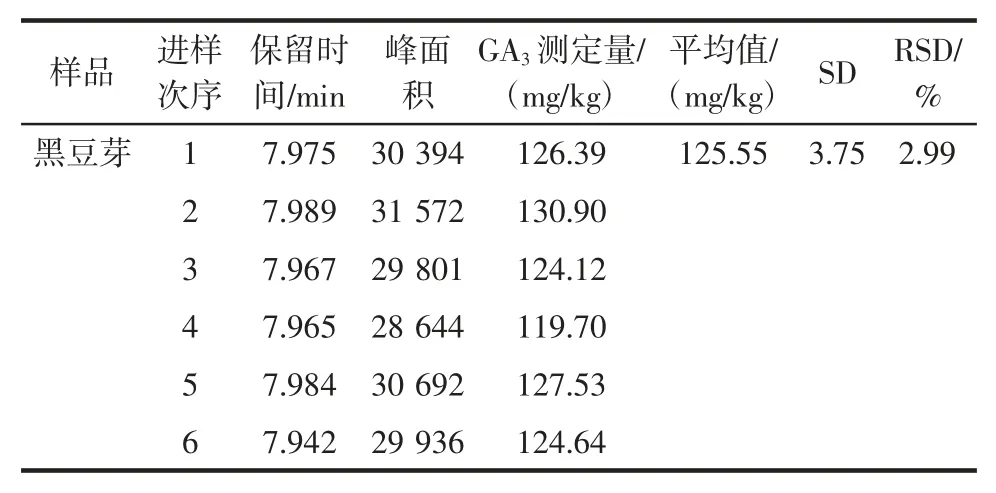
表3 豆芽样品精密度试验结果Table 3 Accuracy test results of bean sprouts
由表3 可知,黑豆芽样品赤霉素GA3重复测定6次试验的结果在119.70 mg/kg~130.90 mg/kg 之间,平均值为125.55 mg/kg。因选用不同批次的黑豆芽样品进行正交试验及精密度试验,正交试验最优组合与精密度实验中赤霉素GA3的测定结果不具有可比性。
相对标准偏差(RSD)越接近0%,表示该方法的精密度越好。由表3 可知,黑豆芽中赤霉素提取量的相对标准偏差为2.99%,表明该方法在重复性条件下(n=6)精密度良好。
准确度是反映分析方法或测定系统存在的系统误差和随机误差的综合指标,通常用加标回收率作为评价指标。黄豆芽中赤霉素3 个水平的加标回收率如表4 所示。

表4 豆芽中赤霉素GA3 的加标回收率Table 4 Recovery rate of gibberellic acid in bean sprouts
回收率越接近100%,表示该方法的准确度越高。从表 4 可知,添加 0.1、0.5、1.0 mg 赤霉素标准品,加标回收率分别为96.04%、97.05%、94.69%,相对标准偏差分别为4.22%、6.61%、4.65%,表明该方法的准确度良好。
欧盟对食品中农药残留测定方法作了严格规定,回收率为70%~120%,相对标准偏差不超过20%[27]。经验证,本研究所建立的赤霉素残留检测方法的回收率及相对标准偏差均在相关标准规定范围内,证明该方法的精密度及准确度良好,符合分析检测的要求。
2.5 市售果蔬中赤霉素GA3残留检测结果
随机购买3 个市场的10 种果蔬样品,采用优化后的超声波提取条件处理样本,经C18固相萃取小柱净化,高效液相色谱法测定,得到样本中赤霉素GA3含量及3 个水平的加标回收率,结果见表5。
由表5 可知,测定的黄豆芽中赤霉素残留量高达21.56 mg/kg,梨、圣女果、苹果、黄瓜样品中的残留量分别为 5.25、4.94、4.57、3.89 mg/kg,其余样品未检出。测定结果表明,芽菜类和早熟果蔬中GA3残留情况严重,与史玉琴[28]的结论一致。
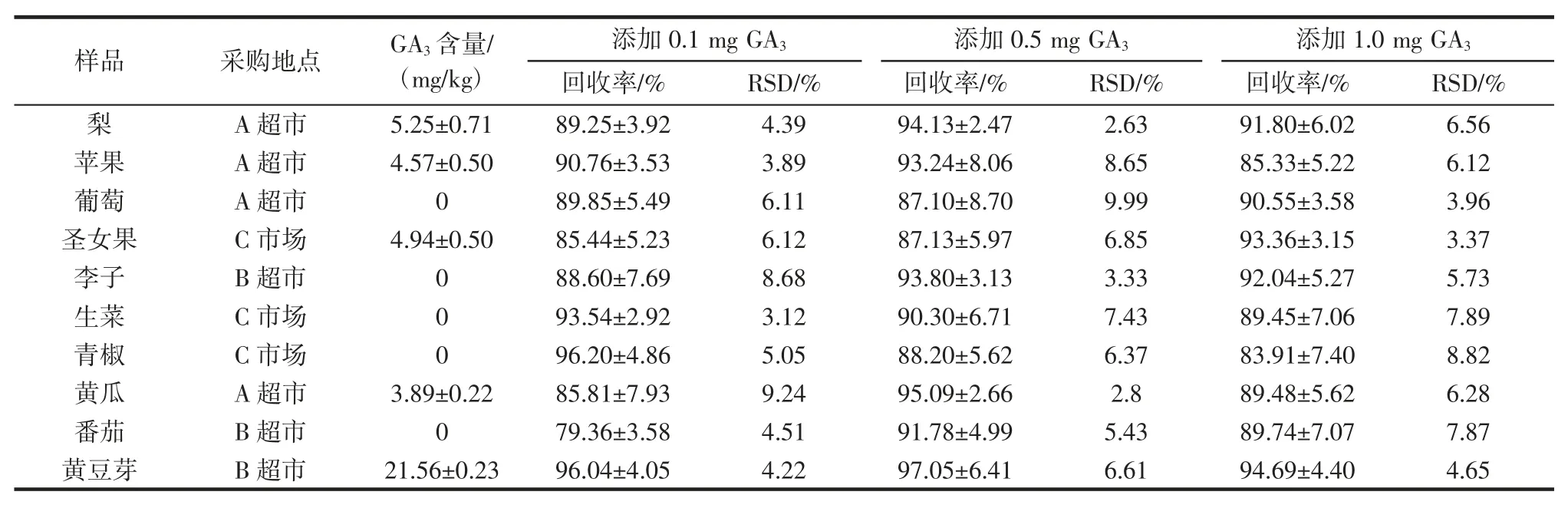
表5 市售果蔬中GA3 残留量Table 5 Residues of gibberellic acid in commercially available fruits and vegetables
由于我国未出台赤霉素GA3的限量标准,如果套用日本肯定列表规定的残留限量0.2 mg/kg,所检测的10 种样品中50%阳性检出均远远超过了0.2 mg/kg,其中黄豆芽中的赤霉素GA3含量超过日本肯定列表的限量规定100 倍。造成赤霉素GA3残留量过高的原因可能与不规范使用有关,相关部门应该加强对农产品中赤霉素GA3规范使用的管理及残留量的检测。
采用本研究所建立的超声波辅助提取-固相萃取-高效液相色谱法测定10 种果蔬样本赤霉素残留量,3 个不同添加水平(0.1、0.5、1.0 mg) 的回收率在79.36%~97.05%之间,相对标准偏差为2.63%~9.99%。根据欧盟及我国相关规定,该方法的精密度及准确度良好,符合检测的技术要求,可以作为果蔬样本中赤霉素残留量的测定方法。
3 结论
采用超声波提取样品中的赤霉素GA3,最优的实验条件为超声时间45 min、超声功率128 W、料液比1 ∶4.5(g/mL)、甲醇浓度85%。超声波提取不仅简化了前处理过程,大大缩短了分析时间,而且测定的加标回收率为79.36%~97.05%,相对标准偏差为2.63%~9.99%。本研究所建立的前处理方法符合简便、快速、准确、灵敏的农药残留检测要求,适用于多种果蔬中赤霉素的残留检测。
