具氯氰菊酯降解功能的植物内生细菌分离鉴定及降解特性研究
2020-02-22孙丽娜黄开华高新华白娜玲吕卫光
孙丽娜,黄开华,高新华,陈 伟,白娜玲 ,吕卫光*
(1.上海市农业科学院生态环境保护研究所,上海 201403;2.上海低碳农业工程技术研究中心,上海 201403)
氯氰菊酯属拟除虫菊酯类杀虫剂之一,是1983年由Shell International Chemical公司(现为BASF)产业化开发[1],具有广谱杀虫作用。氯氰菊酯可用作棉花、蔬菜、果树、茶树、大豆等作物上害虫的防治。对棉花和果树上的鳞翅目、半翅目、双翅目、直翅目、鞘翅目、膜翅目等多种害虫均有较好的防治效果[2]。因此,菊酯类杀虫剂在世界范围内得到广泛应用,目前占我国农业杀虫剂使用面积的三分之一以上。但过度和广泛的使用会对人体健康和生态环境安全造成威胁。研究表明,经常接触氯氰菊酯会产生免疫毒性[3],而且此类农药容易在人体内积累,引发各种慢性疾病[4]。近年来,已有多次关于氯氰菊酯蔬菜残留的报道。李晓莉[5]于2008—2011年间对淄博市蔬菜中拟除虫菊酯类农药残留进行了检测,其中氯氰菊酯残留量最高。雷雨等[6]于2016年调查了定西地区市售蔬菜拟除虫菊酯类农药残留,其总检出率为45.0%,超标率为0.04%,超标农药主要为氯氰菊酯和高效氯氰菊酯。因此,有关氯氰菊酯残留的生物修复得到了广泛关注。
植物内生菌是指真菌或细菌一生中的某个阶段能进入活体植物组织内,并在植物内不引起明显组织变化的微生物[7]。植物内生菌通常归属于宿主植物所栽种土壤中普遍存在的特殊属,是植物组织内的有益菌落[8]。研究表明,植物内生细菌产生的酶类、生长素等次生代谢产物,能调节植物代谢,促进生长,提升植物耐受性[9-11]。与从土壤中分离的降解菌株相比,植物内生菌能有效定殖在植物体内,促进植物对污染物的吸收、转化和降解,从而减轻污染物对植物的毒害作用。因此,亟需筛选具有氯氰菊酯降解特性的植物功能内生菌。
本研究通过富集筛选得到一株以氯氰菊酯为唯一碳源生长的植物内生细菌,并系统研究了其生物学特性和降解功能,以期为利用功能内生细菌来调控植物代谢氯氰菊酯,进而有效地规避作物污染风险提供新途径。
1 材料方法
1.1 试验材料
氯氰菊酯(纯度>98%)购于Sigma公司,甲醇为色谱纯,其余试剂为分析纯。
供试植株牛筋草 Eleusine indica(L.)Gaertn.,采自上海郊区某农药厂附近(30°55′N,121°03′E)。植株生长良好,采集后立即带回实验室进行菊酯降解菌的分离筛选。
1.2 培养基
根据本实验需求,查询相关文献[12]中培养基的配制,以1000 mL液体培养基为标准。
Luria-Bertani(LB)培养基:10 g胰蛋白胨,5 g酵母膏,10 g氯化钠,1000 mL去离子水,pH 7.0~7.2。固体培养基是在每1000 mL液体培养基中加入15~20 g琼脂粉,121℃高压蒸汽灭菌20 min。
无机盐培养基(MSM):0.4 g MgSO4·7H2O,0.2 g FeSO4· 7H2O,0.2 g K2HPO4,0.2 g(NH4)2SO4,0.08 g CaSO4,1000 mL去离子水,pH 7.0~7.2。固体培养基是在每1000 mL液体培养基中加入15~20 g琼脂粉,121℃高压蒸汽灭菌20 min。
菊酯降解培养基:将菊酯原药溶于二甲基亚砜(色谱纯度)配制成浓度为10 000µL·L-1的母液,过滤除菌,然后加入至已灭菌的MSM培养液,菊酯的终浓度为20 mg·L-1。
1.3 功能植物内生细菌的分离筛选
取适量新鲜的植株样本,用无菌水将植株表面附带的灰尘泥土冲洗干净,使植物表面没有污迹,然后自然风干。用75%酒精漂洗3~5 min,然后用无菌水冲洗3~4次,再用无菌水冲洗5次。将表面消毒冲洗好的植物组织放置于已灭菌的研钵内研磨,吸取汁液均匀涂布于LB培养基平板上,于30℃条件下避光培养2~7 d。将最后一次冲洗的水涂布到LB培养基上作为对照,以检验表面消毒的效果。待长出菌落后挑取单菌落进一步划线,以菊酯降解培养基来分离纯化。选取能连续5次在氯氰菊酯作为唯一碳源的无机盐培养基上生长的菌株,保存于LB培养基斜面上供进一步研究。利用气相色谱测定氯氰菊酯的含量,采用稀释平板法测定菌株的细胞数量,确定降解菌株对氯氰菊酯的降解能力及生长情况。
1.4 菌株的鉴定
将分离得到的降解菌株命名为A-24,并对其进行菌落形态学、细胞形态学观察[13]及16SrDNA序列同源性比对分析,确定其分类地位。采用高盐法提取菌体DNA[14],扩增降解菌株16SrRNA基因序列。引物为16SrRNA基因序列通用引物[15],正向引物27F序列为5′-AGAGTTTGATCCTGGCTCAG-3′,反向引物1492R序列为5′-TACCTTGTTACGACTT-3′。扩增产物用AXYGEN核酸纯化试剂盒纯化回收,通过琼脂糖凝胶电泳检测回收的DNA片段纯度和大小(约1.5 kb),然后进行TA克隆,测序。TA克隆体系(5µL)为:pMD18-T 0.5μL,DNA片段2µL,Solution I(TaKaRa)2.5µL,16℃酶连过夜。将测序结果在Ez⁃Taxon(http://eztaxon-e.ezbiocloud.net/)上进行在线比对分析[16]。
1.5 菌株A-24降解氯氰菊酯与其生长关系的测定
挑取A-24单菌落接种至含20 mg·L-1氯氰菊酯的100 mL LB培养基中,30 ℃、180 r·min-1振荡培养至对数期,6000 r·min-1离心收集菌体,使用MSM洗涤菌体两次,最后用MSM重悬,调节菌体浓度为1.0×109CFU·mL-1,作为种子液备用。将1%的菌株A-24接种到菊酯降解培养基中,在30℃、180 r·min-1条件下培养,每12 h取样一次,测定培养液中氯氰菊酯的含量和菌株A-24的生长量(CFU·mL-1)。
1.6 不同碳源和氮源对菌株生长的影响
将菌株以2%接种量接种到100 mL基础盐培养基中,分别添加0.5%(V/m)的麦芽糖、糊精、蔗糖、葡萄糖、果糖和淀粉作为碳源,30 ℃、180 r·min-1振荡培养48 h,分别测定各样品在OD600处的吸光值,每个处理3次重复。
将菌株以2%接种量接种到100 mL基础盐培养基中,分别添加0.5%(V/m)的尿素、硝酸钾、牛肉膏、蛋白胨、酵母膏、亚硝酸钠、硫酸铵、硝酸铵作为氮源,30 ℃、180 r·min-1振荡培养48 h,分别测定各样品在OD600处的吸光值,每个处理3次重复。
1.7 菊酯降解特性研究
在菊酯降解培养基中,按2%接种量接入A-24菌株种子液,分别于20、25、30、35、42℃和45℃条件下,180 r·min-1摇床培养,48 h后取样检测菊酯残留量,计算降解率,确定温度对菌株降解联苯菊酯的影响。
在初始pH分别为5.0、6.0、7.0、8.0、9.0和10.0的MSM培养基中,加入20 mg·L-1的菊酯,按2%接种量接入菌株的种子液,于30℃、180 r·min-1摇床培养,48 h后取样检测菊酯残留量,计算降解率,确定pH对菌株降解菊酯的影响。设置空白对照。采用乙酸钠缓冲液调节pH 5.0、6.0,磷酸钠缓冲液调节pH 6.0~8.0,Tris-HCl缓冲液调节pH 8.0~10.0。
在添加氯氰菊酯终浓度分别为20、50、100 mg·L-1和150 mg·L-1的无机盐培养基中,按2%接种量接入A-24菌株种子液,于30 ℃、180 r·min-1摇床培养,48 h后取样检测菊酯残留量,计算降解率,确定初始氯氰菊酯浓度对菌株A-24降解率的影响。对照是添加相应二甲基亚砜溶剂到无盐培养基中,并在相同条件下培养。
在菊酯降解培养基中,分别按0.5%、1%、2%、5%和10%接种量接入A-24菌株种子液,于30℃、180 r·min-1摇床培养,48 h后取样检测菊酯残留量,计算降解率,确定接种量对菌株A-24降解氯氰菊酯的影响。
1.8 氯氰菊酯含量测定及降解产物检测
氯氰菊酯含量测定采用全量提取法:在20 mL培养基中加20 mL二氯甲烷,剧烈振荡3 min后,静置分层,取有机相经无水Na2SO4脱水,然后准确取1 mL有机相置于2 mL离心管中,并在通风柜内挥发后,重新定容到1 mL色谱纯正己烷中,气相色谱检测氯氰菊酯浓度。气相色谱检测条件:ECD检测器、SPB-5毛细管柱(30.0 mm×0.530 mm×1.5µm),进样口温度240℃,柱温240℃,检测器温度310℃,载气为氮气,流速为1 mL·min-1[17]。
降解产物检测采用全量提取法:准确取1 mL有机相置于2 mL离心管中,并在通风柜内挥发,最后定容到1 mL乙腈/水(60/40,V/V,用甲酸酸化pH为3.0)溶液中,采用高效液相色谱法对降解产物进行鉴定。高效液相色谱(HPLC)检测条件:液相色谱柱为C18反相柱,规格250 mm×4.6 mm;流动相为乙腈∶水(60∶40,V∶V);加入甲酸,pH调为3.0,柱温为30 ℃;流速1.0 mL·min-1;检测波长270 nm[17]。
2 结果与分析
2.1 菌株的分离筛选
从上海郊区某农药厂附近采集植物样品牛筋草,从其根茎中分离到1株降解氯氰菊酯的内生菌,命名为A-24。菌株A-24的菌落圆形隆起、奶油状、边缘整齐,其生理生化特征为:需氧,革兰氏染色呈阴性,氧化酶、脲酶和过氧化氢酶呈阳性,硝酸还原酶和淀粉水解酶呈阴性。
通过引物27F和1492R对菌株A-24的16SrRNA进行扩增,获得1398 bp的基因序列,将该序列提交到GenBank,登录号为MK454541。将菌株A-24的16S rRNA基因序列在数据库EzBilCloud中比对分析,结果显示菌株A-24与Achromobacter属亲缘关系最近,其中与Achromobacter xylosoxidans NBRC 15126T相似性达99.00%,与Achromobacter marplatensis B2T相似性达98.76%。运用MEGA5.0软件通过Neighbor-join⁃ing法对菌株A-24构建系统发育树(图1),结果表明,菌株A-24与菌株Achromobacter xylosoxidans NBRC 15126T位于同一分支。结合菌落形态特性、生理生化特征以及16SrRNA基因比对分析,菌株A-24初步鉴定为Achromobacter属。

图1 基于16SrRNA基因序列构建的菌株A-24系统发育树Figure 1 Phylogenetic tree constructed by the neighbor-joining analysis based on 16SrRNA gene sequences of strain A-24 and related species
2.2 菌株A-24以氯氰菊酯为唯一碳源的降解和生长曲线
氯氰菊酯的含量和菌株A-24的生长量结果如图2所示。菌株A-24在48 h内对20 mg·L-1氯氰菊酯的降解率为91.8%,72 h内完全降解氯氰菊酯。菌株A-24在降解氯氰菊酯的过程中能够利用其作为唯一碳源生长,菌体生长在12 h前为延滞期,12~60 h为对数期,由最初1.32×107CFU·mL-1增加至 6.92×107CFU·mL-1。表明菌株A-24能够降解氯氰菊酯,并能够利用氯氰菊酯作为碳源和能源生长。

图2 菌株A-24降解氯氰菊酯及其生长曲线Figure 2 The growth of stain A-24 and degradation of cypermethrin by A-24
2.3 不同碳源和氮源对菌株A-24生长的影响
各碳源对菌株A-24生长的影响结果如图3A。培养基MSM中添加果糖时菌株A-24在OD600处的吸光值最高,麦芽糖其次,葡萄糖最低。
各氮源对菌株A-24生长的影响结果如图3B。菌株A-24在OD600处的吸光值随着时间的增加而增加,有机氮源牛肉膏、蛋白胨和酵母膏培养基中A-24的吸光值高于尿素培养基,无机氮源硝酸钾、硝酸铵和硫酸铵培养基中的吸光值明显高于亚硝酸钠。
2.4 温度和pH对菌株A-24降解氯氰菊酯的影响
如图4A所示,菌株A-24在30℃时对氯氰菊酯的降解率最高,在25~42℃范围内,均能很好地降解氯氰菊酯,降解率均在75%以上;当温度在20℃时,菌株A-24对氯氰菊酯的降解率在60%以下;当温度在45℃时,菌株A-24对氯氰菊酯的降解率在40%以下。如图4B所示,菌株A-24在pH为7时对氯氰菊酯的降解效果最好,且与其他处理相比差异显著(P<0.05);在pH 7~8的范围内菌株A-24均能较好地降解氯氰菊酯;而当pH为5或10时,与其他pH值相比其降解能力明显下降,且差异显著(P<0.05),降解率低于60%。
2.5 初始氯氰菊酯浓度对菌株A-24降解的影响
如图5所示,当初始氯氰菊酯浓度≤50 mg·L-1时,菌株A-24对氯氰菊酯的降解都在70%以上;初始浓度控制在100 mg·L-1时,菌株A-24对氯氰菊酯的降解低于45%,且与20、50 mg·L-1处理差异显著(P<0.05),表明随着氯氰菊酯初始浓度的升高菌株A-24的降解率降低;当初始浓度为150 mg·L-1时,菌株A-24对氯氰菊酯降解率为30.85%,表明菌株A-24可耐受高浓度的氯氰菊酯。其助剂二甲基亚砜对菌株A-24的生长没有影响。

图3 添加不同碳源和氮源对菌株A-24生长的影响Figure 3 Effect of adding different carbon and nitrogen sources on the growth of strain A-24
2.6 接种量对菌株A-24降解氯氰菊酯的影响
对不同接种量条件下氯氰菊酯的降解效率的检测结果如图6所示。当接种量为0.5%、1%和2%时,氯氰菊酯48 h降解率分别为38.7%、67.2%和91.8%;当接种量为5%时,氯氰菊酯48 h的降解率即可达到99.45%;当接种量为10%时,36 h氯氰菊酯全部降解。结果表明,接种量对菌株A-24降解氯氰菊酯影响较大,随着菌株A-24接种量的增大,氯氰菊酯的降解效率逐渐增大,两者呈正相关关系。
3 讨论

图4 温度和pH对菌株A-24降解氯氰菊酯的影响Figure 4 Effects of temperature and pH on degradation of cypermethrin by strain A-24

图5 初始氯氰菊酯浓度对菌株A-24降解氯氰菊酯的影响Figure 5 Effect of initial concentration on degradation of cypermethrin by strain A-24
植物内生菌可以提高土壤中污染物的降解性能,以减轻农药对植物的毒害作用[12,18-20]。与动物不同,植物没有体细胞免疫,对于环境中的微生物,植物体是一个相对开放的空间,所以几乎所有的植物体内都含有内生菌[21]。污染物的降解过程是酶催化反应的过程,针对不同的污染物,微生物会分泌不同的酶参与反应,从而将复杂的农药结构降解为简单的结构[17,22-26]。冯发运[27]在植物小飞蓬体内分离出Crono⁃bactersp.植物内生菌XFP-gy,其5 d降解20 mg·L-1毒死蜱的降解率为69.59%,外加碳源的降解率可达98.0%。在韭菜体内分离出Sphingomonassp.植物内生菌HJY,其15 d内可代谢95.88%初始浓度为20 mg·L-1的毒死蜱,1%的外加葡萄糖可使其对毒死蜱的降解率提高到6 d 98.48%。刘爽[28]在看麦娘中分离筛选出降解菲的植物内生菌Pn2,经鉴定该菌株为Naxibactersp.,此内生菌72 h对初始浓度49.92 mg·L-1的菲降解率达98.78%。孙凯等[29]从小飞蓬和三叶草中分离筛选出能降解芘的内生细菌BJ03和BJ05,初步鉴定为Acinetobactersp.和Kocuriasp.,15 d 对 50 mg·L-1的芘降解率分别为65.0%和53.3%。封国君[30]分离到能降解二甲四氯的植物内生菌E41和E68,并研究了菌株的降解特性,鉴定了菌株降解二甲四氯的产物为4-氯-2-甲基苯酚。有关氯氰菊酯微生物降解菌已经有很多报道[17,31-33],但植物内生氯氰菊酯降解菌鲜有报道。
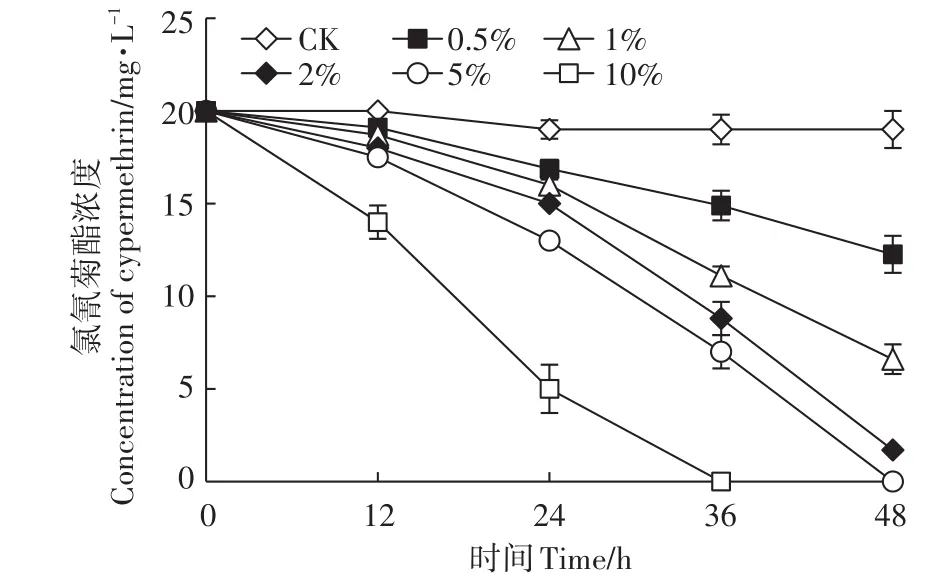
图6 接种量对菌株A-24降解氯氰菊酯的影响Figure 6 Effect of inoculation size on degradation of cypermethrin by strain A-24
本研究的结果表明碳源、氮源种类影响微生物的生长,虽然菌株A-24均能以葡萄糖、蔗糖、淀粉等为碳源生长,但在以果糖为碳源时,生长最快,以牛肉膏、蛋白胨、酵母膏为氮源时生长较快,说明只有添加适当的外加碳源、氮源,才能保证细胞的正常生长。有关微生物降解氯氰菊酯代谢途径的研究已经有报道。Wang等[17]推测了菌株JZ-1降解氯氰菊酯的途径,其可生成二氯菊酸和3-苯氧基苯甲醛,3-苯氧基苯甲醛再转化成3-苯氧基苯甲酸。为研究菌株A-24降解氯氰菊酯的代谢途径,在氯氰菊酯降解过程中定时取样,并利用HPLC检测其代谢产物。与标准品对照并根据其他菌株降解氯氰菊酯的代谢途径[17],将产物鉴定为3-苯氧基苯甲酸(3-PBA)。据此推测菌株A-24降解氯氰菊酯的途径为:氯氰菊酯首先通过酯键水解生成二氯菊酸和3-苯氧基苯甲醛,在脱氢酶的作用下,3-苯氧基苯甲醛生成3-PBA,然后在双加氧酶的作用下进一步降解(图7)。
本研究结果表明,植物内生菌株A-24的生长与降解对初始氯氰菊酯浓度、温度和pH的适应范围较宽,适合用于田间复杂多变的自然环境中菊酯污染的修复。因此深入研究菌株A-24降解氯氰菊酯机理,以及生物修复适用性等问题将是我们下一步研究的重点内容,这对植物内生细菌-植物联合修复有机污染具有现实指导意义。
4 结论
(1)从农药厂附近牛筋草中筛选到1株能够以氯氰菊酯为唯一碳源生长的高效降解菌A-24,革兰氏染色鉴定为阴性菌,经16SrDNA测序鉴定为Achro⁃mobacter属。
(2)在不同碳源、氮源条件下,菌株A-24的生长速率不同,以果糖为碳源时菌株A-24生长最快,麦芽糖其次,葡萄糖最慢。在有机氮源牛肉膏、蛋白胨、酵母膏培养基中A-24生长较快,其中无机氮源亚硝酸钠中最慢。
(3)菌株A-24在30℃时对氯氰菊酯的降解率最高,在pH 7时对氯氰菊酯的降解效果最好。当初始氯氰菊酯浓度≤50 mg·L-1时,菌株A-24对氯氰菊酯的降解率较高。随着菌株A-24接种量的增大,氯氰菊酯的降解效率逐渐增大。
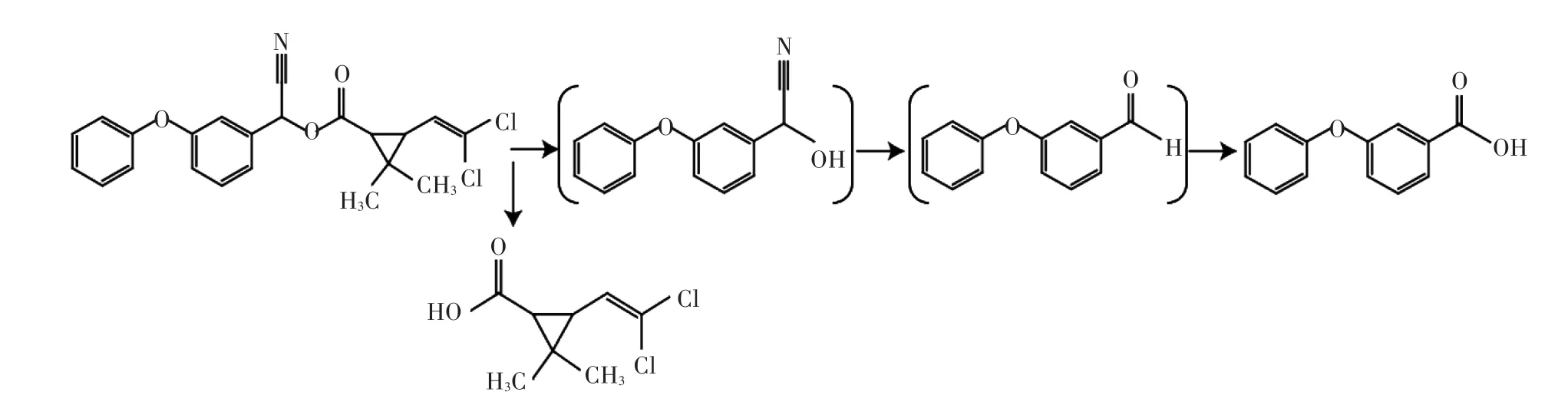
图7 推测菌株A-24降解氯氰菊酯的途径Figure 7 Proposed metabolic pathway of cypermethrin by strain A-24
