柴油尾气颗粒对秀丽隐杆线虫慢性毒性效应的初步研究
2020-02-21吴轩曾葭仪修光利
吴轩 ,曾葭仪,修光利 ,
1. 上海市环境保护化学污染物环境标准与风险管理重点实验室/华东理工大学资源与环境工程学院,上海 200237;2. 国家环境保护化工过程环境风险评价与控制重点实验室/华东理工大学资源与环境工程学院,上海 200237;3. 上海污染控制与生态安全研究院,上海 200092;4. 华东师范大学第二附属中学,上海 200241
柴油机具有高能效、高热效率、低成本等优点,在重型卡车、工程机械、船舶等领域得到了广泛的应用。根据生态环境部发布的《2018年中国机动车环境管理年报》,2017年全国柴油车保有量1956.7万辆,占汽车保有量的9.4%,虽然保有量低于汽油车,但其氮氧化物和颗粒物排放量分别占机动车总排放量的70%和90%以上。2012年国际癌症研究机构(IARC)将柴油机尾气确定为人类致癌物(Kurt,2012)。柴油机尾气颗粒(diesel exhaust particles,DEP)是由柴油不完全燃烧产生的,70%的粒径小于0.3 µm,属于典型的细颗粒物,对室外空气PM2.5有重要贡献。柴油机尾气颗粒(DEP)由碳核和被其表面吸附的各种物质如可溶性有机物(Soluble Organic Fraction,SOF)、重金属、硫酸盐等组成,其中90%的可溶性有机物都具有致癌、致畸、致突变性(刘树模等,2007),对人类身体健康危害极大。DEP能长时间在大气环境中悬浮,且排放源距人类较近,可通过呼吸作用进入人类呼吸道及肺部并沉积,造成肺部炎症反应(Sundeep et al.,1999)。除了肺部急性炎症外,也有研究表明柴油机尾气颗粒(DEP)与很多疾病密切相关,如神经学效应(Shannon,2011)、呼吸系统疾病(Ristovski et al.,2012;Inoue et al.,2007)、心血管系统疾病(Suleimani et al.,2017)及生殖健康及子代发育的影响等(Chunmei et al.,2009;方芳等,2008)。
秀丽隐杆线虫(Caenorhabditis elegans)作为模式生物已被广泛应用于水体(王晓祎等,2009),土壤(Hoss et al.,2009)和大气(王云彪等,2012)等环境介质毒理安全性评价。秀丽隐杆线虫体长约1 mm,呈透明状,其繁殖率高,寿命相对较短,仅3周左右,实验周期短,实验成本低,并且线虫的基因组已被完全测序,就人类基因组而言同源性可高达 60%—80%(Mano et al.,2007;Corsi,2006),是分子生物学中非常重要的工具(Brenner,1974;Chen et al.,2013),为化学品毒性效应研究提供了一个有效的评价载体。如今秀丽隐杆线虫的运动行为、生长发育、生殖水平、寿命子代数目、基因表达、ROS水平等指标已被广泛运用于如杀虫剂等内分泌干扰物(Zhou et al.,2016;何雪珠等,2018;金司仪等,2018)、重金属、纳米材料(Hongbo et al.,2009;Meyer et al.,2010;Khare et al.,2011)和有机农药(Dengg et al.,2004)的生态毒理学评估。
近年来已有研究(张文静等,2019)基于秀丽隐杆线虫对 PM2.5进行有效的快速风险评价,通过模式生物秀丽隐杆线虫的应激响应,发现 PM2.5可能对人体行为、免疫及生殖等方面都有不同程度的影响。而作为 PM2.5的重要组分,柴油机尾气颗粒能否影响机体运动能力及生长发育尚不明确,且缺乏其对机体生化指标影响的报道。研究报道环境空气中 DEP 的浓度范围为 10—5570 μg·m-3(Ghio et al.,2012),人群接触DEP往往是长期且微量的,现有研究仅局限于高浓度短期急性暴露下 DEP的毒性,仍缺乏对其环境浓度下慢性毒性效应的探究。本文通过监测低浓度柴油机尾气颗粒(DEP)慢性(10 d)暴露下线虫的生理指标和生化指标,如头部摆动频率、体长、体宽、氧化应激、细胞凋亡水平和脂褐素水平来探讨柴油尾气颗粒影响下线虫的生理行为响应,从而进行柴油尾气颗粒的毒性效应评价。
1 材料与方法
1.1 供试药剂及仪器
试剂药品:SRM2975标准品(美国国家标准与技术研究院),N2秀丽隐杆线虫(野生型),2, 7-二氯二氢荧光素二乙酸酯(H2DCF-DA,纯度≥97%,阿拉丁试剂上海有限公司),吖啶橙(C17H19N3,纯度≥99%,阿拉丁试剂上海有限公司),大肠杆菌菌株(E.coli OP50),琼脂(西班牙 BIOWEST 公司),酵母蛋白胨(英国OXOID公司),胆固醇、二甲基亚砜、无水乙醇、氯化钠、氯化钾、次氯酸钠、无水氯化钙、无水硫酸镁等化学药品均为分析纯,购自国药集团化学试剂有限公司。
仪器设备:SZM45B1型体视显微镜(舜宇光学科技(集团)有限公司),Nikon Eclipse 80i荧光显微镜(尼康仪器(上海)有限公司),生化培养箱(上海一恒科学仪器有限公司),VD-650型桌上式洁净工作台(浙江苏净净化设备有限公司),LDZM立式高压蒸汽灭菌锅(上海申安医疗器械厂)。
1.2 线虫培养与同步化
用移液枪吸取2 mL无菌K-medium从NGM培养基表面冲洗大量处于产卵期的秀丽隐杆线虫[雌雄同体株,美国线虫遗传中心(CGC)],转移至离心管于3000 r·min-1下离心2 min,弃去上清液后加入1 mL新鲜配制的裂解液(NaOH 1 g,NaClO 1 mL,K-medium 14 mL),上下振荡摇匀,裂解3 min后于3000 r·min-1下离心2 min,弃去上清液,用无菌的K-medium反复清洗底部沉淀3次,充分洗去裂解液成分。将裂解得到的虫卵转移到涂有 E. coli OP50的NGM培养基上,放置于20 ℃恒温培养箱下孵化并培养48 h,得到同步化的L4期幼虫。
1.3 DEP的表征方法
利用扫描电子显微镜(SEM)观察柴油机尾气颗粒物(DEP)粉末状态时的表面形态。用非常窄的电子束来回扫描样品,并且通过样品和电子束的互相作用,从而形成各种效应,主要为样品的二次电子发射效应。
1.4 染毒液配制及染毒方法
由于柴油尾气颗粒SRM2975颗粒难溶于水,故选用二甲基亚砜(DMSO)作为SRM2975颗粒的助溶剂,称取0.01 g SRM2975颗粒于100 mL容量瓶,以DMSO定容,配制成浓度为100 mg·L-1的染毒母液。为保证空白对照组和暴毒组的DMSO浓度保持一致,接下来的实验浓度采用等梯度稀释法实现,最终的DMSO质量分数为0.1%。根据环境中DEP的质量浓度范围,以0.1 mg·L-1为染毒浓度范围的中值,向低剂量组和高剂量组延伸,设置染毒液质量浓度分别为 0(对照)、0.001、0.01、0.1、1 mg·L-1。
暴毒实验使用6孔培养板,每孔加入上述同步化培养到L4期的秀丽隐杆线幼虫及10 mL不同浓度的染毒液,放置于20 ℃恒温培养箱染毒10 d,每隔24 h更换染毒液并加入100 μL E. coli OP50。暴毒结束后收集 6孔培养板内的线虫,用无菌K-medium清洗3次用于后续指标测定。
1.5 DEP在秀丽隐杆线虫体内的分布情况
暴毒结束后,向经不同浓度组暴毒后并清洗完毕的线虫中加入 100 μL 60 μmol·L-1的左旋咪唑溶液,待麻醉1 min后用移液枪吸取适量线虫至NGM固体培养基上,在体视显微镜下观察并拍摄线虫的身体形态。
1.6 秀丽隐杆线虫生理指标的测定
1.6.1 头部摆动频率测定
根据文献报道的测定方法(Tsalik et al.,2003),将经不同浓度组暴毒后并清洗完毕的线虫转移至NGM固体培养基上,待其恢复1 min后,于体视显微镜下观察并记录其20 s内头部摆动的次数(线虫头部从一侧摆到另一侧再摆回此侧),各浓度组至少记录30条秀丽隐杆线虫。
1.6.2 体长体宽测定
根据文献报道的测定方法(周栋,2016),将经不同浓度组暴毒后并清洗完毕的线虫置于 70 ℃水浴中45 min,烫死的线虫呈直线状态,在体视显微镜下观察拍照,结合显微镜微尺和图像分析系统(ipwim 32软件)处理记录线虫身体的长度和宽度,各浓度组至少记录30条秀丽隐杆线虫。
1.7 秀丽隐杆线虫的生化指标的测定
1.7.1 活性氧自由基测定
根据文献报道的测定方法(周栋,2016),向经不同浓度组暴毒后并清洗完毕的线虫中加入1 mL 2,7-二氯二氢荧光素二乙酸酯(H2DCFDA),放置于20 ℃恒温培养箱培养染色2 h,然后反复清洗3次去除荧光染剂成分。再加入 100 μL 60 μmol·L-1的左旋咪唑溶液,待麻醉1 min后用移液枪吸取适量线虫于琼脂糖垫上,于Nikon Eclipse 80i型荧光显微镜下观察每组线虫荧光并捕捉图像,滤镜选择FITC。运用 ImageJ软件处理计算线虫的平均荧光强度值,反映线虫的 ROS水平,每个浓度组处理15条线虫。
1.7.2 脂褐素测定
根据文献报道的测定方法(周栋,2016),向经不同浓度组暴毒后并清洗完毕的线虫中加入100 μL 60 μmol·L-1的左旋咪唑溶液,待麻醉 1 min后用移液枪吸取适量线虫于琼脂糖垫上,于Nikon Eclipse 80i型荧光显微镜下观察每组线虫肠道的自发荧光并捕捉图像,滤镜选择 UV-2A。运用ImageJ软件处理计算线虫肠道的平均荧光强度值,反映线虫体内脂褐素积累水平,每个浓度组处理15条线虫。
1.7.3 细胞凋亡测定
根据文献报道的测定方法(周栋,2016),向经不同浓度组暴毒后并清洗完毕的线虫中加入 1 mL 吖啶橙溶液(25 μg·mL-1),放置于 20 ℃恒温培养箱培养染色2 h,然后反复清洗3次去除吖啶橙成分。再加入 100 μL 60 μmol·L-1的左旋咪唑溶液,待麻醉1 min后用移液枪吸取适量线虫于琼脂糖垫上,于Nikon Eclipse 80i型荧光显微镜下观察每组线虫荧光并捕捉图像,滤镜选择FITC。运用 ImageJ软件处理计算线虫的平均荧光强度值,反映线虫的细胞凋亡水平,每个浓度组处理15条线虫。
1.8 数据分析
运用统计学软件SPSS 22.0进行实验数据统计分析,多组比较采用方差齐性检验和单因素方差分析(One-way ANOVA)中的事后多重比较Dunnett test,所有数据均以Mean±SEM的形式表示,P<0.05认为差异显著,具有统计学意义。
2 结果
2.1 DEP的组分及表征
由于采样获取的柴油机尾气颗粒(DEP)来源具有不稳定性,对实验结果有一定的影响,本研究中使用标准参考物质进行分析。SRM2975是柴油机尾气颗粒的标准参考物质,购自美国国家标准与技术研究院,是从专为柴油动力叉车设计的过滤系统中收集的,其具体组分见标准物质说明书。
利用扫描电子显微镜(SEM)对柴油尾气颗粒进行形貌表征。柴油尾气颗粒(SRM2975)的检测结果如图1所示,SRM2975主要以灰黑色存在,结构近似球形,表面呈现疏松多孔的形貌,易吸附可溶性有机物、重金属及硫酸盐等有毒有害物质。

图1 不同放大尺寸SRM2975的扫描电镜图Fig. 1 Representative scanning electron micrographs of SRM2975
2.2 DEP在线虫体内的分布
DEP慢性暴毒后颗粒物在线虫体内的分布情况如图2B所示,与对照组比较,经过高浓度(1 mg·L-1)染毒液10 d的慢性暴毒后,线虫的咽部和肠道可以明显观察到DEP的累积,而低、中浓度组(0.001、0.01、0.1 mg·L-1)的线虫体内均未观察到DEP的明显分布。通过图2A观察到,经过亚急性(72 h)暴毒后,DEP在线虫体内也存在累积情况,主要分布在肠道后部,与慢性暴毒结果相比不明显。
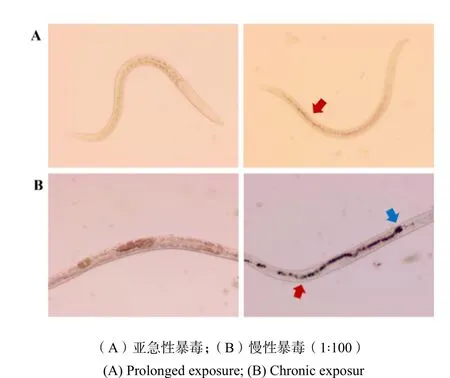
图2 柴油机尾气颗粒在秀丽隐杆线虫体内的分布情况Fig. 2 Distribution of diesel exhaust particles in C. eleganse
2.3 DEP对秀丽隐杆线虫生理指标的影响
2.3.1 DEP对线虫头部摆动频率的影响
DEP慢性暴毒对线虫头部摆动频率的影响如图3所示,经DEP染毒液10 d的慢性暴毒后,与对照组相比,最高浓度组(1 mg·L-1)的线虫头部摆动频率明显降低 18.8%,有极显著性差异(P<0.01),说明DEP对线虫有神经系统毒害。而低、中浓度组(0.001、0.01、0.1 mg·L-1)对其头部摆动频率影响不大,与对照组相比有小幅度上升,不具有显著性差异。
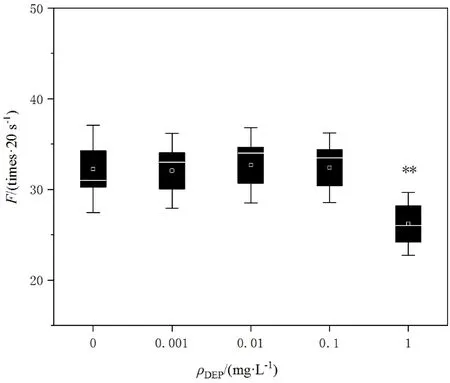
图3 DEP对秀丽隐杆线虫头部摆动频率(F)的影响Fig. 3 The effects of DEP on the head swing frequency(F) of C. elegans
2.3.2 DEP对线虫体长体宽的影响
DEP慢性暴毒对线虫体长体宽的影响如图4所示,经DEP染毒液10 d的慢性暴毒后,最高浓度组(1 mg·L-1)的线虫平均体长为548.1 µm,平均体宽为23.0 µm,与对照组平均体长621.3 µm和体宽25.1 µm相比分别明显降低了11.8%和8.5%,有极显著性差异(P<0.01)。而低、中浓度组(0.001、0.01、0.1 mg·L-1)处理后线虫的平均体长分别为690.7、658.9、630.2 µm,平均体宽分别为 27.7、27.5、26.5 µm,与对照组相比体长分别上升11.1%、6.0%和1.5%,体宽分别上升10.4%、9.6%和 5.6%,有显著性差异(P<0.05)。
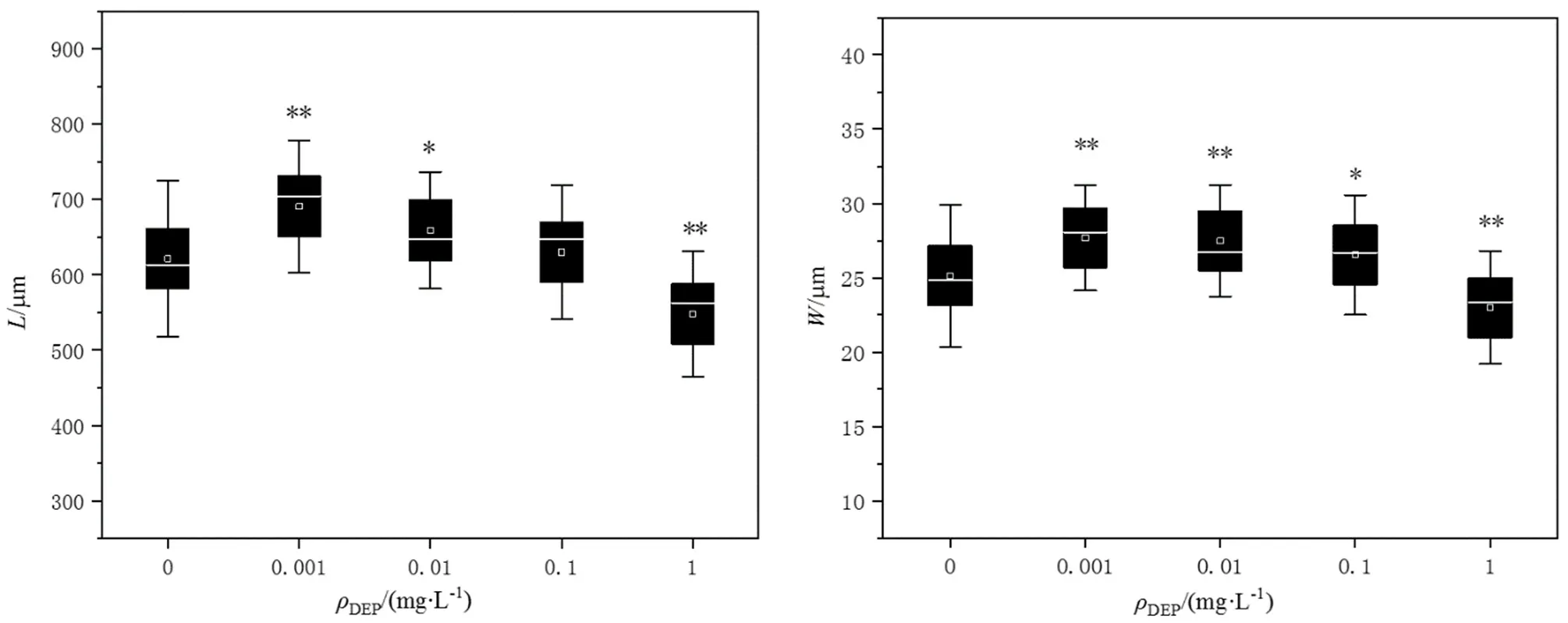
图4 DEP对秀丽隐杆线虫体长(L)和体宽(W)的影响Fig. 4 The effects of DEP on the body length (L) and width (W) of C. elegans
2.4 DEP对秀丽隐杆线虫生化指标的影响
2.4.1 DEP对线虫活性氧自由基水平的影响
DEP慢性暴毒对线虫体内活性氧自由基水平的影响如图5所示,经DEP染毒液10 d的慢性暴毒后,与对照组相比,高浓度组(1 mg·L-1)的线虫体内 ROS水平升高了 10.2%,中浓度组(0.1 mg·L-1)的线虫ROS水平下降了14.1%,具有显著性差异(P<0.05)。
2.4.2 DEP对线虫体内脂褐素的影响
DEP慢性暴毒对线虫体内脂褐素水平的影响如图5所示,经DEP染毒液10 d的慢性暴毒后,与对照组相比,高浓度组(1 mg·L-1)及中浓度组(0.1 mg·L-1)的线虫的肠道自发荧光分别增加了6.2%和11.4%,具有显著性差异(P<0.05)。
2.4.3 DEP对线虫细胞凋亡水平的影响
DEP慢性暴毒对线虫细胞凋亡水平的影响如图5所示,经DEP染毒液10 d的慢性暴毒后,与对照组相比,高浓度组(1 mg·L-1)的线虫细胞凋亡水平上升 1.8%,无显著性变化,中浓度组(0.1 mg·L-1)下降了 4.4%,具有显著性差异(P<0.05)。
3 讨论
本研究利用秀丽隐杆线虫探究了柴油尾气颗粒物(DEP)对生物体的慢性毒性效应。通过体视显微镜观察到在经高浓度(1 mg·L-1)染毒液10 d的慢性暴毒后,DEP主要分布在线虫的咽部和肠道中,但在低、中浓度组的线虫体内未发现明显的DEP生物富集现象。根据文献报道,外源物质通过摄食行为进入线虫体内,经消化道至排出,停留时间一般不超过6 s。因此初步认定线虫通过摄食行为将DEP一同摄入体内,在低浓度条件下以及亚急性暴露后,吞食的DEP通过排泄行为及时排出体内,而在高浓度慢性暴露条件下,摄入颗粒过多,超过体内的自净能力,以致DEP无法正常代谢排出,堆积在咽部和肠道。有研究发现粒径较大的 GO纳米颗粒主要分布在线虫的咽部和肠道,而颗粒较小的GODs纳米颗粒(10—20 nm)分布在线虫的全身器官(李平,2017)。本实验中未发现 DEP在除咽部和肠道外的其他器官有富集,可能是因为DEP颗粒大小在20—50 nm之间,无法穿过肠部屏障进入其他部位。此外,DEP也可能很难通过角质层及阴户等其他方式进入线虫体内。因此,认为DEP主要是通过线虫的摄食行为进入其咽部和肠道,并在体内富集,具有产生毒性效应的潜力。
头部摆动频率是反映线虫运动行为的基本指标,而线虫的运动行为与其神经系统基本功能息息相关,有研究提出秀丽隐杆线虫的运动行为可以作为秀丽线虫神经毒性效应的量化指标(Anderson et al.,2004)。线虫的神经元可按功能分为三类:感觉神经元、运动神经元以及中间神经元,其中运动神经元分别控制不同部位,如头部、身体的肌肉细胞,感觉神经元将外界刺激转化为神经冲动后依次传递,在信号蛋白的协助下形成突触,进一步发挥运动神经功能(Loria et al.,2004)。本实验中高剂量组的DEP对线虫运动行为的影响可能由于DEP被摄入体内,刺激干扰信号蛋白的正常合成与代谢,进而导致突触功能与运动神经功能无法正常发挥。而低中浓度组出现的线虫头部摆动频率变化不大甚至小幅度上升的现象可能是微量DEP进入线虫体内,小幅度刺激其进行觅食等行为,从而导致头部摆动频率小幅度升高。本结果提示秀丽隐杆线虫长期接触DEP可能造成一定的运动神经损害。
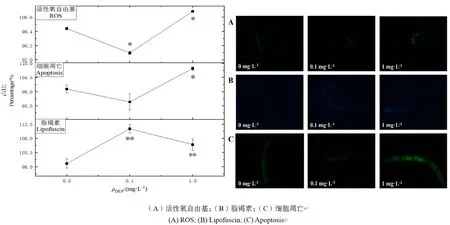
图5 DEP慢性暴露对秀丽隐杆线虫生化指标的影响及其代表性荧光图片Fig. 5 The effect of DEP chronic exposure on the bichemical indicators and its representative fluorescent pictures
体长和体宽是衡量线虫生长发育情况的重要指标,本实验结果表明,DEP会降低线虫的个体发育速率,对其具有生长发育毒性。结合不同剂量的DEP在线虫体内的分布情况分析,低、中浓度条件下(0.001、0.01、0.1 mg·L-1)未观察到 DEP在线虫体内的累积,微量DEP进入线虫体内可能会对其产生刺激,加速其觅食行为,食物摄取量较对照组增大,从而导致其体长、体宽高于对照组,生长发育优于对照组。而高浓度条件下(1 mg·L-1)DEP显著富集于咽部和肠道,不仅会影响线虫的摄食行为导致其食物摄取量变少,积累在肠道的颗粒还可能损害肠壁细胞,影响肠道对营养物质的吸收和贮存,降低线虫免疫力,导致线虫生长发育缓慢。Wu et al.(2013)研究发现氧化石墨稀(Graphene oxide)纳米颗粒对线虫肠细胞造成直接损伤,并能损害控制排泄行为的神经元,导致线虫生长发育缓慢及畸形。在基于其他受试生物如小鼠、斑马鱼等的 DEP毒性研究中也有相似的结论,如Hougaard et al.(2008)发现了DEP会导致小鼠的早期发育缓慢,体重变轻。Wang et al.(2019)以线虫为模式生物的研究也发现,100 mg·L-1DEP暴露72 h后线虫的体长与对照组相比显著下降,与本研究的结果一致。
活性氧自由基(ROS)是反映生物体是否受到氧化损伤的重要指标。当生物体受到外部刺激时,过量的 ROS会使生物体处于氧化应激的状态,对脂质、蛋白质及DNA等细胞大分子造成损害,是造成细胞凋亡和肠道衰老的重要因素。肠道的自发荧光强度代表着脂褐素溶酶体沉积物水平,是氧化损伤和细胞自噬的产物,可以反映线虫的衰老程度和体内氧化损伤程度(Yu et al.,2016)。细胞凋亡是生物体为了适应生存环境,受基因调控的细胞主动争取死亡的过程,具有重要的生物学意义和复杂的分子生物学机制(Vaux et al.,1999),能作为毒理检测的早期预警指标。本实验中,低浓度组(0.1 mg·L-1)线虫体内ROS水平和细胞凋亡水平较对照组均有所降低,而高浓度(1 mg·L-1)的DEP显著提高了线虫体内的 ROS水平和细胞凋亡水平。本研究中高浓度组线虫头部摆动频率降低,生长发育受到抑制,与其体内 ROS水平及细胞凋亡程度密不可分。大量文献表明,正常细胞的过早凋亡会对生物体的生理水平造成负面影响,本研究中线虫的生理指标和生化指标结果也具有相关性。1 mg·L-1的DEP使线虫体内的脂褐素水平与对照组相比提高6.2%,而浓度为0.1 mg·L-1的DEP使线虫体内的脂褐素水平提高了11.4%,表明DEP能够诱导线虫肠道的衰老。Yu et al.(2011)研究发现经Al2O3-NPs慢性暴露后线虫肠道脂褐素的积累主要是由于ROS的大量产生,但在本研究中未发现ROS水平与脂褐素积累的明显相关性,DEP诱导线虫肠道老化的机理有待进一步研究。
4 结论
综上所述,柴油尾气颗粒物的长期暴露会在秀丽隐杆线虫体内的富集,影响其运动行为、抑制其生长发育,具有调控线虫体内的氧化应激和细胞凋亡的作用,并能诱导其肠道老化,具有毒性效应。
