肉桂油对采后病原菌Penicillium expansum的抑制作用研究
2020-02-19孙杨莹陈远志罗华斌林敏梨
孙杨莹,陈远志,蔡 叶,罗华斌,林敏梨,周 婷
(杭州师范大学生命与环境科学学院,浙江 杭州 311121)
0 引言
Penicilliumexpansum俗称青霉菌,属于菌囊门不整囊菌纲曲霉目,是梨果类最主要的采后病原菌之一,宿主还包括枇杷、山楂、桃、葡萄、樱桃、番茄、柑橘、冬枣等多种水果[1],该菌不仅导致果实腐烂,影响果实的风味,还能分泌具有致癌作用的棒曲霉素(Patulin),阻碍果实衍生产品后续加工,严重危害消费者健康[2].2017年,P.expansum主要宿主苹果和梨的全国产量分别为4 139及1 640万吨,两者总产量约占全国水果总产量的23%(第三次农业普查修订).因此,加强对P.expansum的防治,开发更为有效的鲜果贮藏保鲜策略具有重要的应用价值及现实意义.
目前,对P.expansum的防治主要包括低温、农药、生物防治等.低温贮藏所需能耗较大,许多鲜果在低温下也容易发生冷害或冻害,且P.expansum属于嗜冷性真菌,孢子抗逆性强,耐低温[3].农药是目前控制青霉属致病菌的最重要的方法,但过量使用会污染环境并导致抗性菌株产生[4-5].生物防治是拮抗菌(多为细菌或酵母菌)通过营养竞争或菌丝间直接拮抗进行病害防治的方法[6].生物防治受环境条件(温度、湿度、空气成分、营养成分等)影响较大,应用条件苛刻.此外,诱导采后果实抗性的策略也被广泛认可,例如热激[7]、射线照射[8]、喷施氨基丁酸[9]等.但由于成本及其使用范围限制,这些方法尚无法完全替代人工合成杀菌剂.
在此背景下,植物提取物、精油、抗真菌多肽、可食用膜等天然抑菌物质的相关研究也取得很大进展[10-13].肉桂油(Cinnamon oil)为樟科植物肉桂(CinnamomumcassiaPresl)的枝、叶经蒸馏所得的芳香油,微黄或棕黄色澄清液体,气味芳香辛辣、味甜、微溶于水,是一种重要的醛类芳香原料,主要成分为肉桂醛(苯基丙烯醛),含有羰基和苯环外共轭双键,化学性质活跃.此外还含有苯甲醛、水杨醛、苯乙酮、苯乙醇、氢化肉桂醛、反式肉桂醛、乙酸肉桂酯、α-甲氧基肉桂醛、苯乙酸苄酯等多种成分[14-15].具有抗心血管疾病、抗氧化、降血糖、消炎等多种药理活性[16-18],并对病原真菌、细菌具有较强的抑制作用[19-21].近年来,肉桂油用于采后病害的研究已取得了很多成果,对Colletotrichum属、Fusarium属、Rhizopus属、Aspergillus属、Cladosporiumcladosporiodes、Geotrichumcandidum以及Botrytiscinerea等采后病原真菌均有显著的抑制作用[22-25].然而,这些研究多集中于防治效果,而对采后主要病原菌P.expansum细胞发育及次级代谢物合成的影响还鲜有报道,其明确的抑菌机制尚缺乏系统研究.
采后病害的防治首先建立在明确病原菌种类、分类地位及其生物学特性,尤其是对病原菌的生长发育规律(生活史)的了解,从而明确病害发生、发展规律(侵染循环)及其致病机理,在此基础上才能针对性采取防病抗病措施.病原菌的生长发育决定着病原菌的侵染结构形成、致病因子产生、定殖以及扩散,这一过程是通过一系列基因复杂的时序性表达完成的.在此背景下,本研究利用不同浓度肉桂油处理P.expansum,验证其体外及活体的抑菌效果,评估其对真菌毒素Patulin合成及其相关基因表达的影响,并对病原菌转录组水平的变化进行了分析,研究结果有助于阐明肉桂油在分子水平上的抑菌机制及其对病原菌次级代谢物合成的影响,为肉桂油生产实践中的应用及优化防病抗菌措施提供理论基础.
1 材料与方法
1.1 实验材料
Penicilliumexpansum分离自典型青霉病发病苹果果实,在PDA(Potato Dextrose Agar)培养基(BD,美国)上培养备用;红富士苹果(MalusdomesticaBorkhcv. Red Fuji)和白梨(PyrusbretschneideriRehd.)购自杭州下沙本地市场;RNeasy Plant Mini Kit(Cat.74904)购自德国Qiagen公司;Fast Quant RT Kit(Cat. KR106)购自北京天根生化科技有限公司;2×Ultra SYBR mixture(With ROX)(Cat. CW0957)购自江苏康为世纪生物科技有限公司;定量引物由美国Invitrogen公司合成;肉桂油(Cat. A501966)、Patulin标准品(Cat.A606706)及其他主要试剂购自上海生工生物工程有限公司.
1.2 肉桂油对P. expansum发育的影响
在100 mL PDB(Potato Dextrose Broth)中加入适量P.expansum孢子悬浮液和肉桂油,调节孢子终浓度至1.0×106孢子/mL,肉桂油最终体积分数分别为0、0.005%、0.01%、0.02%和0.03%.在25 ℃振荡(200 r/min)培养16 h,分别在10、12、14、16 h统计孢子萌发率,当芽管长度大于等于孢子半径时视为孢子萌发.在培养12~16 h期间,每小时统计0.02%肉桂油处理组孢子的芽管长度.每组随机统计100个孢子,重复3次,整个实验重复2次.
将100 μL 1.0×106孢子/mLP.expansum孢子悬浮液涂布于PDA培养基上,获取直径为0.5 cm的菌饼.放置于含有25 mL PDA培养基(含0或0.02%肉桂油)的培养皿中央,每个处理包含10个重复,25 ℃静置培养9 d,每天统计病斑直径.
在100 mL PDB(Potato Dextrose Broth)中加入P.expansum孢子悬浮液和适量肉桂油,调节孢子终浓度至1.0×106孢子/mL,使肉桂油体积分数分别为0和0.02%,25 ℃静置培养.分别在培养后3、6、9 d离心收集上清液和菌丝.菌丝用于后续Patulin合成相关基因的表达分析,上清液用于Patulin检测.首先利用0.22 μm滤器(Albet,西班牙)对上清液进行过滤,然后取10 μL进行反相高效液相色谱分析(Waters,美国),层析柱为Waters XTerra RP18 column(Waters,美国),流动相为5%的乙腈,参数设置如下:流速0.8 mL/min,柱温18 ℃,检测波长276 nm.利用Patulin标准品绘制标准曲线.
1.3 Patulin合成相关基因表达分析
将上述收集的菌丝样品在液氮中研磨,使用RNeasy Plant Mini Kit提取样品总RNA,并利用Fast Quant RT Kit合成cDNA的第一链.Patulin合成相关基因(PatA、PatB、PatD、PatG、PatH、PatI、PatK、PatL和PatN)的定量引物序列参考Tannous等[26].利用2×Ultra SYBR mixture及CFX96- real Time System(Bio-Rad,美国)进行基因定量表达分析.反应体系为20 μL,运行参数如下:95 ℃/15 s,58 ℃/15 s,72 ℃/20 s,40次循环.监测SYBR Green的荧光变化及Ct(Threshold cycle)值,以β-tubulin基因作为内参,利用2-△Ct表示靶基因的相对表达量.每个处理的每个基因重复检测3次,整个实验重复1次.
1.4 肉桂油对苹果和梨果实青霉病的防治
在100 mL PDB中加入适量P.expansum孢子悬浮液和肉桂油,调节孢子终浓度至1.0×105孢子/mL,肉桂油体积分数分别为0和0.04%,在25 ℃振荡(200 r/min)培养6 h后备用.挑选大小均一、成熟度接近、无机械损伤及病虫害的苹果和梨果实,在2%次氯酸钠中浸泡2 min,清水冲洗后室温风干.每组处理包含30个果实,利用无菌接种针在果实赤道部分形成0.3 cm深的伤口,接入10 μL上述制备的孢子悬浮液,果实在25 ℃培养7 d,每日统计发病率及病斑直径.
1.5 转录组分析
在100 mL PDB培养基中加入适量P.expansum孢子悬浮液和肉桂油,调节孢子终浓度至1.0×106孢子/mL,肉桂油体积分数分别为0和0.02%,在25 ℃振荡(200 r/min)培养6 h,离心收集孢子,无菌水漂洗2次后,液氮速冻,放置于-80 ℃超低温冰箱中待用.样品总RNA的制备、文库构建、上机测序及转录组分析(包含一次生物学重复)由派诺森生物科技有限公司提供技术服务,平台为IlluminaNextSeq500测序系统.原始数据通过FastQC(http://www.bioinformatics.babraham.ac.uk/projects/fastqc/)进行质量过滤质控分析,利用bowtie2/tophat2及NCBInr(http://www.ncbi.nlm.nih.gov/)数据库进行基因组比对及基因注释,通过HTSeq(http://www-huber.embl.de/users/anders/HTSeq)统计比对到基因上的数值,然后通过DESeq(http://www-huber.embl.de/users/anders/DESeq)分析表达差异基因,最后按照表达量倍数差异(≥2或≤0.5)和表达差异显著性P-value筛选出差异表达基因,同时利用Gene Ontology Consortium数据库(http://www.geneontology.org/)和Kyoto Encyclopedia of Genes and Genomes数据库(http://www.genome.jp/kegg/)对差异表达基因进行GO和KEGG功能注释和富集分析.
1.6 统计分析
使用SPSS软件(SPSS,USA)进行数据统计,利用One-way ANOVA和Duncan’s multiple range test进行样本间差异显著性分析,P<0.05时表示差异显著.
2 结果与分析
2.1 肉桂油对P. expansum的抑制作用
利用不同浓度的肉桂油处理P.expansum孢子,经过12 h的培养,对照组孢子的萌发率超过85%,而体积分数为0.02%肉桂油处理组的孢子萌发率低于10%,随着肉桂油浓度的进一步增加,孢子萌发率继续下降,因此确定肉桂油的抑菌作用是浓度依赖型,并采用0.02%作为后续研究的工作浓度(图1a,图2a).P.expansum孢子芽管在0.02%肉桂油处理下,伸长速度显著下降,培养16 h后,处理组的芽管长度仅为对照组的1/2(图1b).此外,P.expansum菌落扩展速度和产孢量也明显下降(图1c,图2b).
2.2 肉桂油对P. expansum毒素合成及相关基因表达的影响
Patulin是P.expansum重要的次级代谢物之一,在0.02%肉桂油处理下,Patulin的合成显著下降,培养9 d后,处理组的Patulin产量仅为对照组的40%(图1d).Patulin的合成涉及大量的酶促反应及相关基因的表达调节,在0.02%肉桂油的胁迫下,PatB、PatG、PatH和PatN的表达显著下调,PatL的表达显著上调,PatA的表达呈现先上升后下降的趋势,而PatD、PatI和PatK的表达在前期不受影响,随着肉桂油处理时间的增加而显著下降(图3).
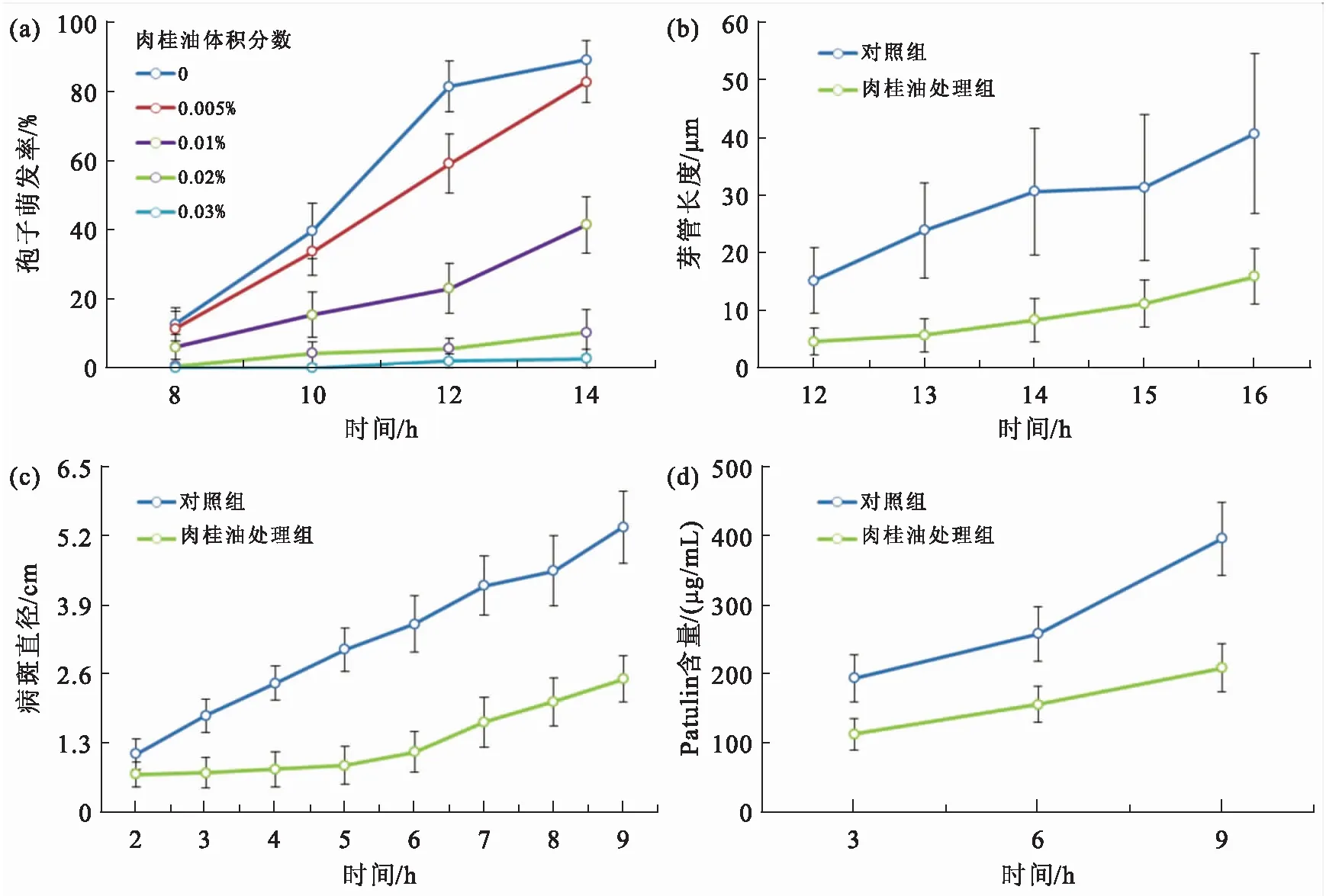
图1 肉桂油对P. expansum孢子萌发率(a)、芽管伸长(b)、菌落扩展(c)及Patulin合成(d)的影响Fig.1 Effects of cinnamon oil on spore germination rate (a), germ tube elongation (b), colony expansion (c) and patulin biosynthesis (d) of P. expansum
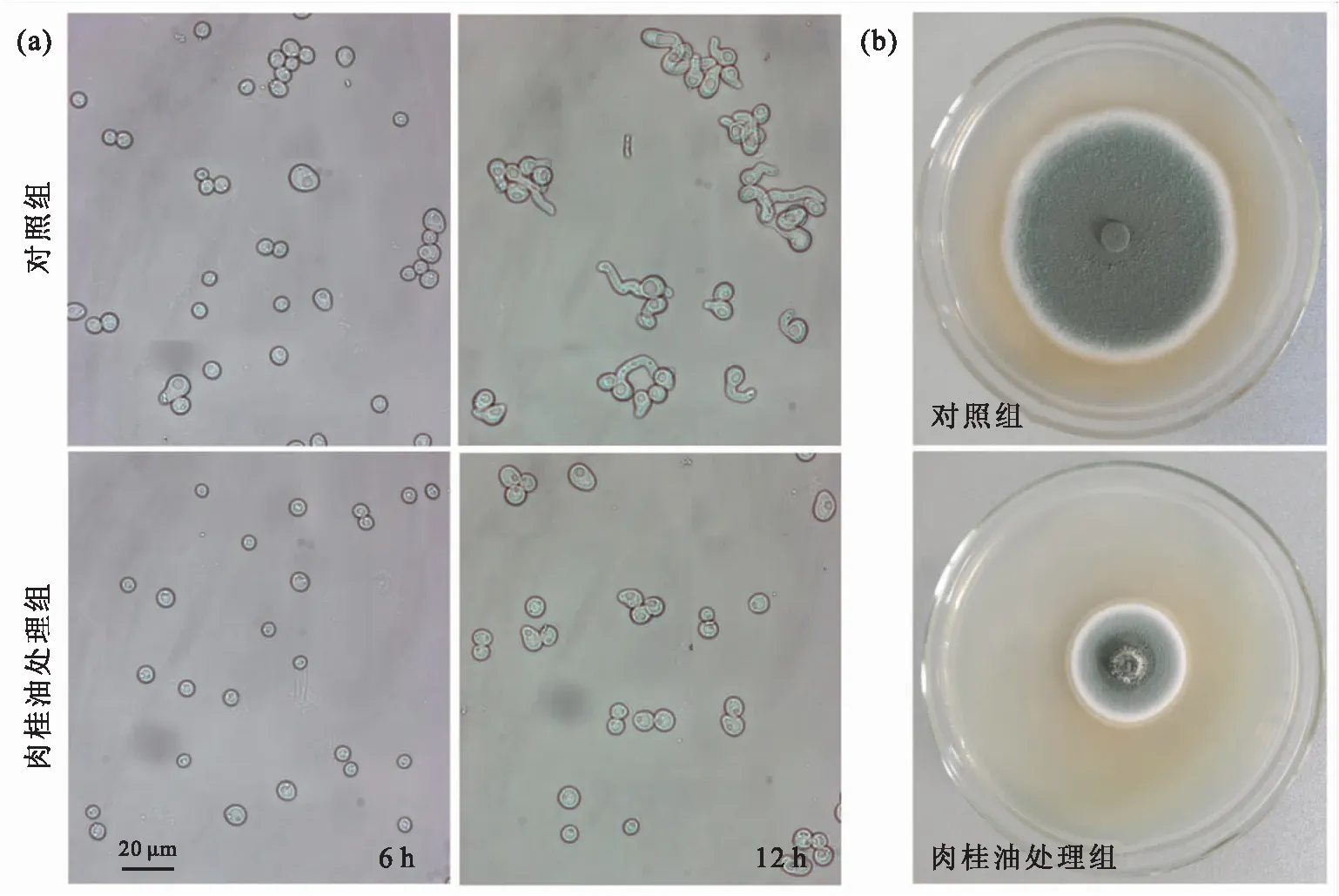
在100 mL PDB培养基中调节P.expansum孢子终浓度至1.0×106孢子/mL,肉桂油体积分数分别为0和0.02%,在25 ℃振荡(200 r/min)培养6 h和12 h后拍摄;菌落形态图片拍摄于接种后8 d.
图2 肉桂油(0.02%)处理对P.expansum孢子萌发(a)及菌落形态(b)的影响
Fig.2 Effects of cinnamon oil (0.02%) treatment on spore germination (a) and colony morphology (b) ofP.expansum
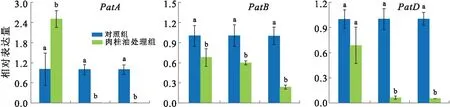
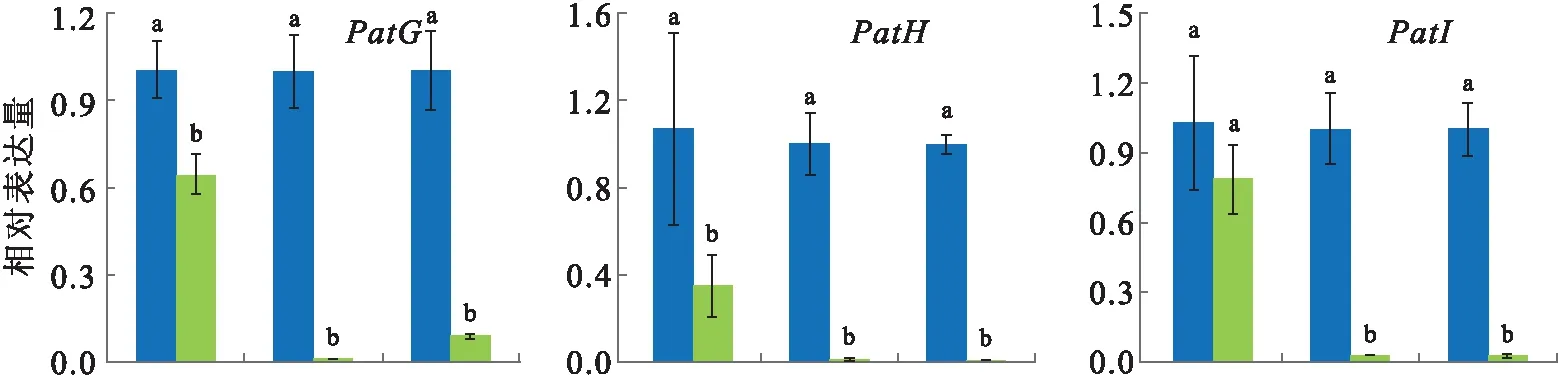

误差线代表标准误,不同的小写字母代表显著性差异P<0.05.
2.3 肉桂油对苹果和梨果实青霉病的防治作用
在前期工作中,利用不同浓度的肉桂油对苹果和梨果实青霉病害进行防治实验,结果表明,肉桂油在较低浓度时防治效果不理想,当体积分数达到0.04%时,防治效果显著.本实验中,对照组和肉桂油处理组的接种果实均全部发病,但处理组的病斑扩展速度明显低于对照组,同时肉桂油的抑菌效果在苹果和梨果实中基本一致(图4).

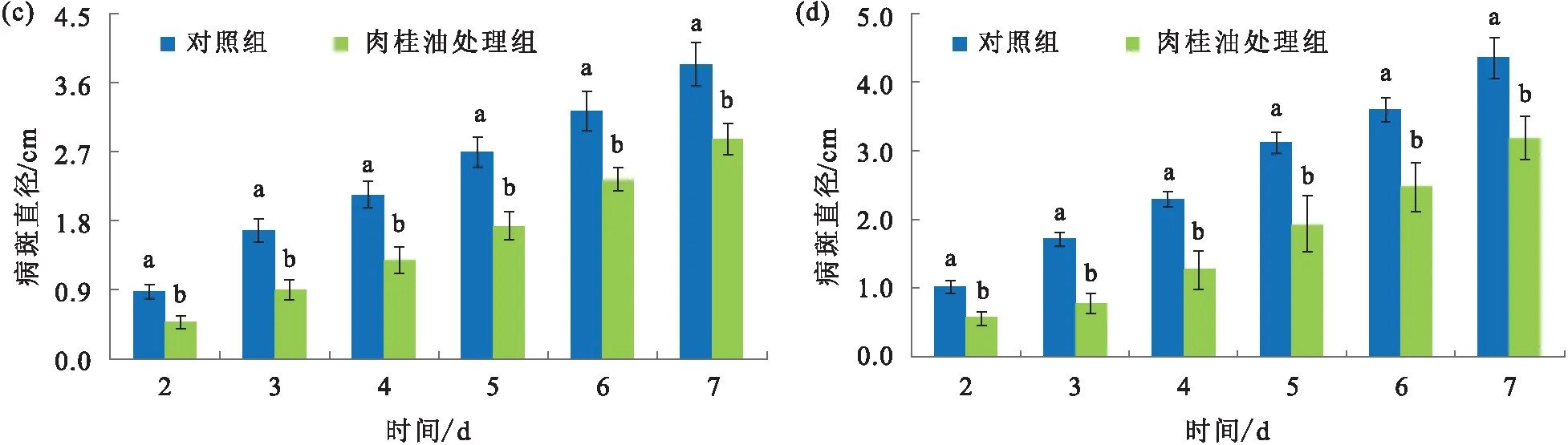
果实图片拍摄于接种后7 d;误差线代表标准误,不同的小写字母代表显著性差异P<0.05.
2.4 肉桂油对P. expansum孢子发育早期转录组的影响
孢子萌发是病原菌生命周期的重要过程之一,是侵染宿主的起始,决定病原菌致病力的重要因素.在25 ℃振荡(200 r/min)培养条件下,培养6 h后P.expansum孢子基本完成体积膨大的过程,个别孢子甚至已经萌发,孢子形态完整;培养12 h后,孢子则基本全部萌发,芽管清晰可见,形态变化多样(图2a).因此,本研究选择培养6 h的孢子进行转录组分析,该时间点对照组和处理组的样品形态接近,背景较为简单清晰,利于寻找肉桂油的作用靶标.通过RNA-seq分析,下机数据通过质控筛选,对照组和处理组分别获得14 290 481 446 bp和8 283 354 519 bp高质量数据,占比原始数据86.77%和80.81%;匹配基因组序列总数分别为93 982 193和54 119 545,占比89.61%和92.10%;基因覆盖率分别为99.13%和99.25%,基因组覆盖率达到80.02%.通过表达量倍数差异和表达差异显著性分析,共有140个基因表达下调,245个基因表达上调(图5).通过Gene ontology富集分析,大多数差异表达基因参与的生物学过程为oxidation-reduction process、chromosome segregation和catabolic process,富集在external encapsulating structure、extracellular region以及microtubule organizing center(图6).通过KEGG富集分析发现,大部分差异表达基因在外源物质降解和次级代谢物代谢、糖代谢、脂代谢、细胞复制和修复等生物学途径中发挥作用(图7).

图5 肉桂油(0.02%)处理诱导的P. expansum胞内差异表达基因MA图Fig.5 MA map of differentially expressed genes in P. expansum under cinnamon oil (0.02%) treatment
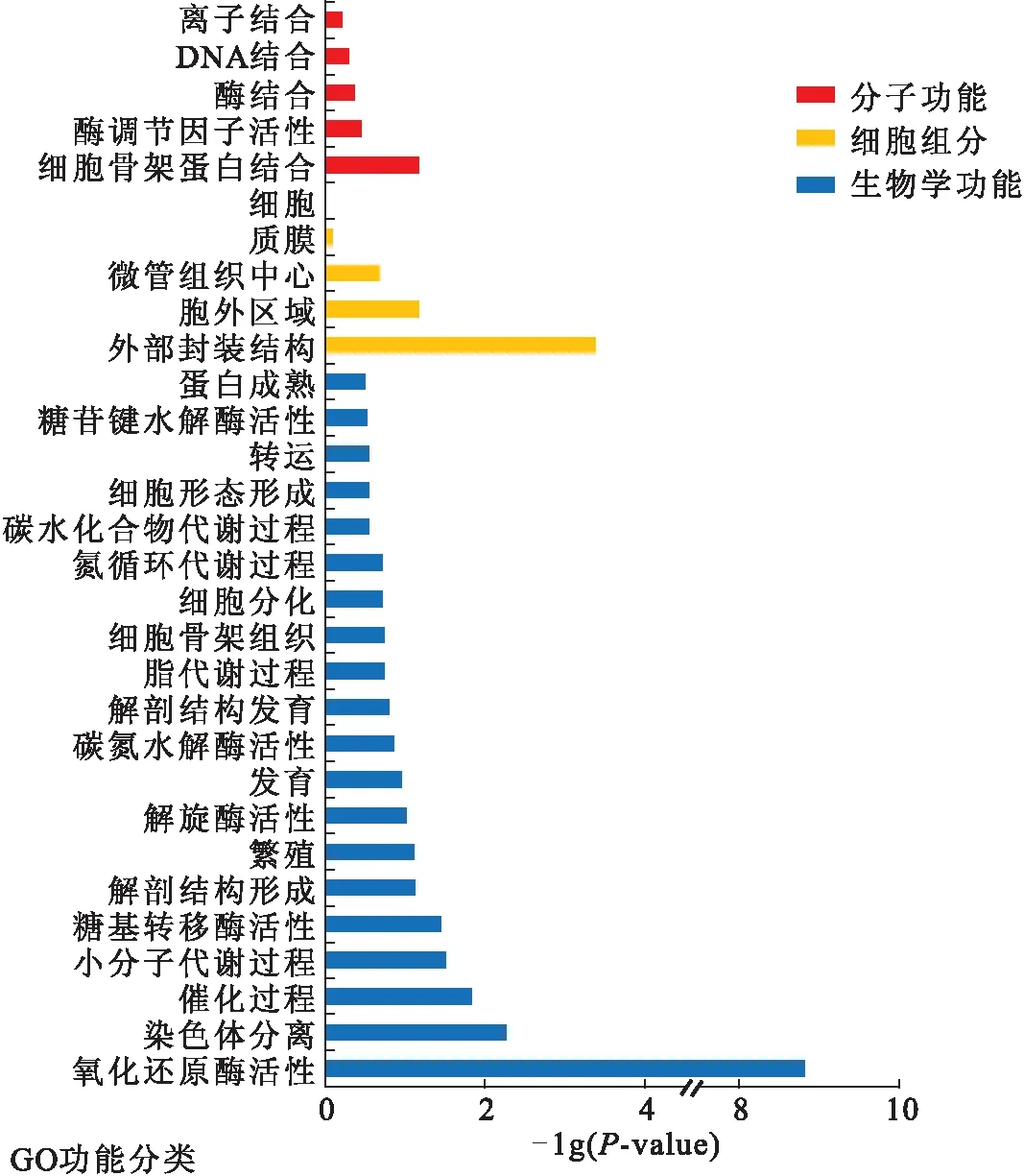
图6 肉桂油(0.02%)处理诱导的P. expansum胞内差异表达基因的GO富集分析Fig.6 GO enrichment analysis of differentially expressed genes in P. expansum under cinnamon oil (0.02%) treatment

图7 肉桂油(0.02%)处理诱导的P. expansum胞内差异表达基因的KEGG富集分析Fig.7 KEGG enrichment analysis of differentially expressed genes in P. expansum under cinnamon oil (0.02%) treatment
3 讨论
植物精油是利用水蒸气蒸馏法、挤压法、冷浸法等萃取的植物花、叶、根、茎或果实中的挥发性芳香物质,成分复杂多样,包含的小分子酚类、萜烯类及醛酮类物质是植物精油抑菌的主效成分.其抑菌方式一种是通过改变微生物细胞、菌丝体的形态结构及化学组成,造成细胞不可逆的损伤,诱发菌丝体溶解,最终导致微生物死亡[27-28].另外一种是抑制分生孢子的产生和萌发,阻断病原菌的扩繁,最终导致微生物死亡[29-30].本研究所使用的肉桂油主要抑菌成分是肉桂醛[14],当体积分数达到0.02%时,能够显著抑制P.expansum的孢子萌发、芽管伸长、菌落扩展以及Patulin的合成,当体积分数达到0.04%时,对苹果和梨果实的青霉病有良好的防治作用.
棒曲霉素Patulin是一种具有致畸形、致突变、致癌毒性的真菌毒素,是P.expansum的主要次级代谢产物,细胞内由15个基因(PatA-PatO)组成的基因簇协同调控Patulin的合成.其中PatK催化acetate和malonate-CoA合成6-methylsalicylic acid,控制Patulin合成的起始;PatG催化6-methylsalicylic acid形成patulin的稳定前体m-cresol;PatH和PatI催化m-cresol的连续羟基化形成gentisyl alcohol;PatN催化isoepoxydon转化为phyllostine是Patulin合成途径中的关键酶促反应[2,26].本研究中,在肉桂油的胁迫下,除PatL以外的关键基因的表达随着处理时间的增加均显著下降,这与Patulin合成下降的表型是相一致的.PatL编码一个包含Zn(II)2Cys6基序的转录因子,前人报道PatL能够在多个生物学途径中发挥作用,如敲除PatL基因能够破坏细胞的形态构成[31].因此,本研究中PatL表达上调表明该基因不仅仅与Patulin的合成相关,还可能在基因簇以外的代谢途径中发挥逆境响应的作用.
转录组是指某个物种或特定细胞在某一生理功能状态下,细胞内所有转录的mRNA产物的集合,是连接基因组遗传信息与生物功能的蛋白质组的必然纽带.通过转录组学的分析发现,肉桂油处理对P.expansum分子水平上的影响非常广泛.在获得的385个差异表达基因中,大部分基因的编码产物具有与离子或者DNA的结合活性以及具有蛋白结合和催化调节活性,主要分布于封装结构、胞外区域以及微管结构.从结构上讲,P.expansum培养6 h后,孢子完成了活化及膨胀的过程,体内代谢活跃,处于即将萌发的状态,细胞形态即将发生剧烈改变[1].而微管在维持细胞形态、细胞分裂、信号传导和物质运输等过程中起着重要作用[32].肉桂油处理下,相关基因的表达改变将对细胞的极性生长和形态变化产生巨大影响.同时,差异表达基因与萜类、醛酮类外源物质的降解及次级代谢物的代谢密切相关,表明病原菌在肉桂油胁迫下,胞内应激反应活跃.此外,糖、脂、氨基酸等物质是病原菌生命活动及能量代谢的基础.通过差异表达基因的GO分析发现,肉桂油处理对这些物质的代谢造成了较大影响,差异表达基因的KEGG分析结果也与该结果相吻合.另外值得注意的是,差异表达基因与氧化还原作用的相关性最高,而肉桂油本身具有较强的抗氧化性[33].因此,推测肉桂油对病原菌胞内的氧化还原水平的平衡造成了较大影响,进而弱化或破坏对胞内元件的功能,对病原菌的发育造成影响.
