食品中修饰型真菌毒素及其同时检测方法研究进展
2020-02-18赵琼晖袁梓洢王宏菊张建莹
赵琼晖,袁梓洢+,王宏菊,张建莹
(深圳海关食品检验检疫技术中心,广东深圳 518045)
食品在生产、贮存、运输、分配及加工过程中易被外源物污染,从而导致食品安全问题。真菌毒素是常见的污染物之一,它是真菌产生的有毒次级代谢产物,对人体和动物具有三致作用、免疫抑制作用和雌激素效应等[1-2]。目前,很多国家和地区对食品中真菌毒素设定了限量。我国食品安全国家标准《食品安全国家标准 食品中真菌毒素限量》(GB 2761-2017)规定了食品中黄曲霉毒素B1(aflatoxins B1,AFB1)、黄曲霉毒素M1(aflatoxins M1,AFM1)、脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)、赭曲霉毒素A(ochratoxin A,OTA)及玉米赤霉烯酮(zearalenone,ZEN)等限量[3]。
修饰型真菌毒素是真菌毒素在微生物[4]、植物[5]或动物[6]中经代谢或修饰作用而生成的代谢或修饰产物,也包括食品加工过程中产生的各种产物。目前研究并未确证修饰型真菌毒素的毒性比原型毒素更大,但大量研究表明修饰型真菌毒素进入人或动物体内会被水解并释放出原型毒素,成为潜在的风险毒素[7-8]。一般地,食品更易受到多种修饰型真菌毒素或/和真菌毒素的侵染,而多种毒素共存可能会导致毒性附加或/和协同效应[9-10]。
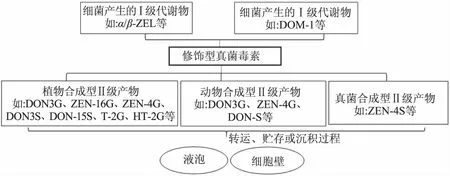
图1 修饰型真菌毒素的分类Fig.1 The taxonomy of modified mycotoxins
因此对多种修饰型真菌毒素的同时检测尤为必要。不过,修饰型真菌毒素比其原型毒素的极性强,在常规的提取、净化、检测过程中易被漏检[11],所以人们常低估食品中毒素的总含量。因此,监测食品中修饰型真菌毒素的存在情况仍是确保食品安全和人及动物健康的重要任务。本文综述了食品中修饰型毒素的形成和种类、毒性性质及同时检测方法,以期为进一步研究食品中修饰型真菌毒素的存在情况、代谢特点和同时检测技术提供一定的理论参考。
1 修饰型真菌毒素的形成及种类
修饰型毒素的来源之一是当真菌毒素污染于动植物中,为了降低该毒素的毒害作用,受侵的动植物体会自发的发生脱毒反应而形成修饰型真菌毒素[12]。以植物解毒代谢为例,植物解毒过程分为三个阶段。第一阶段又称转化阶段,该阶段主要是发生还原、氧化、乙酰化和水解作用,生成对应的一级代谢产物(修饰型);第二阶段又称结合阶段,在相关酶的作用下,将第一阶段的产物或母体真菌毒素与极性较强的物质(如糖类[13]、硫酸盐[14]和谷胱甘肽[15]等)相结合生成对应的二级代产物(修饰型);第三阶段是将上述的代谢产物转运、贮存或沉积于细胞器中(如液泡、细胞壁等),实现空间上的隔离。目前公认的修饰型真菌毒素分类见图1[16]。真菌也能产生各种修饰型真菌毒素,如禾谷镰刀菌,体外实验发现该菌能诱导ZEN的合成且伴随着大量I和Ⅱ级代谢产物[17]。此外,修饰型毒素另一来源是各种食品加工技术所产生的真菌毒素相关代谢物[18-19]。
实际上,研究表明有超过400种不同化学结构的真菌毒素,它们可由上述的途径改性生成大量不同结构的修饰型真菌毒素[20]。单端孢霉烯族毒素、伏马毒素B(fumonisin B,FB)、ZEN和OTA的修饰型已被发现并鉴定,其分子结构式见图2[12,21-23]。目前在食品中发现的修饰型真菌毒素主要包括如下:
B型单端孢霉烯族毒素的修饰型,如DON的葡糖化产物(DON-3-葡萄糖苷(DON-3-glucoside,DON-3G)和DON-15-葡萄糖苷(DON-15G))[24]、雪腐镰刀菌烯醇(nivalenol,NIV)的葡糖化产物(NIV-葡萄糖苷(NIV-G))、镰刀菌酮X(fusarenone X,FUX)的葡糖化产物FUX-葡萄糖苷(FUX-G)[25]、DON的乙酰化产物(3-乙酰基-DON(3-acetyl-DON,3A-DON)和15-乙酰基-DON(15A-DON)[24]、DON的硫酸盐产物DON-3-硫酸盐(DON-3S)和DON-15-硫酸盐(DON-15S)[14]、去环氧-DON(Deepoxy-DON,DOM)[26]等。
ZEN的修饰型,如ZEN-4-葡萄糖苷(ZEN-4G)、ZEN-4-硫酸盐(ZEN-4S)、α/β玉米赤酶烯醇(α/β-zearalenol,α/β-ZEL)、α/β-ZEL-葡萄糖苷(α/β-ZELG)等[24]。
A型单端孢霉烯族毒素的修饰型,如T-2-葡萄糖苷(T-2G)和HT-2-葡萄糖苷(HT-2G)[21]、3-乙酰基-T-2(3A-T-2)和3-乙酰基-HT-2(3A-HT-2)[27]等。
FB的修饰型,如水解FB1/FB2/FB3(hydrolyzed FB1/FB2/FB3,HFB1/HFB2/HFB3)、N-羧甲基FB1(N-carboxymethyl FB1,NCM-FB1)、N-脱氧果糖基FB1(N-deoxyfructosyl FB1,NDF-FB1)等[22]。
OTA的修饰型,如14R-OTA、14-脱羧酶-OTA、OTA-甲基-α-二氯吡喃酯、OTA-葡萄糖酯、OTA-纤维二糖酯等[23]。

图2 食品中常见的修饰型真菌毒素的化学结构Fig.2 Chemical structures of the most frequently occurring modified mycotoxins in food注:a:B型单端孢霉烯族毒素的修饰型;b:玉米赤霉烯酮类毒素的修饰型; c:A型单端孢霉烯族毒素的修饰型;d:水解伏马毒素;e:赭曲霉毒素A的修饰型。
2 修饰型真菌毒素的毒性
目前对修饰型真菌毒素的毒理学性质存在争议和不确定性。从脱毒方面来看,一般认为,修饰型真菌毒素的毒性比原型小,相关的报道也被证实。如在镰刀菌污染的小麦中检测到了植物的自然脱毒产物DON-硫酸酯,其毒性比原型小[14]。相似地结论也表明DON3G毒性偏低[28]。而且Lemmens等[29]发现DON能被葡萄糖糖基转化酶催化生成DON-3G,同时也发现能将DON快速生成DON-3G能力的小麦品种通常对镰刀菌有较高的抵抗性。另外,研究者通过烘烤和加热处理制得的面包及其他谷物制品中发现了DON的异构化代谢产物iso-DON和nor-DON,其毒性比原型DON低[30]。但与之相反的结论也被相继报道。对于DON毒素代谢物,Broekaert等[31]报道DON及其修饰型毒素72 h暴露后的肠道上皮细胞毒性如下:DON3G≪3A-DON 从修饰型真菌毒素的降解方面而言,大量研究称在人和动物体内修饰型真菌毒素能水解还原成原型真菌毒素。在体外模拟实验中,Dall’Erta等[33]首次证实了DON-3G、ZEN-4G和ZEN-4S可被人体消化道中肠道菌水解成原型及其他代谢产物(如DOM-1)。ZEN14G和ZEN16G也能在人体胃肠细胞内发生脱糖基化反应后生成母体毒素,增加总雌激素的负荷,且ZEN14G比ZEN16G更易水解,其原因可能是人体的细胞溶质β-葡萄糖苷酶能裂解ZEN14G而无法裂解ZEN16G[34]。此外,人体和乳猪的喂食活体实验中也发现了DON3G能在体内消化系统中可快速水解成DON原型及其他代谢产物DOM-1和DON-葡萄糖醛酸[7,35]。所以,修饰型毒素可能具有直接的毒理学性质,实际上真实的毒素暴露水平会远大于目前检测的量,故有必要将修饰型真菌毒素纳入风险评估研究中。FAO/WHO食品添加剂联合专家委员会(JECFA)将DON-3G、3A-DON和15A-DON认定为人体DON膳食暴露[36]。2016~2018年,欧洲食品安全局(EFSA)也相继对ZEN[37]、DON[38]、NIV[39]、T-2、HT-2[40]和FB[41]及相关修饰型毒素的膳食暴露情况开展了相关风险评估工作。 食品中修饰型真菌毒素的检测过程一般包括取样、均质、提取、净化、检测和定量[1]。由于毒素的不同理化性质和食品基质的多样性等,目前已发展出不同的提取方法、净化方式和检测技术。 固-液体提取法(solid-liquid extraction,SLE)是使用溶剂的最传统且最常用的食品样品前处理技术之一。对极性较强的修饰型真菌毒素而言,常用的提取试剂为乙腈、甲醇、丙酮、二氯甲烷、氯仿和乙酸乙酯等有机溶剂。目前,有机溶剂与一定比例水或酸性缓冲溶液的混合提取液被大量应用于修饰型真菌毒素的提取。水的加入可以充分浸润样品,促进有机溶剂对样品的渗透能力,尤其对易发生交联反应的高淀粉、高蛋白样品,如谷物及其制品等。乙腈和水(84∶16,v/v)[42]、甲醇和水(70∶30,v/v)[43]已用于提取谷物及其制品中多种毒素。pH对毒素的提取效率有影响[44]。一般加入适量的酸性溶液(乙酸或甲酸等)可以提高其回收率。如加入1%的乙酸可有效提取红葡萄酒包括DON、ZEN及其隐蔽型在内的36种毒素,回收率可高达120%[45]。FBs毒素属酸性毒素,提取试剂为含0.1%甲酸的乙腈/水(99∶1,v/v)可使回收率提升至80%[46]。而对于脂肪含量较高的食品,推荐使用非极性溶剂如己烷和环己烷脱脂后再经乙腈/水/乙酸(79∶20∶1,v/v/v)进行提取[24]。另一方面,研究者也能通过间接法提取出食品基质中的总毒素(母体和修饰型毒素)。Brya等[47]用氢氧化钾碱水解玉米制品中的修饰型毒素后,再用二氯甲烷提取其中的总FBs毒素(母体和修饰型毒素)。 近年来,许多仪器自动溶剂提取方法在真菌毒素及修饰型毒素的分析中得到应用。一般包括超临界流体萃取(supercritical fluid extraction,SFE)、加速溶剂萃取和微波辅助提取等。与传统方法相比,这些方法安全环保,效率高,但成本更高[1]。如Zougagh等[48]应用SFE法对玉米粉中ZEN、α/β-ZEL毒素进行提取。 为了更好的检出目标物,避免蛋白质、脂类、有机酸、酚类和色素等基质干扰成分的影响,通常会进行净化处理。目前,多功能净化柱、固相萃取柱、免疫亲和柱和凝胶渗透色谱净化法在多种毒素净化环节上的研究较多。Sun等[46]曾对比了多功能净化柱、吸附粉和固相萃取柱对25种真菌毒素及其修饰型真菌毒素的净化效果,结果显示C18和氨基固相萃取柱更适用于多种毒素的同时净化,但氨基柱不适用弱极性FBs和OTA两种毒素的净化。DON免疫亲和柱对DON及其修饰型毒素(DON3G、15A-DON和3A-DON)有良好的交叉性,能有效评估样品中DON的总含量(原型及修饰型)[49]。宫小明等[50]利用凝胶渗透色谱净化法(层析柱:30 mm×210 mm,填料:Bio-Beads SX-3填料,流动相:乙酸乙酯/环己烷)成功净化花生和玉米油中DON、3A-DON、15A-DON等18种真菌毒素,回收率达到80%~96%。 此外,QuEChERS技术是快速、简单、便宜、有效、可靠、安全的前处理技术,已被大量应用于谷物及其制品[51]、坚果[52]、啤酒[53]和芝麻酱[54]等不同食品基质中多种毒素的同时提取和净化。QuEChERS技术的提取净化效果受样品基质、提取剂、盐析剂、净化剂等多个因素的影响[55]。C18是常使用的净化剂,它通过非极性相互作用可以有效去除糖类和脂类物质。但C18固相萃取柱对啤酒的净化效果优于花生等含脂高的食品[52-53]。不同净化剂可以组合使用。C18和乙二胺-N-丙基硅烷(primary secondary amine,PSA)有效吸附绿茶中的有机酸、酚类和脂类[44]。与C18和Z-Sep+结合吸附剂相比,增强型脱脂吸附剂对坚果食品净化后基质效应更小,大多毒素基质效应小于±20%[52,56]。总之,净化方式的选择和使用可根据具体食品基质的特点和目标毒素的结构性质。但实际上目前的净化方法很难完全去除干扰物,基质效应仍然存在,可能对方法的灵敏度和选择性有一定的影响。 修饰型真菌毒素一般无法用常规检测技术检出,人们易低估其风险和暴露水平。所以,建立一套能实现对其准确发现和定性的检测技术非常重要。如今研究者已成功报道了修饰型真菌毒素同时检测的方法,其主要包括液相色谱-串联质谱法(liquid chromatography-mass spectrometry,LC-MS)和酶联免疫法(enzyme linked immunosorbent assay,ELISA)。 3.3.1 液相色谱-串联质谱法 LC-MS是最常见的分析多种真菌毒素及其修饰型毒素的检测方法。质谱仪根据检测器不同工作原理可分为三重四级杆-串联质谱仪(triple quadruole-mass spectrometry,QqQ-MS)、离子阱质谱仪(iron trap-mass spectrometry,IT-MS)、飞行时间质谱仪(time of flight-mass spectrometry,TOF-MS)和静电场轨道阱质谱仪(Orbitrap-mass spectrometry,Orbitrap-MS)。表1汇总了LC-MS同时检测不同食品基质中多种毒素的情况。 表1 液相色谱串联质谱法同时检测不同食品基质中原型及修饰型真菌毒素Table 1 Simultaneous determination of mycotoxins and their modified metabolites in different food matrices by liquid chromatography-tandem mass spectrometry 注:-代表该值文献中未提供。 QqQ-MS是日常真菌毒素检测工作法定的标准方法[57],电喷雾正离子多反应监测模式(multiple reaction monitoring,MRM)能实现同步定量和定性,灵敏度高、选择性强,目前应用较多。Blesa等[58]利用LC-QqQ-MS/MS检测了80个小麦样品中包括DON、3A-DON和15A-DON等在内的18种毒素,所有分析物在20 min内均有良好的色谱分离,定量限为1.0~250 μg/kg。Yang等[59]建立了UPLC-MS/MS快速测定鸡肉、猪肉、鸡肝和猪肝中单端霉烯族毒素及其主要代谢产物的分析方法。加标样品的平均回收率为74%~97%,方法的检测限和定量限分别为3.0~15.0和10.0~50.0 μg/kg。UPLC-MS/MS适用于红葡萄酒中36种真菌毒素和200种杀虫剂的检测,其中35种毒素的回收率为70%~120%[45]。 IT-MS是另一常见的低分辨仪器,因其特有的空间限定特点,能实现多级质谱分析,具有很强的物质结构鉴定能力。QqQ-MS与IT-MS复合质谱系统可提高检测灵敏度,因此LC-QTrap-MS/MS技术的使用较为常见。LC-QTrap-MS/MS适用于DON和ZEN原型及相关修饰型毒素的鉴定和检测。小麦中发现两种DON新型代谢产物DON-3S和DON-15S,该方法DON-3S和DON-15S检出限可达到0.003和0.002 mg/kg[14]。它也适用于伏马毒素类修饰型毒素的检测。如Dall’Asta等[43]使用LC-QTrap-MS/MS方法在无麸质食品中均检测到HFBs(HFB1、HFB2和HFB3),其中零食食品中检出的HFBs中位值高达1430 μg/kg。 但是上述两种MS属低分辨率,通常仅适用少量目标化合物的分析。而且标准品的缺乏制约了大量修饰型真菌毒素的定量和检测。为了减小食品基质效应,一般通过同位素标记内标法或基质匹配标准曲线解决,不过目前商业化的产品主要集中于DON、T-2和HT-2的修饰型毒素。 近年来,全扫描技术的发展弥补了低分辨质谱技术的劣势。高分辨质谱(high resolution mass spectrometers,HRMS),如TOF-MS和Orbitrap-MS利用全扫描模式获得高灵敏度,高分辨率(可达100000 FWHM),高质量数精确度(<5 ppm)。与QqQ方法相比,LC-HRMS串联法能进行目标分析、未知组分鉴定和数据分析溯源等[60]。LC-HRMS已被成为食品中多组分分析的利器[61],已大量应用于DON[62-63]和FUX[25]的修饰型毒素、ZEN的硫酸盐[64]、H-2/HT-2的糖苷物[65]、FBs的水解产物[47]、OTA的多糖酯类[23]。同时,HRMS仍存在基质效应,导致离子抑制或增强现象。不过,即使存在离子抑制现象,研究者也声称HRMS能通过宽的仪器动态范围对不同理化性质的55种真菌毒素、323种农药和11种植物毒素进行高选择性和高灵敏性的检测[66]。此外,与Orbitrap/MS相比,TOF/MS更容易受到复杂基质啤酒的干扰[67]。在实际应用过程中,人们常将HRMS质谱与其他质量分析器质谱联用。HRMS与QqQ-MS结合能提高检测准确性和灵敏度。LC-Q-TOF/MS可快速筛查和确证小麦、玉米中13种毒素[68];UPLC-Q-Orbitrap-HRMS被应用于谷物[69]、奶制品[26]和大豆食品[70]。另外,TOF-MS与IT-MS质谱联用时,可实现多级碎裂精确分析,提高真菌毒素结构分析能力。如研究者利用LC-IT-TOF/MS方法发现了T-2、HT-2、DON、3A-DON和雪腐镰刀菌醇(NIV)5种毒素的裂解规律。T-2和HT-2毒素使用[M+Na]+裂解模式,脱去异戊酰基和乙酸基是其常见的裂解途径,而DON、3A-DON和NIV使用[M-H]-模式,环氧裂解是三者的常见裂解途径[71]。最后,TOF-MS与Orbitrap-MS结合能进一步实现高通量分析,它已被应用于食品中3A-DON等200多种真菌毒素及代谢物的检测[72]。 不过,高分辨质谱在某些方面仍需提升。同量异位物的分离和鉴定存在难度,为了提高未知分子鉴定能力,离子迁移光谱法被推荐使用[73]。HRMS灵敏度低于QqQ法,检出限偏高,少量样品能被HRMS定量。此外,样品经HRMS方法检测易出现较大未知的杂峰,检测结果可能出现假阳性或假阴性。Kluger等[62]经C13标记内标法以鉴定小麦中各种新的未知脱毒产物。 3.3.2 酶联免疫法 研究者也采用ELISA法来检测修饰型毒素。相比LC-MS法,该法具有快速、易操作性、高特异性、高灵敏度和低成本等优势,更适宜大量样品中修饰型毒素的快速定性筛查和现场检测。Usleber等[74]通过免疫兔子获得DON和3A-DON的抗体,并利用50%的抑制水平测定其交叉反应性。结果发现,DON抗体与3A-DON(100.0)和15A-DON(1.1)有较强的交叉反应性(相对于DON=1.0),与NIV(0.063)和FUX(0.016)的交叉反应性较小;3A-DON抗体对3A-DON具有明显的特异性(3A-DON=1.0),与15A-DON(0.016)和DON(<0.001)仅有轻微的交叉反应。在DON抗体基础上,建立的直接ELISA检测DON,3-A-DON和15-A-DON的检出限分别为1.0、0.05和1.5 μg/mL;在3A-DON抗体基础上,建立的直接ELISA法测定的3A-DON检出限为0.1 μg/mL。但是,研究也指出制备的DON抗体一般会对3A-DON和15A-DON有不同程度的交叉反应,使得检测的DON含量高于实际真实含量[75]。 综上所述,因潜在的交叉反应,使得ELISA法测得的结果可能是母体毒素及多种修饰型毒素的总含量。因此ELISA法更适用毒素风险的快速筛查,对阳性结果则需通过其他方法(如LC-MS/MS)进行验证。 近年来,修饰型真菌毒素的“隐蔽性”愈发吸引研究者的关注和探究。目前食品中主要发现了五大类真菌毒素的相关修饰型毒素,其中单端孢霉烯族毒素和ZEN毒素在毒性和同时检测方面研究最多,而经葡糖化、酰基化和硫酸盐作用产生修饰型毒素的研究最为明晰。不过,国内外对修饰型真菌毒素的认识不足,部分修饰型真菌毒素,甚至国内外都缺乏检测方法。而且由于其数量多、结构多样且商业化标准品缺乏等导致检测技术有待提升。另外,大多修饰型毒素毒性研究偏少,如T-2和HT-2的糖苷类产物是否在动物体内存在降解代谢仍存疑。从食品中毒素污染情况来看,目前仍集中于谷物及其制品中,对豆类等农产品研究不多。而且对于加工类食品,其加工工艺的不同是否会影响修饰型毒素的产生或产生的组分种类和含量是否存在差异还未可知。综上,修饰型毒素已广泛存在于食品中,对人和动物的健康存在潜在的安全风险。研究者已在修饰型毒素的来源、污染情况、毒理学性质和检测方法等方面取得了一定的成果,但是仍存在很多的挑战。不过,相信经过研究者的努力,人们可以更合理地评估隐蔽型真菌毒素的风险及对该类毒素采取调控措施。3 食品中修饰型真菌毒素的同时检测
3.1 提取方法
3.2 净化方式
3.3 检测技术

4 结论与展望
