灵芝菌生物发酵北五味子果汁降酸工艺优化及其护肝作用
2020-02-18邱智东伍法杰张彦飞罗浩铭王伟楠
辛 宇,邱智东,伍法杰,张彦飞,曲 墨,罗浩铭,王伟楠
(长春中医药大学药学院,吉林长春 130117)
北五味子(Schisandrachinesis(Turcz.)Baill)是我国传统的药食同源中药材,其主要成分为木脂素、挥发油、多糖、多酚、有机酸等成分[1-2]。因其具有极高的营养价值和药理保健功能,被认为是品质优良的食品和药品原料[3-5]。然而,北五味子中的可滴定酸含量与柠檬接近,酸度过高导致北五味子糖酸比例不协调、口感风味不佳,高浓度的有机酸和较低的pH对人体牙釉质和牙本质也具有腐蚀作用,制约了北五味子果汁的深度开发[6-9]。因此在保持浓郁香气和营养成分的前提下,降低酸度是改善北五味子口感和生产北五味子保健产品的重要途径。
目前降酸的方法主要有化学法、树脂法和生物法[10-11]。化学降酸法是通过加入CaCO3等化学试剂,使其发生中和反应来降低果汁中的部分有机酸,但这种方法在果汁储藏过程中会产生盐类沉淀,且外源性化学试剂的加入也会对降酸后的产品使用安全性造成影响;树脂降酸法主要采用碱性离子交换树脂对北五味子果汁中的酸性成分进行吸附,以达到降酸目的,但会使北五味子果汁中的营养成分大量流失,在降酸的同时也降低了北五味子果汁的附加值;生物降酸法主要是利用微生物代谢,在一定的条件下,分解北五味子果汁中的有机酸,形成酸度较低的其他活性物质,从而达到降低酸度的目的,该方法相较上述两种方法而言,具有条件绿色、反应温和、食用安全性高等优点,可以作为北五味子果汁降酸的主要手段。
目前有关北五味子果汁生物降酸国内还未见报道,因此本文通过菌种筛选确定灵芝菌作为果汁生物降酸实验研究的菌种,进而利用生物法降低北五味子果汁中有机酸的含量,为高品质、高营养价值的北五味子高端保健饮品的开发提供参考。
1 材料与方法
1.1 材料与仪器
北五味子新鲜果实 吉林省北佳中药科技开发有限公司提供,长春中医药大学药学院中药品种质量鉴定实验室鉴定为北五味子(Schisandrachinesis(Turcz.)Baill);灵芝菌(Ganodermalucidum,CGMCC编号5.644) 中国普通微生物菌种保藏管理中心提供;健康Wistar大鼠(雄性,150~200 g,许可证号:SCXK(吉)2018-0007) 长春市亿斯实验动物有限公司提供,自由进食进水适应环境一周,备用;无水葡萄糖标准品、没食子酸标准品、芦丁标准品 纯度>98%,中国药品生物制品检定所;色谱甲醇 色谱纯,美国Thermo Fisher公司;硫酸镁、碳酸钙、硫酸锰、磷酸二氢钾、葡萄糖、维生素B1分析纯,西陇科学股份有限公司;蛋白胨、琼脂粉、酵母浸粉 生化试剂,北京奥博星生物技术有限责任公司;丙氨酸氨基转移酶(ALT)试剂盒、天冬氨酸氨基转移酶(AST)试剂盒 南京建成生物。
YXQ-LS-50A立式压力蒸汽灭菌器 上海博迅实业有限公司医疗设备厂;pHBJ-260型便携式pH计 上海仪电科学仪器股份有限公司;TG328A(S)分析天平 上海精科分析仪器厂;EL-204型电子分析天平 梅特勒-托利多仪器(上海)有限公司;KQ-500B超声波清洗器 昆山市超声仪器有限公司;HH-4数显恒温水浴锅 金坛市江南仪器厂;TU-1080紫外-可见分光光度计 北京普析通用有限责任公司;冷冻干燥机 美国labconco公司;Sorvall Evolution RC离心机 美国Sorvall公司。
1.2 实验方法
1.2.1 北五味子果汁的处理 将北五味子新鲜果实放入干净的大烧杯中,除去果梗,用16层纱布挤出果汁,分离果肉和种子,测定果汁体积后进行冷冻干燥,得到冻干粉末,密封避光低温保存,备用。计算得到果汁冻干粉的得率约为5%。
果汁冻干粉得率(%)=(冻干粉重量/原果汁体积)×100
1.2.2 菌种的复苏、复壮及种子液的制备 马铃薯葡萄糖琼脂(Potato dextrose agar,PDA)培养基的制备:马铃薯200 g/L、葡萄糖20 g/L、琼脂粉15 g/L。种子液培养基的制备:蛋白胨10 g/L、酵母浸粉2 g/L、葡萄糖20 g/L、硫酸镁0.5 g/L、碳酸钙0.1 g/L、硫酸锰0.1 g/L、磷酸二氢钾1 g/L、维生素B110 mg/L、蒸馏水1 L、自然pH。
将灵芝菌斜面从低温冷藏冰箱中取出,迅速移至30 ℃水浴中加热30 min后,擦干试管表面,将斜面放置在28 ℃的微生物培养箱中培养12 h后,取出接种到新的PDA斜面培养基中,在28 ℃的微生物培养箱中培养4~5 d,待白色菌丝长满斜面之后,向斜面试管中加入1/5试管体积的生理盐水,旋涡振荡10 s,将孢子悬液转移到无菌三角瓶中,利用血球计数板法将孢子悬液浓度调节至1×107spores/mL,备用。取一定体积的孢子悬液按照体积比1∶20加入液体培养基中,于28 ℃恒温培养培养5~6 d后,即得灵芝菌摇瓶种子液。
1.2.3 北五味子果汁生物发酵工艺优化
1.2.3.1 单因素实验 将北五味子果汁冻干粉溶于20倍体积的蒸馏水中,121 ℃高压灭菌20 min,无菌条件下放至室温后转移至28 ℃的恒温摇床中备用。固定接种量5%(V/V)、接种菌龄5 d、振荡速度160 r/min,依次考察发酵时间0、2、4、6、8、10、12、14、16 d的果汁pH,绘制pH变化曲线作为最适发酵时间选择的依据;固定发酵时间12 d、接种菌龄为5 d、振荡速度160 r/min,依次考察接种量2.5%、5.0%、7.5%、10.0%(V/V)对果汁pH变化的影响;固定接种量5%(V/V)、振荡速度160 r/min、发酵时间12 d,依次考察接种菌龄2、3、4、5、6、7 d对果汁pH变化的影响;固定接种菌龄3 d、接种量5%(V/V)、发酵时间12 d,依次考察振荡速度140、160、180、200 r/min对果汁pH变化的影响;固定接种菌龄3 d、接种量5%(V/V)、发酵时间12 d、振荡速度180 r/min,依次考察生长因子维生素B1浓度0、5、10、20、40、80 mg/L对果汁pH变化的影响。
1.2.3.2 正交试验 根据1.2.3.1结果选择4个主要因素进行L9(34)四因素三水平的正交设计,分析各因素对北五味子果汁pH的影响,确定最佳发酵工艺,并对结果进行验证,正交因素与水平设计见表1。

表1 正交实验因素水平表Table 1 Factors and levels design for orthogonal experiments
1.2.4 北五味子果汁生物发酵过程及发酵产物处理 根据优化后的工艺获得北五味子生物发酵产物。将发酵产物在60 ℃下超声振荡60 min,取出,在10000 r/min下,离心15 min,取上清液,即得北五味子发酵果汁;将北五味子发酵果汁于-50 ℃,8 Pa冻干,称重,密封避光低温保存,备用。
1.2.5 pH和酸度测定 pH采用精密pH计直接测定;酸度采用酸碱滴定法测定[12]。

式中:CNaOH:滴定所用NaOH溶液的浓度,g/L;VNaOH:滴定所用NaOH溶液体积,mL;VSC:被滴定的北五味子果汁体积,mL。
1.2.6 多糖含量测定方法
1.2.6.1 标曲的建立 精密称量无水葡萄糖标准品,置100 mL容量瓶中,用蒸馏水定容,配成浓度为0.1016 mg/mL的标准品溶液,分别精密量取0.1、0.2、0.4、0.6、0.8和1.0 mL标准品溶液,绘制标准曲线[13-14]。建立回归方程为y=0.05656x-0.02524,R2=0.9995,标准品溶液在1.27~12.7 μg/mL范围内与吸光度呈良好线性关系。
1.2.6.2 供试品溶液的制备及其多糖含量的计算 称量50.6 mg北五味子鲜果果汁冻干粉末和50.7 mg北五味子发酵物冻干粉末,分别加入25 mL蒸馏水,充分溶解、过滤,续滤液定容至25 mL配成供试品溶液;精密吸取发酵前后的供试品溶液各0.4 mL,按照1.2.6.1中的方法处理后,以不含样品的溶液为空白对照,测定其在490 nm波长下的吸光度值,并根据标准曲线方程计算鲜果汁和发酵物中多糖的含量,该实验平行三次,测定结果以平均值计。
1.2.7 多酚含量测定方法
1.2.7.1 标准曲线的建立 精密称量没食子酸标准品,用蒸馏水定容,配成浓度为0.1024 mg/mL的对照品溶液,分别精密量取0.25、0.50、0.75、1.00、1.25和1.50 mL标准品溶液,绘制标准曲线[15-18]。建立回归方程为y=0.12095x+0.06581,R2=0.9996,说明没食子酸对照品在0.8020~4.9150 μg/mL范围内与吸光度呈良好线性关系。
1.2.7.2 供试品溶液的制备及其多酚含量的计算 称量1.0008 g北五味子鲜果果汁冻干粉末和1.0005 g发酵后冻干粉末,加入蒸馏水25 mL,超声(40 kHz、30 ℃)提取1.5 h,过滤,续滤液定容至25 mL即为供试品溶液。精密吸取发酵前后的供试品溶液各0.5 mL,按照1.2.7.1中的方法处理后,以不含样品溶液为空白对照,测定其在760 nm波长下的吸光度值,并根据标准曲线方程计算鲜果和发酵物中多酚的含量,该实验平行三次,测定结果以平均值计。
1.2.8 黄酮含量测定方法
1.2.8.1 标准曲线的建立 精密称量芦丁对照品,用60%甲醇稀释至刻度,配成浓度为10.42 μg/mL的对照品溶液,分别精密量取0.1、0.4、1.0、2.0、3.0和4.5 mL对照品溶液,绘制标准曲线[19-22]。建立回归方程为y=0.01203x+0.0592,R2=0.9997,说明芦丁对照品在1.042~46.89 μg/mL范围内与吸光度呈良好线性关系。
1.2.8.2 供试品溶液的制备及其黄酮含量的计算 分别称量1.0008 g北五味子鲜果果汁冻干粉末和1.0005 g发酵后冻干粉末,加入60%甲醇25 mL,超声(40 kHz、30 ℃)提取1.5 h,补足失重,过滤即为供试品溶液;精密吸取发酵前后供试品溶液各5 mL,按照1.2.8.1中的方法处理后,以相应试剂为空白对照,测定在510 nm波长下的吸光度值,并根据标准曲线方程计算鲜果和发酵物中黄酮的含量,该实验平行三次,测定结果以平均值计。
1.2.9 发酵前后北五味子果汁对酒精肝大鼠模型中AST和ALT活力的影响
1.2.9.1 分组及给药 将50只大鼠按体重随机分为5组,每组10只,即空白对照组(正常组)、模型对照组(酒精肝损伤模型组)、北五味子鲜果组、北五味子发酵组及阳性对照组(联苯双酯组)。
将空白对照组和模型对照组灌胃等体积的生理盐水,鲜果组和发酵组均按大鼠体重200 mg/kg进行灌胃,连续给药7 d,于给药第6 d晚上禁食,末次给药1 h后,除空白对照组外,其余各组均按12 mL/kg灌胃50%乙醇溶液,造成急性酒精肝损伤。
1.2.9.2 血清采样检测 末次给药后8 h,处死大鼠,解剖取肝脏。将各组动物腹腔注射10%水合氯醛300 mg/kg进行麻醉,腹主动脉采血6 mL,分离血清,注入干净的采血试管内,4 ℃、2000 r/min,离心10 min,分离血清,按照天冬氨酸氨基转移酶(AST)试剂盒和丙氨酸氨基转移酶(ALT)试剂盒说明书比色法测定。
1.2.9.3 组织采样检测 取肝脏组织块(0.2~1.0 g),用冰冷的生理盐水清洗,滤纸拭干,称重,剪碎,置于玻璃匀浆器中,加入冰生理盐水制成10%的组织匀浆,3000 r/min,离心15 min,取上清液,稀释为10%的组织匀浆,按照天冬氨酸氨基转移酶(AST)试剂盒和丙氨酸氨基转移酶(ALT)试剂盒说明书比色法测定。
1.3 数据处理
所有实验数据以平均数±标准平均误差(Means±SD)表示。差异显著性检验采用GraphPad Prism 6统计软件进行单因素方差分析。以P<0.01作为具有极显著性差异,P<0.05为具有显著性差异。
2 结果与分析
2.1 果汁生物降酸工艺研究单因素实验
2.1.1 发酵时间的考察 经过测定,高压灭菌之后的北五味子果汁pH≈1.8,在这种强酸环境下,灵芝菌的生长会受到一定程度的抑制。灵芝菌在北五味子果汁中的发酵状况以及不同发酵时间灵芝菌的代谢活动对北五味子果汁pH的影响如图1所示。

图1 发酵时间对果汁pH的影响Fig.1 Effect of fermentation time on the pH value of juice
通过灵芝菌的生物发酵,北五味子果汁的pH得到了显著的改善,从0~6 d,果汁的pH迅速提高,可能是正处于灵芝菌的对数生长期,菌丝体生长代谢旺盛而引起的。从第6 d开始,果汁pH变化趋于缓和,到达第12 d后pH基本保持不变,所以确定最佳发酵时间为12 d。
2.1.2 接种量的考察 初始接种量大,利于菌种适应新的培养环境,加快生物量累计的效率,然而,菌种的生长与特定物质的代谢并不一定呈正相关性,且接种量过大,会消耗北五味子果汁中大量的营养物质,降低北五味子发酵果汁的营养附加值,因此,考察接种量是生物降酸工艺摸索的重要环节之一。
由图2可知,当初始接种量位于2.5%~5.0%之间时,灵芝菌对北五味子果汁中的酸性物质代谢速率随着接种量的增加迅速提高,pH上升幅度较大,在接种量5%时达到峰值,之后pH维持一个相对稳定的状态,所以选择接种量4%、5%、6%进行后续的优化实验。

图2 接种量对果汁pH的影响Fig.2 Effect of inoculation volume on the pH value of juice
2.1.3 菌龄的考察 微生物在新培养环境中的生长和代谢情况,与接种时的菌龄有很大的关联,菌龄太短或太长均对发酵效果不利,一般来讲,处于对数生长期的菌种能够在新的培养基中快速繁殖,加快生物量的积累和代谢反应的发生[23]。因此本实验选择一定菌龄范围的灵芝菌,平行接种到北五味子灭菌果汁中,考察最适的发酵菌龄,结果如图3所示。

图3 接种菌龄对果汁pH的影响Fig.3 Effect of inoculation age on the pH value of juice
接种菌龄小于2 d的灵芝菌在北五味子果汁中生长缓慢,发酵后果汁pH的提高幅度较低;当菌龄处于3~5 d时,发酵后的果汁pH均大于3;菌龄大于5 d后,果汁pH开始下降;考虑到实验周期的问题,故选择菌龄3、4、5 d进行后续优化实验。
2.1.4 振荡速度的考察 在微生物培养过程中,振荡不仅可以提高微生物与培养基中营养成分的接触几率,使同一生物发酵体系中的微生物生长代谢进程相对均匀,而且还决定着液体培养基中的溶氧和二氧化碳浓度,因此,振荡速度是一项非常重要的考察参数[24]。
通过图4可以看出,当振荡速度小于160 r/min时,灵芝菌在北五味子果汁中的发酵效率较低,pH没有明显的变化,当振荡速度大于160 r/min后,发酵果汁中的pH有了一定程度的提高,并且在180 r/min达到最大值;振荡速度在180~200 r/min时,发酵果汁中的pH明显下降,所以选择振荡速度170、180、190 r/min进行后续正交试验。

图4 振荡速度对果汁pH的影响Fig.4 Effect of vibration speed on the pH value of juice


图5 维生素B1对果汁pH的影响Fig.5 Effect of VB1 on the pH value of juice
2.2 果汁生物降酸工艺研究正交试验
由表2和表3可知,接种量(A)的变化对实验结果的影响最为显著,最终确定北五味子果汁生物发酵降酸工艺的最佳条件为A3B3C1D3,即:接种量为6%(V/V);维生素B1的加入量为10 mg/L;接种菌龄为3 d的灵芝菌;摇床振荡速度为190 r/min。

表2 正交分析表Table 2 Orthogonal analysis

表3 L9(34)正交试验方差分析结果表Table 3 Variation analysis of L9(34)orthogonal tests
2.3 发酵工艺验证
称取北五味子鲜果汁冻干粉1 g,加入20 mL蒸馏水,0.2 mg维生素B1,121 ℃灭菌20 min,按6%(V/V)的接种量接种菌龄3 d的灵芝菌,在190 r/min、28 ℃的恒温摇床中培养12 d,测定pH和滴定酸度变化,该实验平行三次,结果见图6。三批试验菌体pH之间无明显差异,发酵后的pH范围稳定在3.18~3.22之间,通过灵芝菌的生物发酵,北五味子果汁的滴定酸度下降了53.7%。

图6 生物降酸工艺验证结果Fig.6 Verification results for deacidification process
2.4 果汁发酵产物主要活性成分的含量测定
通过对多糖、黄酮、多酚的含量进行测定结果见表4,发现果汁经过发酵之后多糖的含量提高了61.5%,而多酚和黄酮的含量分别降低了64.2%和50.6%。在灵芝菌液体发酵过程中,多糖是其最重要的代谢产物之一,因此,果汁中多糖含量的升高可能与灵芝多糖的合成与分泌有关[26];另一方面,据文献报道,灵芝菌在发酵过程中分泌的漆酶可以氧化并生物降解苯酚和黄酮等多酚类化合物,在本实验中,这可能是导致北五味子果汁中该类成分含量下降的主要原因[27]。

表4 果汁发酵前后主要成分含量变化表Table 4 Contents variation of major components in juice before and after fermentation
2.5 发酵前后北五味子果汁对大鼠酒精肝损伤的保护作用比较
2.5.1 血清及组织ALT测定结果 如表5所示,与空白对照组相比,模型对照组大鼠血清及肝组织丙氨酸氨基转移酶(ALT)活性极显著增加(P<0.01);与模型对照组相比,北五味子鲜果组、北五味子发酵组及阳性对照组大鼠血清及肝组织丙氨酸氨基转移酶(ALT)活性显著或极显著降低(P<0.05或P<0.01);与北五味子鲜果组相比,北五味子发酵组及阳性对照组大鼠血清及肝组织丙氨酸氨基转移酶(ALT)活性显著降低(P<0.05)。
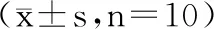
表5 酒精性肝损伤大鼠血清及肝组织 丙氨酸氨基转移酶(ALT)的活性Table 5 ALT activity in serum and liver tissue of alcohol-induced rat model of liver
注:与模型对照组比较,*代表差异显著,P<0.05,**代表差异极显著P<0.01;与五味子鲜果组比较,Δ表示差异显著,P<0.05;表6同。

表6 酒精性肝损伤大鼠血清及肝组织 天门冬氨酸氨基转移酶(AST)的活性Table 6 AST activity in serum and liver tissue of alcohol-induced rat model of liver
2.5.2 血清及肝组织AST测定结果 如表6,与空白对照组相比,模型对照组大鼠血清及肝组织天门冬氨酸氨基转移酶(AST)活性极显著增加(P<0.01);与模型对照组相比,北五味子鲜果组、北五味子发酵组大鼠血清及肝组织天门冬氨酸氨基转移酶(AST)活性显著降低(P<0.05),阳性对照组极显著降低(P<0.01);与北五味子鲜果组相比,北五味子发酵组及阳性对照组大鼠血清及肝组织天门冬氨酸氨基转移酶(AST)活性显著降低(P<0.05)。
有研究表明[28],机体的脂质过氧化和氧化应激与酒精性肝病的发病机制密切相关。肝细胞膜脂质过氧化,会损伤细胞膜的结构和功能,导致细胞肿胀破损,释放出丙氨酸氨基转移酶(Alanine aminotransferase,ALT)和天冬氨酸氨基转移酶(Aspartate aminotransferase,AST)。ALT几乎全部存在于肝内,绝大部分分布在肝细胞的细胞浆中,所以当肝细胞受损,细胞膜通透性增加使肝细胞中的ALT释放到血液中,引起血清ALT升高。而AST主要分布在肝脏肝细胞浆和线粒体中。在正常情况下,仅有极少量ALT和AST释放到血液中,因此在血清中活性很低;当肝细胞受损时,这两种酶大量释放入血,使得血清中ALT和AST活性显著增高[29]。因此,AST、ALT等指标水平的变化成为临床上评价肝损伤最常用的重要指标[30]。
实验使用50%乙醇进行灌胃,建立大鼠急性酒精肝损伤模型,观察北五味子果汁发酵物的保肝护肝作用。结果表明,北五味子鲜果汁组和发酵果汁组均可以显著或极显著的降低大鼠血清和肝脏组织中ALT和AST的活力(P<0.05或P<0.01),说明二者对酒精所致的大鼠急性肝损伤均具有一定的保护作用,且发酵组作用效果要优于鲜果组。
3 结果与讨论
本研究首次将生物发酵技术应用于天然北五味子果汁的降酸工艺,一定量的北五味子果汁冻干粉末,以1∶20 (W/V)的比例加入蒸馏水,接种菌龄3 d,接种量6%(V∶V),维生素B1浓度10 mg/L,振荡速度190 r/min,经过12 d的发酵之后将果汁的pH由1.85提高到3.21,滴定酸度从14.9 g/L降低到6.9 g/L,与原果汁相比酸度降低了53.7%,远高于目前其他已报道的北五味子果汁降酸技术[31];通过初步的化学成分分析表明,发酵果汁中多酚和黄酮的含量大幅度下降,而这两类成分是大多数植物中构成酸性环境的主要化学物质,据报道,引起北五味子果汁酸度过高的主要原因也是与这两类成分相关[32],因此,这可能是北五味子果汁生物降酸的主要原因[33]。
在食品和健康产品加工过程中引入发酵环节可能会导致生物安全性等问题,因此本文中选择的发酵菌种是卫健委规定的允许在保健食品工业上使用的药食同源真菌,生物安全性高、遗传稳定性好、且工艺简便、营养成分背景清晰,在降酸的同时,果汁中多糖的含量上升约61.5%,提高了北五味子果汁的营养附加值。
在药理活性方面,目前关于北五味子保肝护肝活性的研究主要集中于它的干燥果实及其提取物,其中主要活性物质为木脂素和多酚类化合物[34],在本研究中,多酚的含量下降较为明显,为了探清发酵过程是否会降低北五味子果汁的保肝护肝活性,对血清和肝组织中AST和ALT的活力进行了检测,并以此结果为依据初步表征不同实验组的保肝护肝活性;结果表明,发酵前后的果汁均能显著降低血清和肝脏组织中AST和ALT的活力(P<0.05),并没有因为多酚含量的降低而产生显著的药理活性下降。灵芝多糖也具有良好的保肝护肝活性[35],考虑到发酵之后果汁中多糖含量的增加,推测果汁中新增的灵芝多糖类成分可能与其他活性成分起到了协同预防酒精肝损伤的作用,该部分内容需要进一步的深入研究验证。
本文在达到降酸目的的同时,提高了北五味子独特的保健功效,得到的北五味子降酸果汁可以作为多种保健食品和健康产品的原料进行开发;在后续的研究中,北五味子果汁发酵过程中化学成分的系统变化分析将有利于阐明其生物降酸的机理,也为其原料和产品的安全使用提供理论依据。
