嗜酸氧化亚铁硫杆菌耐重金属离子连续转接驯化试验研究
2020-02-17刘玉龙李广悦李建东丁德馨
刘玉龙,李广悦,胡 南,李建东,丁德馨
(1.南华大学 铀矿冶生物技术国防重点学科实验室,湖南 衡阳 421001;2.中广核铀业发展有限公司,北京 100029)
嗜酸氧化亚铁硫杆菌(AcidthiobacillusFerrooxidans,A.f)已被广泛应用于微生物冶金、煤炭脱硫和废水处理[1-3]。低品位铀矿石的微生物浸出也取得了良好的效果[4]。微生物在处理土壤重金属污染过程中也表现出良好的淋滤效果,其首要条件是微生物能适应重金属的环境[5-6]。
低品位铀矿石的A.f浸出,是利用A.f的氧化作用从铀矿石中提取铀的方法。A.f的氧化作用分为直接氧化作用和间接氧化作用,其中,直接氧化是通过A.f将黄铁矿、砷黄铁矿等硫化矿物氧化,实现铀矿石中铀的浸出;而间接氧化则是通过A.f将Fe2+氧化生成Fe3+,随后Fe3+被用作氧化剂,实现矿石中铀的浸出。如果铀矿石中含有较高品位的重金属,随着浸出的进行,浸出液中的重金属离子会富集得越来越多,吸收尾液中重金属离子的浓度也随之升高。吴学玲等[7]的研究表明,在培养液中添加150 mmol/L Cu2+或200 mmol/L Zn2+时,A.f的生长速率受到明显抑制,其Fe2+氧化速率出现显著差异。通常,环境中高浓度的重金属离子主要通过改变细菌细胞的渗透压,对细菌生长产生抑制甚至危害作用。在异常的生长环境中,细菌可通过调整自身的生理反应以适应渗透压的变化,从而表现出对重金属离子的耐受性。但是,细菌对重金属离子的耐受性受重金属离子种类及浓度的影响较大。因此,为增强A.f在实际矿石浸出液环境中的适应性,需要提高A.f对高浓度重金属离的耐受性及其氧化活性。

根据某含Cu、Mn、Cr和Pb铀矿石的A.f浸出需要,以A.f为试验菌株,采用连续转接驯化法提高A.f对Cu2+、Mn2+、Cr3+和Pb2+的耐受性;并结合其在驯化培养基中的适应时长,确定该菌株对4种重金属离子的耐受限值,为这类铀矿石的A.f浸出的实际应用提供理论依据。
1 试验材料与方法
1.1 试验仪器与设备
GSP-9080MBE隔水式恒温培养箱,SPH-200D小容量全温度恒温培养振荡器,SHA-B双功能水浴恒温振荡器,AL-104电子天平,BCD-195KAN冰箱,ALP高压灭菌器,SH23-2恒温磁力搅拌器,S20K Seven Easy数字pH仪。
1.2 试验试剂
本试验所需的化学药剂有(NH4)2SO4、KCl、K2HPO4、MgSO4·7H2O、Ca(NO3)2、H2SO4、CuSO4·5H2O、MnSO4·H2O、3CdSO4·8H2O、Cr2(SO4)3·6H2O、Pb(NO3)2,均为分析纯。
1.3 菌种
采用的A.f由本实验室从中国某铀矿山酸性矿坑水中分离纯化得到,并保存在低温冰箱中。
1.4 培养基
9K培养基组分:(NH4)2SO4,3 g;K2HPO4,0.5 g;KCl,0.1 g;MgSO4·7H2O,0.5 g;Ca(NO3)2,0.01 g;FeSO4·7H2O,23 g;蒸馏水,1 000 mL。9K培养基pH=2.0,121 ℃灭菌15 min。
在9K培养基中,加入Cu2+、Mn2+、Cr3+和Pb2+重金属离子,配制成不同浓度的驯化培养基。
1.5 试验方法
1.5.1 配制培养基
按照9K培养基的配方称取化学试剂。先将除FeSO4·7H2O外的所有化学试剂倒入烧杯,用磁力搅拌器搅拌,将pH调节至2.5;再继续搅拌至所有化学试剂溶解后,加入FeSO4·7H2O,调节pH,使其稳定在2.0。
1.5.2A.f活化
将500 mL的三角烧瓶灭菌后,向其中倒入300 mL 9K培养基,加入50 mL菌液。测量溶液初始电位,用牛皮纸包好瓶口,放入SPH-200D小容量全温度恒温培养振荡器中培养,当溶液的电位达到-500 mV时,取出备用。
1.5.3A.f氧化活性的表征
A.f通过把培养基中的Fe2+氧化为Fe3+获得生长需要的能量。如果培养基中的电位持续升高,则表明A.f生长活性较高;当培养基中的氧化还原电位达到-500~-550 mV时,培养基中Fe2+的氧化比例达100%,表明A.f处于生长旺盛期[13]。此外,A.f在驯化培养过程中的适应时长与其氧化活性存在一定的相关性。A.f的氧化活性通过综合培养基的氧化还原电位和A.f的适应时长进行表征。
1.5.4 耐重金属离子驯化试验
将150 mL的三角烧瓶灭菌后,倒入80 mL的9K培养基,并接种20 mL的活化菌液。接种完成后,在培养基与菌液的混合体系中加入不同质量浓度的重金属离子。混合均匀后,测量初始溶液的电位和pH,并用牛皮纸包好瓶口,放入转速为180 r/min、温度为30 ℃的SHA-B双功能水浴恒温振荡器中培养,定期测量溶液的电位和pH。培养时间在2 d内时,每3 h测量一次;培养时间超过2 d时,每24 h测量一次。当溶液的电位超过-550 mV并趋于稳定时,表明该菌株能适应极端环境,对重金属离子产生了耐受性。取该菌液作为下一步耐重金属离子驯化试验的出发菌,按50%的接种量将驯化菌转接到具有更高重金属离子浓度的驯化培养基中。如此反复,直至该驯化菌的适应时长发生突变,此时的重金属离子浓度即为本研究中A.f的耐受限值。每组试验设3个平行样。
2 试验结果与讨论
2.1 A.f耐Cu2+驯化试验
A.f耐Cu2+驯化的试验结果见表1。
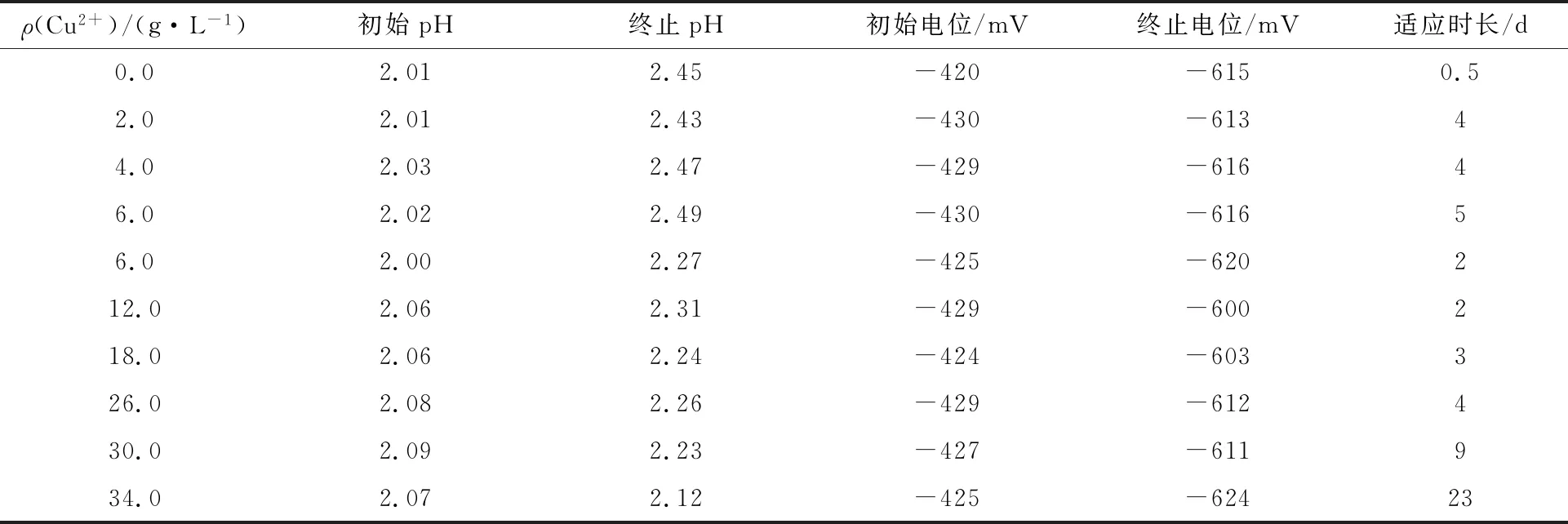
表1 A.f耐Cu2+驯化试验结果
从表1可看出,与对照样相比,接种于Cu2+质量浓度分别为2.0、4.0和6.0 g/L的驯化培养基中的A.f,其生长活性明显降低,完全氧化驯化培养基中Fe2+的时间由0.5 d延长至4~5 d。适应时长的延长表明这3种质量浓度的Cu2+对A.f有较强的毒害作用,抑制了A.f的生长繁殖,致使A.f需要经过一定时间的调整或改变代谢途径来适应新的环境[14]。
将Cu2+质量浓度为6.0 g/L的驯化培养基中的A.f进一步转接到Cu2+质量浓度相同的驯化培养基中,A.f氧化Fe2+的能力和效率明显提升,完全氧化Fe2+的时间由5 d缩短至2 d,表明连续转接驯化培养较大程度提高了A.f的驯化速度和效果。将上一级驯化后的A.f连续转接至Cu2+质量浓度分别为12.0、18.0和26.0 g/L的驯化培养基中,A.f完全氧化驯化培养基中Fe2+的时间分别为2、3和4 d,表明经过驯化的A.f在逐步提高Cu2+质量浓度时,其氧化活性逐渐降低,二者具有较强的相关性。
当Cu2+质量浓度达到30.0 g/L时,A.f的生长能力及对Fe2+的氧化能力受到强烈的抑制,第9天才能把驯化培养基中的Fe2+完全氧化。这与李洪枚[15]的研究结果一致,即Cu2+质量浓度在20.0~30.0 g/L的范围内,通过驯化能提高A.f的生长活性。当驯化培养基中Cu2+的质量浓度达到34.0 g/L时,A.f在驯化培养基中的适应时长发生突变,完全氧化驯化培养基中Fe2+的时间为23 d,表明此浓度下A.f的生长能力和氧化活性受到了较强的抑制和危害,即达到A.f生长可耐受的Cu2+浓度限值。
2.2 A.f耐Mn2+驯化试验
A.f耐Mn2+驯化的试验结果见表2。
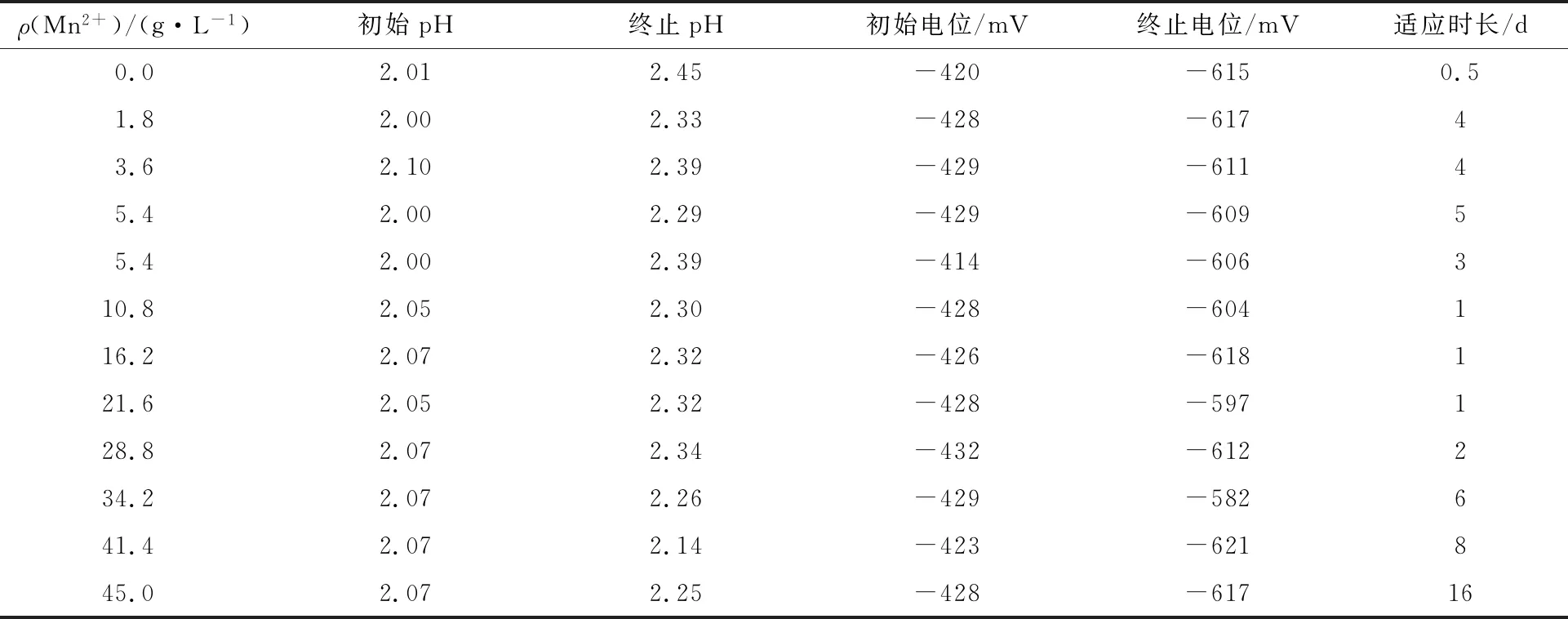
表2 A.f耐Mn2+驯化试验结果
从表2可看出,与对照样相比,当A.f接种在Mn2+质量浓度分别为1.8、3.6和5.4 g/L的驯化培养基中时,完全氧化Fe2+的时间由0.5 d延长至4~5 d。Mn2+对A.f有较大的毒害作用,对其生长有较强的抑制作用,使其氧化活性维持在较低水平。因此,A.f在Mn2+存在的环境中需要一个较长的适应过程。
将Mn2+质量浓度为5.4 g/L的驯化培养基中的A.f进一步转接到Mn2+质量浓度相同的驯化培养基中,A.f完全氧化Fe2+的时间由5 d缩短至3 d,表明连续转接驯化可以明显提高A.f对Mn2+的耐受性。将驯化培养基中Mn2+的质量浓度逐步提高至10.8、16.2、21.6、28.8和34.2 g/L,A.f完全氧化驯化培养基中Fe2+的时间由1 d逐步延长至6 d。滕青等[16]研究表明,Mn2+质量浓度越大,A.f对环境的适应性越弱,迟缓期越长,A.f的比生长速率越小,进入对数期的时间越久。因此,随着Mn2+质量浓度升高,A.f适应时长延长的主要原因可能是A.f的生长活性受到抑制。
当驯化培养基中的Mn2+质量浓度达到41.4 g/L时,A.f完全氧化驯化培养基中Fe2+的时间为8 d。主要原因可能是高质量浓度的Mn2+对A.f产生明显的生理毒害作用,部分A.f因不能适应环境而死亡,导致A.f的数量减少,从而影响其对Fe2+的氧化速率。当驯化培养基中Mn2+质量浓度达到45.0 g/L,A.f的适应时长发生突变,完全氧化Fe2+所需时间为16 d,表明A.f代谢完全受到抑制,生长活性减弱,此时的质量浓度即为A.f生长可耐受的Mn2+浓度限值。
2.3 A.f耐Cr3+驯化试验
A.f耐Cr3+驯化的试验结果见表3。

表3 A.f耐Cr3+驯化试验结果
从表3可看出,Cr3+对A.f的毒害及阻生作用极其强烈。有关文献[17]报道,在Cr3+浓度较低时,可抑制A.f生长。当驯化培养基中Cr3+质量浓度仅为0.3 g/L时,A.f完全氧化Fe2+的时间为4 d,比对照样中A.f完全氧化Fe2+的时间延长了3.5 d。Cr3+质量浓度为0.6和0.9 g/L的驯化培养基中,A.f完全氧化Fe2+也需要6 d的时间,表明即使较低质量浓度的Cr3+也能明显抑制A.f的生长和氧化活性。
将在Cr3+质量浓度为0.9 g/L的驯化培养基中驯化过的A.f逐级连续转接至1.2和1.5 g/L的培养基中,A.f完全氧化Fe2+的时间均为4 d,比在Cr3+质量浓度为0.9 g/L的驯化培养基中的驯化时间缩短了2 d。结果表明连续转接驯化有效提高了A.f对Cr3+的耐受性,在较短时间内适应了新环境,氧化活性得到了提高。
将驯化培养基中的Cr3+质量浓度提高至1.8 g/L后,连续转接驯化后A.f完全氧化Fe2+的时间成倍增长,达到9 d,表明该质量浓度对A.f产生了很强的抑制作用,导致A.f氧化活性明显降低。当驯化培养基中Cr3+质量浓度提高至2.1 g/L时,A.f的生理活动受到较强的毒害,氧化活性明显降低,即达到A.f生长可耐受的Cr3+浓度限值。
2.4 A.f耐Pb2+驯化试验
A.f耐Pb2+驯化的试验结果见表4。
从表4可看出,将A.f接种到Pb2+质量浓度分别为1.0、1.5和2.0 g/L的驯化培养基中,其完全氧化Fe2+的时间由0.5 d延长至5 d。该现象表明,Pb2+对A.f的生长活性影响较大。当驯化培养基中Pb2+质量浓度逐渐增大时,A.f的活性明显降低,其生长受到抑制。晏铭等[18]的研究同样表明,A.f对Pb2+有一定的耐受性,通过驯化能筛选出耐受性强、生长活性高的性能优良的菌种。
将Pb2+质量浓度为2.0 g/L的驯化培养基中的A.f接种至Pb2+质量浓度为2.5 g/L的驯化培养基中,A.f完全氧化Fe2+的时间由5 d缩短至3 d。结果表明A.f在连续转接驯化下,很快适应了环境,增强了其对Pb2+的耐受性。将上一级驯化的菌液再次转接到Pb2+质量浓度为3.0 g/L的驯化培养基中,A.f完全氧化Fe2+的时间由3 d延长至8 d,表明3.0 g/L的Pb2+对A.f产生了明显的抑制作用。
当驯化培养基中Pb2+质量浓度达到3.5 g/L时,A.f需要相当长一段时间(17 d)来适应这一浓度,A.f生长基本处于停滞状态,细菌的氧化活性受到较强的抑制作用,此时的质量浓度即为A.f生长可耐受的Pb2+浓度限值。
3 结论
1)Cu2+、Mn2+、Cr3+和Pb2+的质量浓度越高,对A.f的生理毒害作用及生长抑制作用越明显。4种重金属离子对A.f的生理毒害作用的强弱排序为Cr3+>Pb2+>Cu2+>Mn2+。
2)接种比例为50%的连续转接驯化是一种可有效提高A.f对重金属离子的耐受性和A.f的氧化活性的驯化方式。经连续转接驯化后,A.f对重金属离子的耐受能力明显提高,生长停滞期缩短,氧化活性显著提高。
3)在接种比例为50%的连续转接驯化条件下,A.f对Cu2+、Mn2+、Cr3+和Pb2+的耐受限值分别为34.0、45.0、2.1和3.5 g/L。当重金属离子的质量浓度在耐受限值内时,连续转接驯化可以快速提高A.f对重金属离子的适应性及A.f的氧化活性;当重金属离子质量浓度高于耐受限值时,A.f的生长基本处于停滞状态,氧化活性较低。在后续的研究中可进行高浓度下的等浓度连续转接驯化培养,以最大限度地提高A.f对重金属离子的耐受性。
