MiR-25-3p靶向NOTCH1对食管鳞癌细胞ECA109侵袭、迁移、增殖的影响
2020-02-14薛亚军杜雅彦周奕君董星星魏育涛
薛亚军,杜雅彦,周奕君,董星星,魏育涛,4
食管癌(esophageal cancer, EC)是全球第八大常见癌症,也是癌症相关死亡的第六大常见原因[1]。食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)占高危地区EC所有组织学类型的90%,在中国中北部,ESCC发病率和死亡率排名第一[2]。NOTCH的信号转导基因包括NOTCH1、NOTCH2、NOTCH3和NOTCH4等四种受体[3],参与细胞增殖、分化、凋亡、转移和黏附。NOTCH1的失调与癌症密切相关[4-5]。
miR-25是位于染色体7q22.1上的假定致癌基因,在各种癌症中高表达,并在许多恶性肿瘤相关过程中发挥功能,如癌症形成、增殖、凋亡和迁移[4]。多种分子途径也是miR-25在各种癌症中的靶点[6]。然而,miR-25对ESCC中的作用和分子机制仍不清楚。该研究主要关注ESCC中miR-25-3p与NOTCH1的相关性,探讨其对ESCC细胞的可能作用机制,为ESCC的诊断和治疗提供实验依据。
1 材料与方法
1.1 主要试剂、仪器与细胞系人ESCC细胞株ECA109购自于中科院上海细胞库,引物及内参均由上海生工公司设计合成;miRNA模拟物及抑制物由上海吉玛制药公司设计合成;NOTCH1的过表达质粒和小干扰RNA(siRNA)干扰片段由GenePharma公司构建。LipofectAMINETM 2000转染试剂购自于美国Invitrogen公司;Transwell小室及Matrigel基质胶购自于美国Corning公司;CCK-8试剂盒购自于上海气海复泰有限公司;miRcute系列细胞miRNA提取及检测试剂盒购自于北京天根生化科技有限公司。
1.2 资料来源参考数据库①本研究选取PicTar(http://pictar.org/)、miRGen(http://www.diana.pcbi.upenn.edu/miRGen.html)、TargetScan (http://www.targetscan.org/vert_50//)、miRWalk(http://www.microrna.org/microrna/)和miRDB(http:// mirdb.org / miRDB /)5个预测网站进行。为了减少软件预测的假阳性,取至少同时满足2个预测软件的基因才能作为靶基因。②应用TargetScan预测miR-25-3p与NOTCH1 3′-UTR的互补结合位点。
1.3 细胞培养与转染将细胞系在Roswell Park Memorial Institute(RPMI)1640培养基混合物中培养,其中混合有10%胎牛血清(FBS),放置于含有5% CO2、温度为37 ℃的细胞培养箱中培养。实验组分成两组:第1组:miR-25-3p上调组(转染miR-25-3p模拟物,使miR-25-3p表达量提高)、miR-25-3p下调组(转染miR-25-3p抑制剂,使miR-25-3p表达量降低)和NC组(脂质体包裹NC序列,不影响miR-25-3p的表达);第2组:NOTCH1上调组(转染NOTCH1模拟物,使NOTCH1表达量提高)、NOTCH1下调组(转染NOTCH1抑制剂,使NOTCH1表达量降低)和NC组(脂质体包裹NC序列,不影响NOTCH1的表达)。NOTCH1的过表达质粒是pcDNA3.1(+)NOTCH1。其阴性对照质粒为pcDNA3.1(+)NC,不含NOTCH1基因的启动子区。分别用miR-25-3p模拟物、抑制剂,NOTCH1模拟物、抑制剂和相对阴性对照转染ECA109细胞系。该公司合成的模拟物按照推荐量用无酶水稀释,脂质体Lipofectmine 2000与模拟物的比例根据细胞状态和qRT-PCR结果进行调整。miRNA-25-3p 模拟物、抑制剂和NOTCH1 模拟物、抑制剂的靶序列如表1所示。转染24 h后更换为完全培养液继续培养24 h,收集后用于后续试验。
1.4 实时荧光定量PCR法检测miR-25-3p的表达水平使用miRNeasy Mini Kit从细胞中分离RNA。以260~280 nm光密度(OD)比评估RNA质量。应用miRcute Plus miRNA First-Strand cDNA Synthesis Kit和PrimeScript RT Reagent Kit将RNA逆转录为cDNA。应用SYBR Premix Ex Taq试剂盒用于定量mRNA。在CFX96实时热循环仪中进行检测。该研究中使用的寡核苷酸列于表1中。所有miRNA样品用U6标准化,而mRNA样品用GADPH标准化。通过使用2-ΔΔCT方法计算相对表达水平。

表1 实验相关引物序列列表
1.5 Transwell侵袭试验检测细胞侵袭能力将细胞在未添加胎牛血清的OPTI-MEM培养基中饥饿处理6 h。将细胞悬浮于1 ml无血清培养基中,并将100 μl(1×105)细胞接种到24孔板的上室中,在下室中加入600 μl含有10%FBS的RPMI 1640培养基。置于细胞培养箱培养48 h后,用棉签旋转擦去上室面上未穿膜的细胞,多聚甲醛固定20 min后用0.5%结晶紫染色。在100×放大倍率下获得横跨下膜的5个视野的图像。使用ImageJ计数细胞。
1.6 CCK-8法检测细胞增殖能力将ECA109细胞以每孔4 000个细胞的密度接种到96孔微量培养板上,并在含有10% FBS的RPMI 1640培养基中培养12 h。将在OPTI-MEM培养基中培养的细胞设定为对照组。37 ℃培养48 h后,将每个孔与10 μl CCK-8混合,并在37 ℃下进一步培养3 h。使用分光光度计在450 nm处检测OD值。以时间为横轴,OD值为纵轴绘制细胞生长曲线。
1.7 双荧光素酶报告基因检测在NCBI数据库中搜索NOTCH1启动子区基因序列。将荧光素酶质粒(2 001 bp)及其剪接变体荧光素酶报告基因质粒(1 501、1 001和501 bp),hsa-miR-25-3p过表达质粒和PRL-TK Renilla荧光素酶质粒转染到293T细胞。用于检测的设备包括全波长扫描酶标仪和Dual-Glo®荧光素酶测定系统。样品加载试验采用以下步骤:①将Dual-Glo®荧光素酶试剂加入板中;②在20~25 ℃温育10 min;③测量萤火虫发光;④加入100 μl Stop & Glo®Reagent试剂到板上;⑤在20~25 ℃温育10 min;⑥测量海肾发光;⑦计算每个孔的萤火虫/海肾发光的比例;⑧将样品孔中的比例标准化为对照孔(或一系列对照孔)中的比率。
1.8 统计学处理应用SPSS 17.0软件进行分析。每组的数据均进行3次重复。当数据处于正态分布时,使用两个独立样品的Student-T检验,三个或更多个独立样品的单向ANOVA评估组间差异。当数据不符合正态分布时,使用Kruskal-Wallis H检验评估组间差异,对具有三个或更多独立样本的数据进行统计分析,并使用Wilcoxon秩和检验对两个独立样本的数据进行统计分析。P<0.05为差异有统计学意义。
2 结果
2.1 miR-25-3p及NOTCH1的转染效率质体包裹经化学修饰的合成miR-25-3p和NOCH1转染ESCC细胞系ECA109,使miR-25-3p和NOTCH1在ECA109细胞中差异表达,以研究其调控机制。实验分组见1.3项,转染完成后,使用qRT-PCR检测三组细胞miR-25-3p和NOTCH1表达量,结果显示上调组较NC组,表达量明显升高;下调组较NC组表达量明显降低(图1),差异有统计学意义(P<0.05),说明miR-25-3p和NOTCH1的模拟物和抑制剂成功转入细胞。
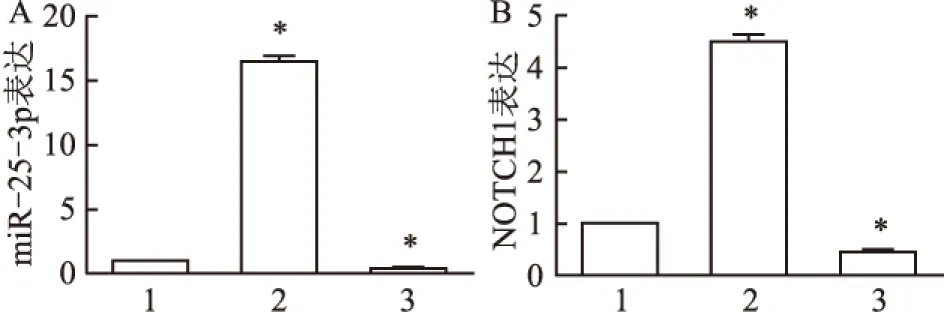
图1 miR-25-3p及NOTCH1的转染效率
A:miR-25-3p的转染效率(1. NC组;2.miR-25-3p上调组; miR-25-3p下调组);B:NOTCH1的转染效率(1. NC组;2.NOTCH1上调组; NOTCH1下调组);与NC组相比,*P<0.05
2.2 荧光素酶验证NOTCH1与miR-25-3p的靶向关系通过搜索TargetScan数据库,在NOTCH1的3′UTR中发现了一个保守位点。本课题组进行了荧光素酶报告分析,以评估miR-25-3p是否靶向调控293T细胞中的Notch1 mRNA。ECA109细胞用于确定miR-25-3p的抑制和过表达是否会影响NOTCH1 mRNA的表达水平。首先,检查NOTCH1的3′UTR以确定整个区域是否是miR-25-3p的功能靶标。荧光素酶报告基因测定证实NOTCH1的3′UTR是miR-25-3p的实际靶标(图2A)。NOTCH1的3′UTR中的一个保守位点被确认为实际功能位点。在miR-25-3p转染48 h后荧光素酶活性被显着抑制(NOTCH1的3′UTR中miR-25-3p靶位点的位置为第1 602~1 608个位点。该结果表明该特异性位点为miR-25-3p靶向位点(图2B)。在用miR-25-3p模拟物转染的ECA109细胞系中,NOTCH1 mRNA表达水平显著降低(图2C)。进行蛋白质印迹分析以证实miR-25-3p表达与ECA109细胞系中的NOTCH1表达呈负相关。miR-25-3p下调组ECA109细胞系中NOTCH1表达水平显著升高,miR-25-3p上调组ECA109细胞系中NOTCH1表达水平显著降低(图2D)。
2.3 miR-25-3p促进细胞迁移和侵袭将miR-25-3p模拟物和抑制剂转染到ECA109细胞中时,进行基质胶侵袭测定以检查miR-25-3p对ECA109细胞侵袭的影响。如图3A所示,上调组的下室中的细胞多于NC组的细胞,表明miR-25-3p可促进ECA109细胞的侵袭(P<0.05,图3B)。CCK-8增殖试验显示在ECA109细胞中上调miR-25-3p可促进细胞增殖(P<0.05,图3C)。这些数据表明miR-25-3p可促进ESCC细胞侵袭和增殖。
2.4 NOTCH1抑制ESCC细胞迁移和侵袭将NOTCH1模拟物和抑制剂质粒转染到ECA109细胞中,使用qRT-PCR检测NOTCH1的水平。NOTCH1 下调组下室中的细胞数多于NC组(图3A),NOTCH1的缺乏也增强了ECA109细胞的侵袭能力(P<0.005,图3B),CCK-8增殖试验显示在ECA109细胞中下调NOTCH1可促进细胞增殖(P<0.05,图3C)。NOTCH1上调组的下室中细胞数比NC组中少(P<0.005,图4A),NOTCH1的上调抑制ECA109细胞的侵袭能力(P<0.005,图4B)。CCK-8增殖测定显示NOTCH1上调抑制细胞生长(P<0.05,图4C)。这些数据表明NOTCH1负调控ESCC细胞侵袭和增殖。此外,miR-25-3p上调和NOTCH1下调对侵袭和增殖发挥相同的作用。
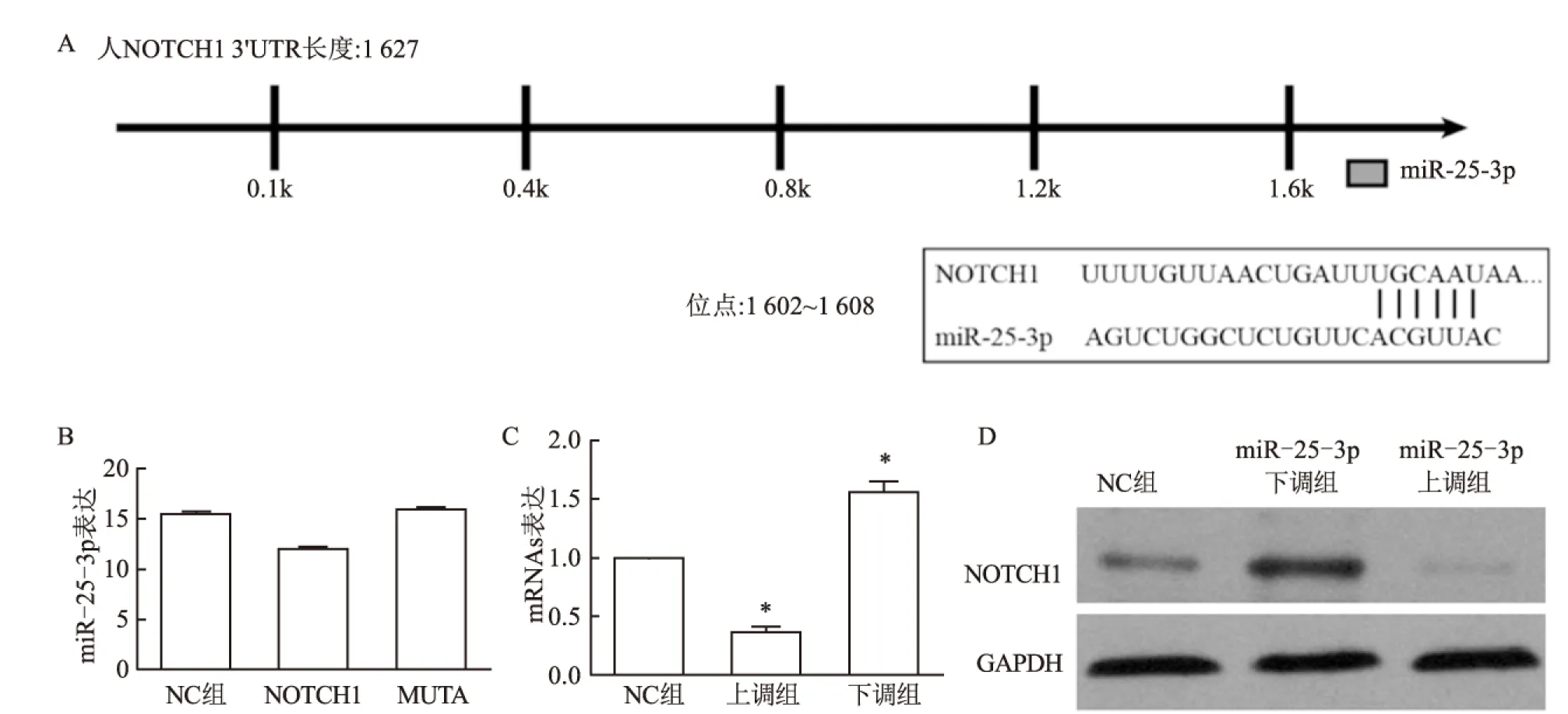
图2 荧光素酶验证NOTCH1与miR-25-3p的靶向关系
A:miR-25-3p与NOTCH1的保守结合位点的示意图;B:NOTCH1的3′端非编码区是miR-25-3p的靶标之一;C:上调miR-25-3p后,NOTCH1 mRNA水平下降;下调miR-25-3p后,NOTCH1 mRNA水平升高,与NC组相比:*P<0.05;D:下调miR-25-3p后,NOTCH1蛋白表达增多;上调miR-25-3p后,NOTCH1蛋白表达减少
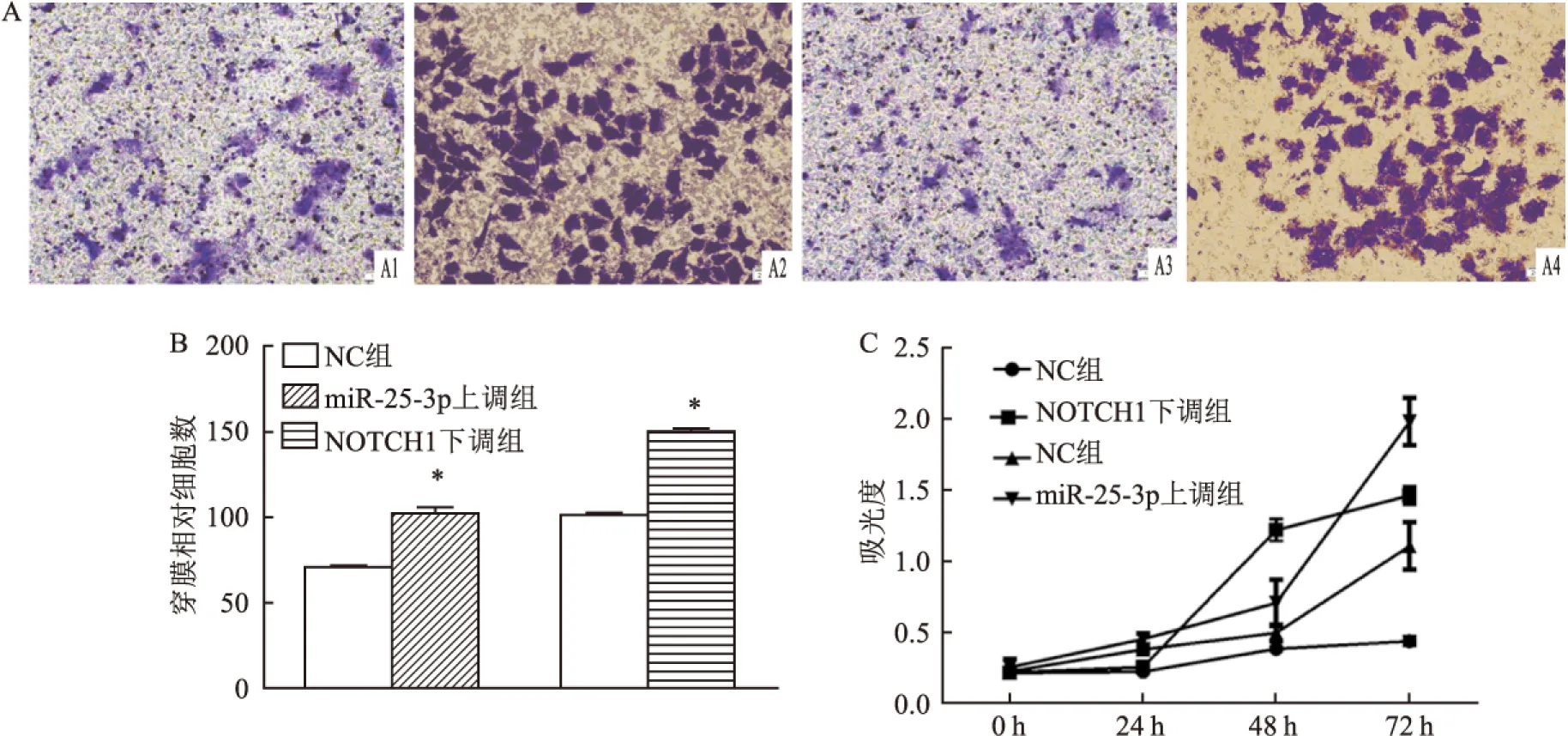
图3 Transwell和CCK-8实验检测miR-25-3p和NOTCH1上调和下调后对ECA109细胞增殖和迁移能力的影响
A:显微镜100倍下观察穿过Transwell小室的相对细胞量;1:miR-25-3p上调组;2:NOTCH1下调组;3:NC组(miR-25-3p实验组);4:NC组(NOTCH1实验组);B:穿过Transwell小室的相对细胞数;C:CCK-8法检测细胞增殖能力;与NC组比较:*P<0.05
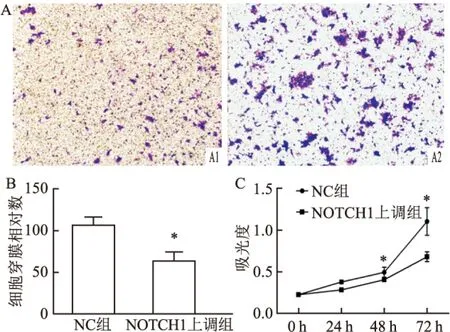
图4 Transwell和CCK-8实验检测NOTCH1上调后对ECA109细胞增殖和迁移能力的影响
A:显微镜100倍下观察穿过Transwell小室的相对细胞量; 1:NOTCH1上调组;2:NC组;B:miR-25-3p上调组穿膜细胞相对数;C:NOTCH1上调组CCK-8增殖测定;与NC组比较:*P<0.05
3 讨论
至2012年,全球共发生255 800例 EC和400 200例死亡病例[7]。 ESCC是EC的主要病理分型之一,也是最常见的亚型。最近有研究表明细胞癌变是由异常信号转导引起的,癌细胞是由异常增殖信号诱导的。
miRNA和蛋白质是特殊的生物学标志物,有助于癌症的早期诊断。它们也是新的治疗目标,有助于癌症预后评估。最近发现越来越多的miRNA在各种癌症中差异表达,因此,它们是潜在的生物标志物,可以作为临床实践中补充的癌症生物标志物。研究[8]表明,miRNA-21抑制剂可能通过下调Bcl-2的表达诱导人 EC细胞ECA109的凋亡。miR-25 、miR-106b、miR-21、miR-203和miR-145是ESCC中关键的差异表达miRNA[9],其具体的作用机制尚未见有文献报道。其他研究确定了miR-106b-25与肿瘤发生的关联及其在肿瘤形成过程中上调[10]。Kan et al[11]的研究表明miR-106b-25具有潜在的抗细胞凋亡作用,并在体外实验中进行验证发现可以促进细胞周期。Kim et al[12]证实了miR-25的高表达与胃癌淋巴结转移之间的正相关性。同样,miR-25在EC中高表达,其高表达与淋巴结转移显著相关。在本研究中,通过转染对miR-25进行过表达及抑制,然后进行ECA109细胞系迁移、侵袭和增殖的测定,结果表明miR-25过表达促进ESCC细胞转移和侵袭。
NOTCH蛋白是一种跨膜受体,从蠕虫到人类在结构和功能上都具有保守性。NOTCH信号通路在ESCC中失调。该途径可能调控组织发育和体内平衡。此外,NOTCH信号通路与癌症干细胞的自我更新、增殖、分化和凋亡有关。因此,NOTCH信号传导是ESCC的潜在治疗靶标。研究[13]表明,NOTCH1信号通路是许多器官中的关键信号通路,可调节细胞分化和凋亡,影响许多生物过程的发育和功能。这一发现表明NOTCH1是一种有前景的EC生物标志物,具有重要的理论意义。
本课题组前期研究发现,miR-25-3p在ESCC中高表达,提示miR-25-3p与ECSS的发生发展相关。本研究通过体外细胞实验及双荧光素酶实验发现,NOTCH1抑制ECA109细胞增殖和迁移,miR-25-3p促进ECA109细胞增殖和迁移,而miR-25-3p靶向调控NOTCH1的表达,从而得出结论;miR-25-3p可能通过靶向负调控NOTCH1的表达来促进ESCC细胞的侵袭和增殖,从而促进ESCC的发生和发展。因此,miR-25-3p可作为预测ESCC预后或治疗靶点的潜在生物标志物。但是,肿瘤的发生和发展受到很多因子和信号通路的协同作用,本研究的发现在ESCC中是否具有主要作用尚需要进一步深入研究。
