Wipe Test在HLA组织配型实验室污染监测及预防管理中的应用
2020-02-13武君华尚利侠王小芳王天菊王满妮
武君华,尚利侠,陈 乐,王小芳,王天菊,王满妮,房 婕,齐 珺
陕西省血液中心西安市中心血站血型研究室 710061
人类白细胞抗原(HLA)系统是迄今为止基因多态性最高的复合体之一,而HLA基因分型是影响造血干细胞移植和器官移植成败及疗效的重要因素之一,确定高分辨水平的基因分型将有助于提升移植成功率[1]。根据国际免疫遗传学数据库IMGT/HLA统计数据3.35版,截止2019年4月已发现HLA-A等位基因4 846个,HLA-B等位基因 5 881个,HLA-C等位基因4 654个,HLA-DRB1等位基因2 444个,HLA-DQB1等位基因1 498个(http://www.ebi.ac.uk/imgt/hla/stats.html),可见其高度的复杂性和多态性。随着现代分子生物学和生物工程技术的发展,HLA基因分型技术已由一代测序向二代、三代测序技术升级,但Sanger直接测序法(PCR-SBT)仍为目前HLA基因分型的金标准。此外,组序列特异性引物(GSSP)DNA单链测序、聚合酶链反应-序列特异性寡核苷酸探针(PCR-SSO)等技术也是常用的补充方法[2]。无论选择哪一种分型方法,均需建立在PCR的基础上,它可将DNA片段扩增到百万倍甚至更多,且扩增产物在后续的PCR循环中能再次被扩增,容易造成实验室污染风险[3]。而污染无论来自基因组DNA还是扩增产物,均可导致假阳性,干扰HLA基因型别的判读,出现错误的实验结果。因此,HLA组织配型实验室应建立严格的防污染程序,并进行常规的DNA污染监测及预防管理。本研究通过建立一种敏感的针对HLA-Ⅰ类和Ⅱ类基因扩增区域内的非多态区序列特异性引物(SSP)混合检测扩增方法,即擦拭试验(Wipe Test)方案以及包含一系列纠正预防措施在内的综合体系,旨在建立实验室常规DNA防污染监测体系,预防和消除可能会干扰检测准确性的PCR产物或基因组DNA的污染,促进并持续改进HLA组织配型实验室质量管理体系。
1 资料与方法
1.1标本来源 标本来自15个监测点,涉及HLA基因分型全过程,包括核酸提取区、PCR加样区、PCR扩增区和下游产物处理区4个区域共计15处取样点。
1.2仪器与试剂 高速离心机(日本KUBOTA 3300),PCR仪(德国 SENSO公司),电泳仪(北京六一,DYY-6D),凝胶成像仪(中国上海,Tanon1600),涡旋混合器(VORTEX,G-560E),无菌镊子,恒温水浴箱(GFL,1004),Wipe Test污染检测试剂(赛默飞世尔科技公司,批号006)。
1.3方法
1.3.1Wipe Test方案设计 首先设计针对本次试验整体的阴、阳性对照,以及针对每个监测点的抑制对照反应孔和4个监测区域的开管阴性对照。阳性对照以试剂盒自带阳性DNA标本为模板,并加入反应所需的全部试剂,其目的为证明扩增反应体系可正常工作;阴性对照以超纯水取代DNA模板,包含除模板DNA外的所有试剂,其目的为检测反应体系的污染;抑制对照孔的模板包含相同体积的监测点标本DNA和试剂盒阳性基因组DNA;设置开管阴性对照的目的为检测空气中气溶胶,将一次性无菌EP管在工作区开盖放置至少1 d后,加入超纯水和扩增反应混合液进行扩增。监测点采样需全面、分布均匀、独立采集且互不交叉,包括(1)核酸抽提区:离心机,超净工作台台面,加样枪,冰箱门把手,开管阴性对照;(2)PCR加样区:加样台台面,加样枪,开管阴性对照;(3)PCR扩增区:PCR仪内孔,开管阴性对照;(4)下游产物处理区:加样枪,加样台台面,离心机,冰箱门把手,开管阴性对照。擦拭区监测点标本的具体制备方法为使用在超纯水中浸湿的一次性无菌棉签擦拭监测取样点10 cm2的区域,将棉签放入1.5 mL离心管中,加120 μL超纯水,涡旋振荡;56 ℃孵育1 h后以7 000 r/min的转速离心30 s,4 ℃条件下保存备用。
1.3.2混合检测扩增体系 将处理好的15个监测点标本1 μL、阳性对照标本1 μL、阴性对照标本1 μL和每个监测点抑制对照孔标本2 μL(监测点标本1 μL+阳性对照标本1 μL)分别加入反应板中;向反应板中每孔加入制备好的PCR mix 8.6 μL(具体体系为PCR Buffer 6 μL,Deionized water 2.5 μL,Tap酶0.1 μL),各孔总反应体系为9.6 μL(每个监测点抑制对照孔终体系为10.6 μL),盖紧封口盖,充分混匀后离心。
1.3.3PCR反应及凝胶电泳 将上述扩增体系置入PCR仪中,PCR反应程序如下;程序结束后对扩增后的产物进行2%琼脂糖凝胶电泳,并在Tanon1600凝胶成像仪上成像,判读结果。扩增程序为:(1)96 ℃ 25 s,70 ℃ 25 s,72 ℃ 45 s,循环5次;(2)96 ℃ 25 s,65 ℃ 50 s,72 ℃ 45 s,循环21次;(3)96 ℃ 25 s,55 ℃ 60 s,72 ℃120 s,循环4次。扩增结束后将反应产物置于4 ℃环境下保存。
2 结 果
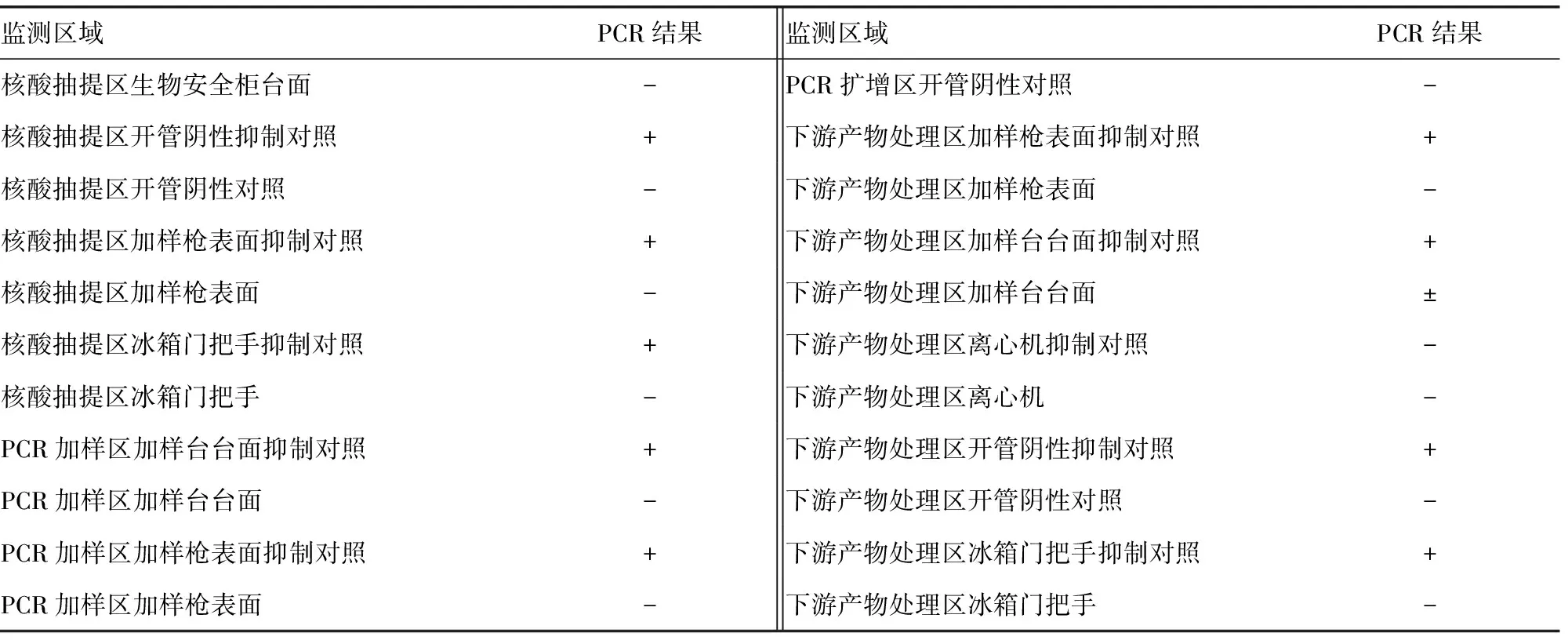
2.1第1季度首次Wipe Test结果 阳性对照孔和标本抑制对照孔中均有PCR产物出现;阴性对照孔中无PCR产物出现。核酸抽提区离心机抑制对照孔和下游产物处理区离心机抑制对照孔均无反应,提示这2处采集点PCR可能被样品中的物质所抑制,其对应的“擦拭区待检标本孔”的结果无效;其他标本抑制对照孔均有反应,出现PCR产物;下游产物处理区加样台台面为弱阳性结果,提示下游产物处理区存在基因组DNA或PCR产物的污染,需及时处理。除以上3个监测点外,其余监测点均为阴性,无DNA或PCR扩增产物的污染,见表1和图1。

表1 第1季度首次Wipe Test 监测结果
续表1 第1季度首次Wipe Test 监测结果
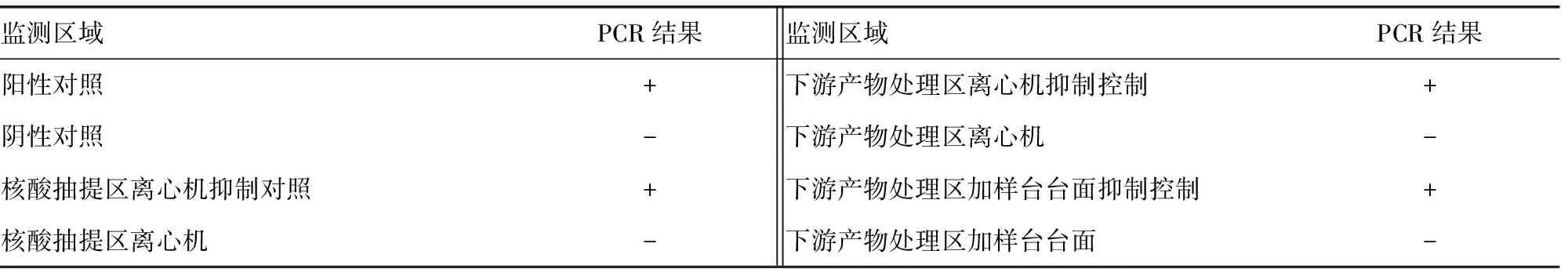
表2 处理及整改后Wipe Test 监测结果
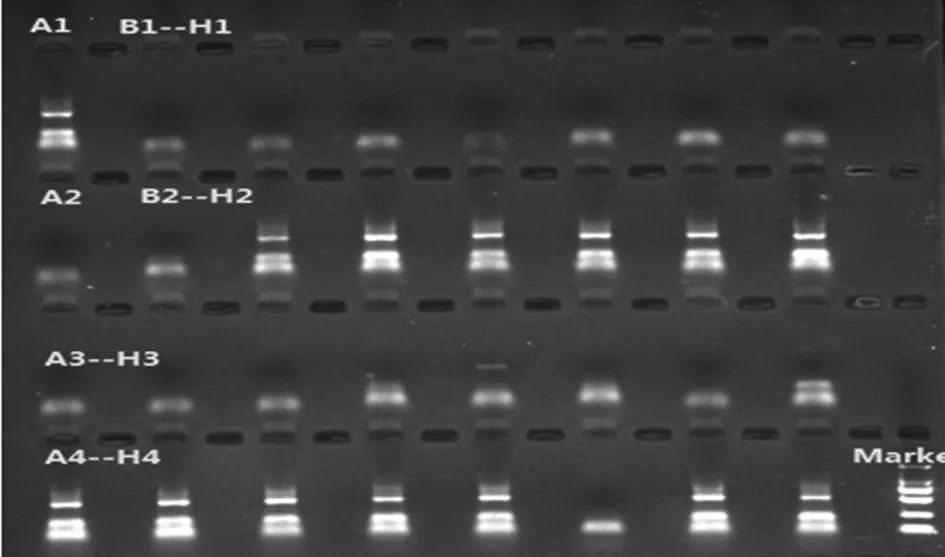
注:A1为阳性对照; A2为阴性对照; B1-H1为样本孔(核酸抽提区:离心机,生物安全柜台面,开管阴性对照,加样枪,冰箱门把手;PCR加样区:加样台台面,加样枪);B2-H2为B1-H1样本对应抑制对照孔;A3-H3为样本孔(PCR加样区:开管阴性对照;PCR扩增区为PCR仪内孔,开管阴性对照;下游产物处理区为加样枪,加样台台面,离心机,开管阴性对照,冰箱门把手);A4-H4为A3-H3样本对应抑制对照孔。
图1首次Wipe Test结果
2.2局部灭活方案和验证结果 Wipe Test结果表明2处监测点抑制对照孔无反应,1处监测点反应弱阳性,出现PCR产物污染的可能性较大,深入分析原因并立即对此3处施行局部灭活方案。首先用含氯量为2 000 mg/L的次氯酸钠消毒液覆盖30 min,再用75%乙醇溶液擦洗以去除残留物,超纯水彻底清洗干净、干燥,最后进行紫外线(波长一般选择254~300 nm)照射消毒30 min。灭活验证采用对相应监测点重新采样进行Wipe Test,结果显示局部灭活有效。见表2和图2。
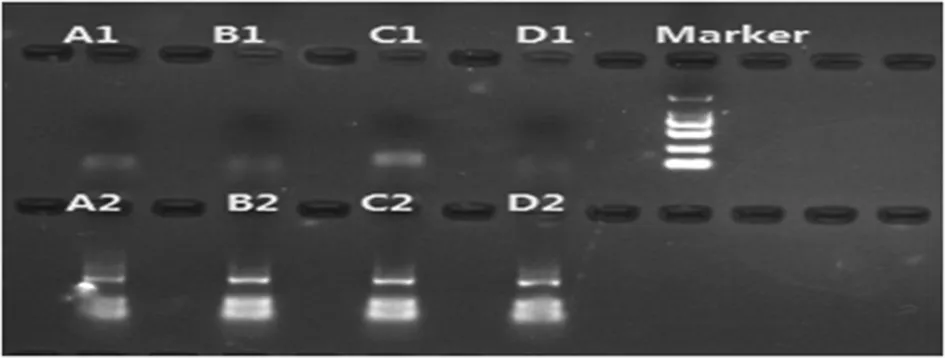
注:A1为阴性对照;A2为阳性对照;B1为核酸抽提区离心机;B2为核酸抽提区离心机抑制对照;C1为下游产物处理区离心机;C2为下游产物处理区离心机抑制对照;D1为下游产物处理区加样台台面;D2为下游产物处理区加样台台面抑制对照。
图2阳性区灭活处理及整改后Wipe Test结果
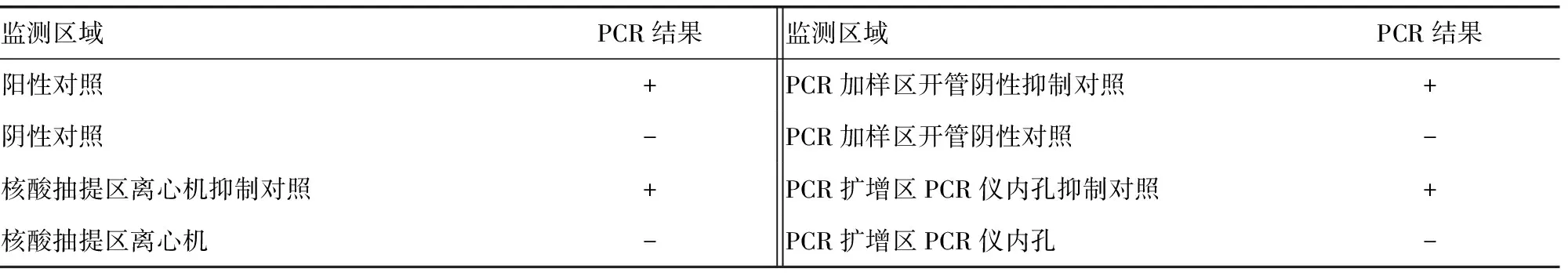
表3 HLA组织配型实验室第3季度各监测点Wipe Test结果
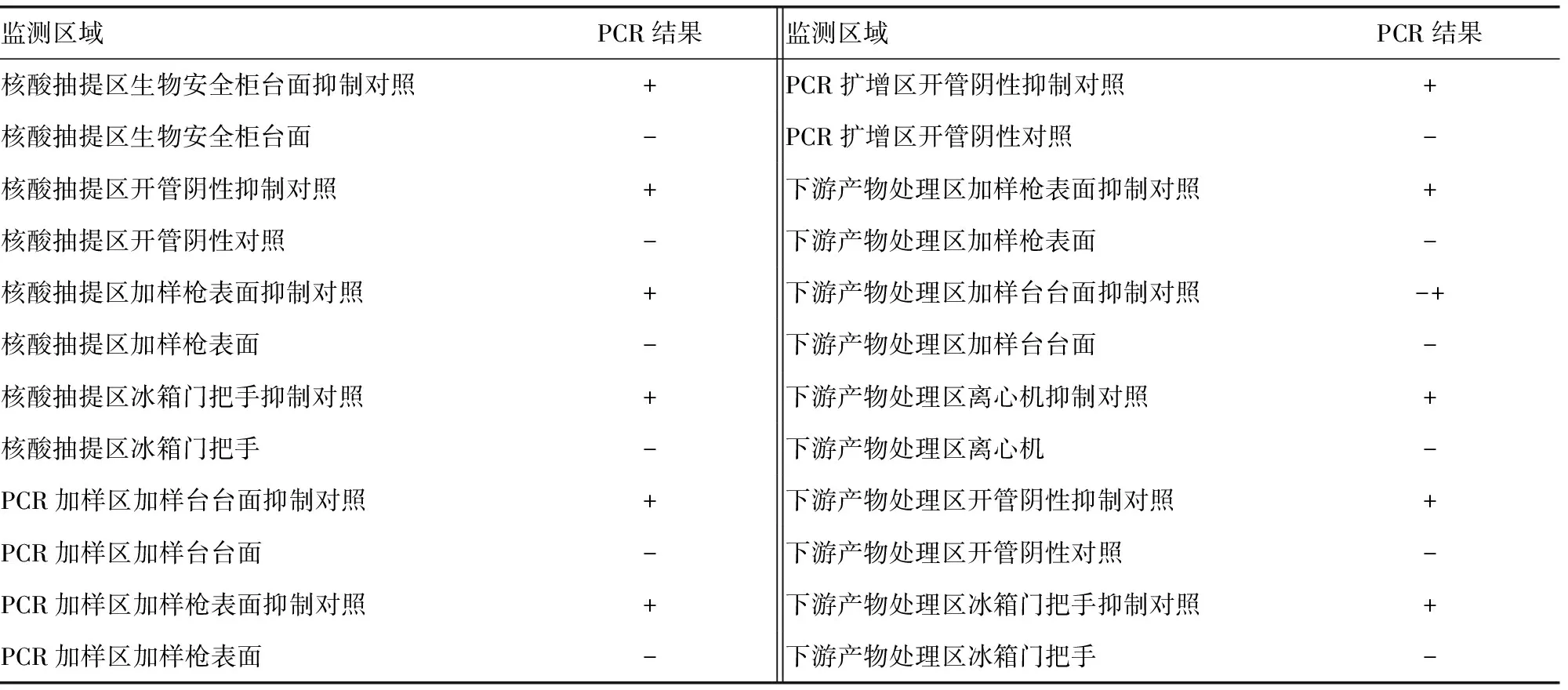
续表3 HLA组织配型实验室第3季度各监测点Wipe Test结果
2.3定期与不定期监测结果 为确保整体试验过程的零污染,采取每2~3周不定期抽查监测与每3个月定期全面监测相结合的方式进行质量管理。对于容易发生DNA污染的区域加强抽检。除第1季度首次进行Wipe Test时出现阳性结果外,再未出现提示发生污染的阳性结果。表3和图3为实验室对HLA分型实验过程中各个主要监测点进行的第3季度定期全面监测Wipe Test,结果均显示合格。
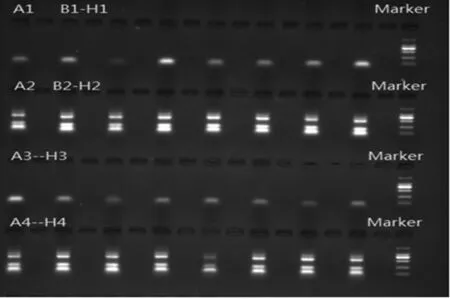
注:A1为阴性对照;A2为阳性对照;B1-H1为样本孔(核酸抽提区:离心机,生物安全柜台面,开管阴性对照,加样枪,冰箱门把手;PCR加样区:加样台台面,加样枪);B2-H2为B1-H1样本对应抑制对照孔;A3-H3为样本孔(PCR加样区:开管阴性对照;PCR扩增区为PCR仪内孔,开管阴性对照;下游产物处理区为加样枪,加样台台面,离心机,开管阴性对照,冰箱门把手);A4-H4为A3-H3样本对应抑制对照孔。
图3 HLA实验过程主要监测点Wipe Test结果
3 讨 论
HLA组织配型是影响器官移植和骨髓移植存活率的重要因素之一[4],HLA基因分型检测技术具有灵敏度高、准确度高等优点,可检测出待测基因的型别,但同时对实验室人员、实验室设置、检测的技术流程以及质量控制等也提出了更高的要求。对HLA实验过程中污染的监测和控制已成为整体实验质量保证的重要环节。
Wipe Test检测针对HLA-Ⅰ类和HLA-Ⅱ类基因扩增区域内的非多态区设计特异性引物,此引物能检测到HLA组织配型实验室实验过程中干扰HLA基因分型的基因组DNA和(或)PCR产物的污染。为了确保试验结果的有效性,本研究设计了较为全面的反应链,每轮检测包括阴性对照、阳性对照、抑制对照和(或)开管阴性对照。阳性对照含有基因组DNA,可以检测本次实验引物是否有效;阴性对照不含已知来源的DNA,排除检测试剂或加样过程中的污染;开管阴性对照则用以检测实验室气溶胶的污染。此外,抑制对照孔用于检测试验体系中有无PCR抑制物的存在,正常为阳性;无PCR产物提示PCR反应可能被样品中的物质所抑制,则对应区域的“监测点样本管”结果无效。
首次监测试验结果出现核酸抽提区和下游产物处理区离心机抑制对照孔均无反应,表明该区域存在PCR抑制物;下游产物处理区加样台台面结果为弱阳性,提示存在污染,需立即启动去污染措施,并重复Wipe Test确认污染已成功去除。通过排查,发现核酸抽提区和下游产物处理区离心机的PCR之所以存在抑制物,是因为核酸抽提过程中大量使用不同水平的乙醇溶液进行滤洗和产物纯化,且未及时清除残留;下游产物处理区加样台台面的污染是由于扩增反应后实验人员在打开八联管时,开管动作较大,造成管内液体外溅到操作台台面。尽管下游产物处理区加样台台面样本为扩增后区,其阳性对上游PCR扩增影响不大,但为避免对HLA分型后期杂交扩增分析实验产生干扰,也应注意避免污染的发生。本研究对以上3个监测点采取了局部灭活处理,包括使用含氯漂白剂(次氯酸钠)和75%乙醇溶液擦拭清洁工作台面、紫外灯照射等措施清除残留的PCR产物等污染源,并通过Wipe Test复检试验验证了局部灭活的有效性。通过加强人员培训,强化规范操作意识,注重试验细节,严格遵循相应的质量控制程序,后续的不定期Wipe Test抽检和定期全面监测结果均为合格,未再出现此类情况。另一种污染灭活方法为酶灭活法,即在扩增时用dUTP代替dTTP参与PCR,生成dU化的扩增产物,这种产物因存在“非自然”状态下的碱基而与靶DNA相区别;通过将细菌的尿嘧啶糖苷酶(UNG)加入反应混合物,在扩增前进行一次消化,上次扩增残余的dU化的PCR产物就会被UNG降解,从而不能作为下一次扩增的模板[5]。对于以上两种扩增产物灭活方法(局部灭活法和酶灭活法),通过对经济、实际操作难易程度及灭活效果等方面进行对比,本实验室选择了局部灭活法对本实验室的扩增产物进行灭活,并取得了较好的成效。
PCR-SBT是在HLA分型实验中对HLA基因座上的2个等位基因同时扩增克隆,然后以两股基因组DNA片段的扩增混合物作为测序模板进行下游测序反应[2]。在整个HLA基因分型检测过程中,容易引起实验室污染的方面主要来自:(1)扩增产物的污染;(2)天然基因组DNA或RNA的污染;(3)试剂污染;(4)气溶胶污染及标本间交叉污染等[3,6-7]。其中扩增产物污染是PCR中最主要和最常见的污染,PCR产物拷贝量大,远远高于PCR检测数拷贝的标准,极微量的PCR产物污染就可造成假阳性[8]。另外,临床标本中存在的大量待测微生物,包括科研实验中得到的PCR产物、质粒克隆以及存在于实验室环境中的特定微生物等[9],这些也在实验过程中存在污染隐患。为保证整个HLA分型实验过程免受这些因素的污染,预防十分关键。质量控制是一种针对HLA分型实验流程管理的方案,包括诸多的环节,通过采用规章制度来保证标本、试剂、核酸和扩增产物等物质的无污染[10],并强化实验技术人员的业务水平,提高操作技能,对实验室工作人员进行防污染培训,强化实验室人员“无基因”或“无核酸”的意识。实验室应建立适合自身的污染监测和预防管理程序,制订切实可行的全面、严谨、系统、有效的监测、灭活、验证和预防方案,最大限度地降低实验室污染发生的概率,从而保证检测结果的精准性。
