以全血细胞减少为首发症状的系统性红斑狼疮并发自身免疫性低血糖1例报告及文献复习
2020-02-13史妍,孙艳,2,石光,于琼,唐艳
史 妍,孙 艳,2,石 光,于 琼,唐 艳
(1.吉林大学第二医院肿瘤血液内科,吉林 长春 130041;2.郑州大学第一附属医院消化内科,河南 郑州 450000)
系统性红斑狼疮(systemic lupus erythematosus, SLE)是一种原因不明、累及多系统损害的自身免疫性疾病,临床表现多样,易并发血液系统损害,甚至有很多患者是以血液系统异常为首发症状,容易被误诊。SLE典型特征是产生针对造血系统及其以外不同组织的自身抗体。因此,部分患者可在疾病的不同阶段并发不同组织受累的表现。某些自身免疫性疾病,如SLE和Graves病可伴发自身免疫性低血糖(autoimmune hypoglycemia,AIH)。其中B型胰岛素抵抗综合征(type B insulin resistance syndrome,TBIRS)是一种罕见的AIH,由KAHN等[1]在1976 年首次报道。截至2016年,全球报道不超过100例,国内仅有几例个案报道[2]。因胰岛素受体自身抗体(insulin receptor autoantibodies,IRAbs)检测的局限性,诊断率较低,目前有研究者[2]提出: IRAbs阳性不是TBIRS诊断的必需条件。现将本科收治的1例以全血细胞减少为首发症状且临床考虑并发TBIRS的SLE患者临床诊疗经过报道如下,并复习相关文献, 以期提高临床医生对该病的认识。
1 病例资料
1.1 一般资料 患者,男性,70岁,因头晕和乏力3个月、加重2周于2018年12月29日收入吉林大学第二医院肿瘤血液科。该患者入院前3个月无明显诱因出现头晕和乏力,于当地医院检测血常规发现全血细胞减少,2 d后就诊于某地三级甲等医院行骨髓形态学和病理检查示:骨髓有核细胞增生减低。行咖啡酸片治疗,效果欠佳。入院前2周乏力加重,且出现反复空腹低血糖,波动于1.9~3.0 mmol·L-1。病程中,患者偶有牙龈出血,无低热、皮疹和口腔溃疡,无口干和眼干,无腮腺肿痛、舌痛及舌面干裂,无关节疼痛。既往:“光过敏”病史3年,未系统诊治。无吸烟史及大量饮酒史。
1.2 查 体 患者身高180 cm,体质量75 kg,体质量指数(body mass index,BMI)23.1 kg·m-2。体温 36.5℃,脉搏80 min-1, 呼吸频率16 min-1,血压110/75 mmHg。一般状态尚可,意识清楚,自主体位,眼睑和甲床苍白,全身皮肤及黏膜无黄染、皮疹及出血点。无龋齿,全身浅表淋巴结未触及肿大。胸骨无压痛。双肺呼吸音粗,双下肺可闻及湿啰音。心率80 min-1,律齐,心音正常。肝、脾未触及肿大。双下肢无水肿。
1.3 检测指标 血常规:白细胞(WBC) 1.70×109L-1,血红蛋白(Hb) 49 g·L-1,血小板(PLT) 25.00×109L-1,网织红细胞计数 0.02×1012L-1。血生化:白蛋白20.30 g·L-1,球蛋白 60.20 g·L-1,血糖 3.37 mmol·L-1,甘油三酯 0.23 mmol·L-1,血沉 35 mm·h-1,尿蛋白>0.5 g·24 h-1。自身免疫抗体系列:抗干燥综合征A(SSA)抗体阳性(),抗干燥综合征B(SSB)抗体阳性(),52 kDa蛋白抗体阳性(),抗心磷脂抗体13 U·mL-1,抗核抗体(ANA)筛查 1∶1 000(<1∶100),ANA荧光模型为核颗粒型。补体系列:C3 244.0 mg·L-1,C4 <16.7 mg·L-1。糖代谢检查:葡萄糖耐量试验(OGTT),空腹血糖 3.74 mmol·L-1,餐后1 h血糖8.71 mmol·L-1,餐后2 h血糖12.00 mmol·L-1,餐后3 h血糖10.97 mmol·L-1,血清胰岛素(空腹)28.85 mU·L-1,血清C肽(空腹)0.28 μg·L-1,胰岛素自身抗体(IAA)(-),胰岛细胞抗体(ICA)(-)。骨髓形态学:粒系增生减低,成熟粒细胞较多;红系增生减低,以中晚幼细胞为主,形态无异常,成熟红细胞呈缗线状排列;淋巴细胞占21%,形态正常;全片共见巨核细胞1个,为裸核。骨髓病理:有核细胞增生减低。骨髓穿刺细胞学检查结果见图1(封三)。
1.4 影像学检查 胸和腹部CT:双肺间质性炎症,两侧胸腔积液,腹盆腔积液,腹腔内网膜改变。胰腺平扫+增强:胰腺形态和大小未见异常,内部密度均匀,未见异常密度影;增强扫描未见异常强化影。
1.5 临床诊断及治疗 患者无口干和眼干等症状,因PLT减少不能行唇腺活检,患者及家属拒绝完善泪膜破碎时间或角膜染色试验等相关检查。根据病史、临床表现、辅助检查及风湿免疫、肾病内科和内分泌等科室会诊,明确临床诊断:SLE(SLE-DAI评分 10分,中度活动),AIH。给予醋酸泼尼松片45 mg 口服,治疗5 d后,患者乏力症状好转,空腹血糖为7.52 mmol·L-1,餐后2 h血糖 10.4~14.2 mmol·L-1,餐后血糖升高为主,未服用降糖药,考虑激素作用。血常规:WBC 2.24×109L-1,Hb 73 g·L-1,PLT24.00×109L-1,提示糖皮质激素治疗有效,患者出院。治疗2周随访,空腹血糖6.3 mmol·L-1, WBC 2.30×109L-1,Hb 78 g·L-1,PLT 31.00×109L-1,泼尼松片加量至50 mg 口服。治疗2个月后随访,患者泼尼松片减量为40 mg 口服,患者未再出现空腹低血糖,复查血常规及空腹血糖结果分别见表1和图2。
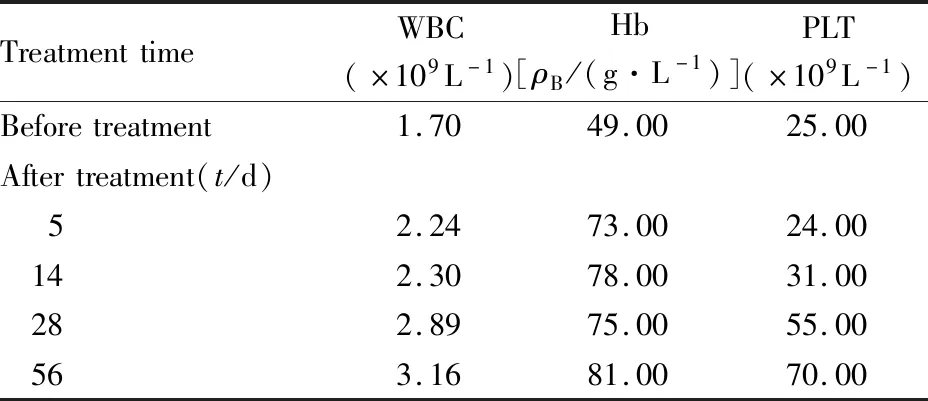
表1 SLE患者治疗前后血常规Tab.1 Blood routine examination of patient with SLE before and after treatment
2 讨 论
SLE是一种系统性自身免疫性疾病,首发症状复杂多样,易并发血液系统损害,常首发表现为一系、两系或全血细胞减少,血象异常发生率占SLE患者的85%以上。临床上SLE并发全血细胞减少症可发生在SLE典型症状出现之前,也可在其之后出现。SLE患者血液学改变缺乏特异性,临床易误诊为再生障碍性贫血(AA)、骨髓增生异常综合征(MDS)和Evans综合征等疾病。SLE患者骨髓穿刺常规检查和骨髓组织病理学检查发现异常的情况并不少见, 包括增生活跃性骨髓、低增生性骨髓、骨髓纤维化、再生障碍性骨髓、噬血现象和红系造血异常等[3]。CHEN等[4]进行的一项大规模荟萃分析表明:PLT减少可增加SLE患者死亡率和终末器官损害的风险。本例患者符合1997年美国风湿病学会SLE的分类标准,入院时以全血细胞减少为首发症状,多次骨髓检查提示低增生性骨髓、巨核细胞少见,但患者多种自身抗体阳性,补体C3和C4低下,为SLE诊断提供了线索。国内研究[5]报道:SLE患者血细胞减少的原因不单纯是自身抗体的破坏,尚存在其他未明确的原因。
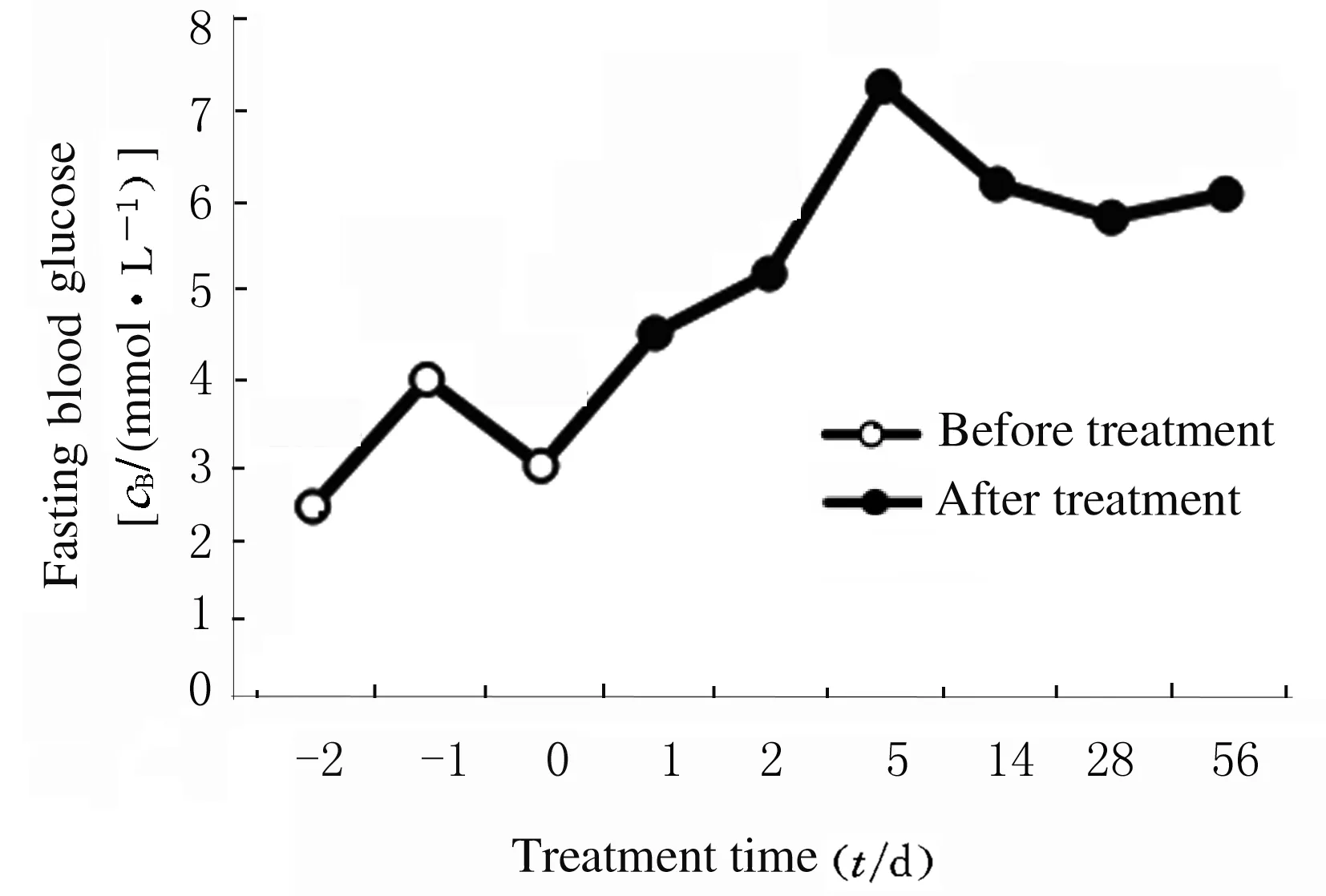
图2 SLE患者治疗前后空腹血糖水平Fig.2 Fasting blood glucose levels of patient with SLE before and after treatment
SLE患者体内可同时产生除造血系统以外不同组织的自身抗体,可在疾病的不同时期参与免疫介导的组织损伤[6-7]。而自身抗体介导的葡萄糖稳态异常是SLE的罕见特征。该患者就诊本院时出现反复空腹低血糖,胰腺CT检查未发现胰腺占位,排除其他原因低血糖,因此经多学科会诊考虑该患者为AIH。AIH是内源性抗体与胰岛素或胰岛素受体相互作用而引起的一种罕见的低血糖综合征。对AIH的认识非常重要,因为该综合征可能引起严重的低血糖症状,并可能与胰岛素瘤相混淆[8]。AIH一般分为TBIRS和胰岛素自身免疫综合征(insulin autoimmune syndrome,IAS,又名Hirata病)2种[9]。Hirata病的特征:多数亚洲患者都有相关的药物接触、感染、自身免疫性或血液病[10];未接触外源胰岛素;高胰岛素性低血糖,可发生在空腹和(或)餐后,但以餐后低血糖多见[11];IAA效价升高;胰岛病理检查结果无异常[10]。
TBIRS是由IRAbs导致的葡萄糖稳态异常,多伴发一种或多种其他自身免疫性疾病,其中最常见的为SLE,少见的与幽门螺旋杆菌感染[12]和HIV感染[13]有关。ARIOGLU等[14]在28年的随访中发现:24例TBIRS患者中,17例(70%)伴发SLE,1例伴发原发性胆汁性肝硬化,1例伴发骨髓瘤,5例未发现伴发其他相关疾病。最常见的临床表现是中或重度高血糖,其中有些患者出现严重的胰岛素抵抗,表现为不可控制的空腹及餐后高血糖。ARIOGLU等[14]分析的24例TBIRS患者使用胰岛素平均剂量为5 100 U·d-1。一些患者也出现高血糖向低血糖的转变,而另一些患者仅表现为严重的空腹低血糖。大多数胰岛素抵抗患者不肥胖,空腹甘油三酯水平通常较低[14]。本例患者身高180 cm,体质量75 kg,甘油三酯降低,与文献报道相符。TBIRS可通过检测IRAbs诊断,但因检测技术的局限性,目前还未广泛应用。在临床实践中,与高基础胰岛素水平相关的极度胰岛素抵抗或需要高剂量胰岛素调节血糖水平患者,低甘油三酯或高脂联素水平患者,以及并发其他自身免疫性疾病或血液病的患者,都应该怀疑TBIRS[10]。本例患者初诊SLE,以单纯空腹低血糖为主要表现,IAA阴性,低血糖时胰岛素升高而C肽降低,甘油三酯水平低,虽未行IRAbs检测,但根据以上资料,临床可诊断为TBIRS。
目前TBIRS所致低血糖的发病机制尚不明确。DONS等[15]认为:低血糖可能与IRAbs滴度有关,抗体滴度高时拮抗作用(胰岛素抵抗)占优势,抗体滴度低时激动作用(胰岛素模仿作用)占优势。目前公认的TBIRS治疗[16]:一是控制血糖,二是免疫抑制或免疫调节治疗。免疫调节治疗主要包括类固醇激素、环磷酰胺、霉酚酸酯、环孢素A、硫唑嘌呤、血浆置换、免疫球蛋白和利妥昔单抗等。研究[17]显示:利妥昔单抗、环磷酰胺和大剂量类固醇激素冲击治疗后用硫唑嘌呤维持是一种高效且相对安全的TBIRS治疗方案,可使其从美国国立卫生研究院(NIH)报道高达54%的死亡率[12]转归为可治愈的糖尿病。本例老年患者同时有全血细胞减少,经多学科会诊首选糖皮质激素治疗。
综上所述,对于以全血细胞减少为首发表现的SLE患者,需及早完善骨髓穿刺常规检查以及骨髓活检,应结合病例特点进行全面分析和综合判断,以免误诊。对于诊断为AIH的患者,应积极寻求并存的自身免疫性疾病或血液系统疾病。SLE并发低血糖时应考虑自身抗体介导的葡萄糖稳态改变。
