3种体外培养方法诱导骨髓间充质干细胞向心肌细胞分化效果比较
2020-02-13金莲花韩立志
周 岩, 金莲花,卢 娜,韩立志
(吉林大学第一医院小儿心血管科,吉林 长春 130021)
扩张型心肌病(dilated cardiomyopathy,DCM)是一种临床常见的心肌病,该病预后差,5~10年生存率较低(30%~40%)[1-2],目前尚无特效的治疗药物及治疗方法[3]。骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)作为一类研究较早、较深入的成体干细胞,具有多种分化潜能,现已成为以干细胞为基础的治疗策略中不可或缺的重要种子细胞,对维持组织稳态和再生能力必不可少[4-5]。研究[6-8]表明:BMSCs可以分化为心肌细胞和血管内皮细胞,是目前心血管疾病细胞移植治疗的理想种子细胞,已经成为国内外研究的热点。但BMSCs向心肌细胞的分化率较低,其分化机制及诱导分化条件等问题均有待解决。本研究旨在探讨在体外不同诱导条件下BMSCs分化为心肌细胞的作用,模拟DCM体内微环境诱导分化BMSCs,寻找BMSCs诱导分化为心肌细胞的最佳方法,为采用BMSCs移植治疗DCM奠定基础。
1 材料与方法
1.1 实验动物、主要试剂和仪器 Wistar大鼠乳鼠15只,出生5 d,购自吉林大学白求恩医学院动物中心,动物许可证号:SCXK(吉)2013-0001。DCM大鼠为本课题组在前期工作中用阿霉素诱导制备。FITC 标记的CD44和CD105抗体、 PE标记的CD29和CD34抗体购自美国DAKO公司, 胎牛血清(FBS)和L-DMEM培养基购自美国Hyclone 公司,Trizol试剂盒购自美Invitrogen 公司,RIPA细胞裂解液、BCA蛋白浓度测定试剂盒和细胞浆蛋白抽提试剂盒购自上海碧云天生物技术公司。VE-180型垂直电泳槽、VE-186转移电泳仪和Tanon 1600型凝胶成像系统均购自上海天能科技有限公司, FACSCalibur 流式细胞仪购自美国BD 公司。
1.2 BMSCs的分离培养及鉴定 颈椎脱臼法处死出生5 d大鼠(体质量为8~10 g),75%酒精浸泡5 min,无菌条件下分离股骨胫骨,剪去骨两端,收集细胞制成细胞悬液,置于37℃、5%CO2培养箱培养。选取生长状态良好的第3代BMSCs,流式细胞仪检测细胞表面标志物CD34、CD44、CD29和CD105表达。同时采用成脂和成骨诱导剂诱导分化,观察细胞形态表现,在成骨诱导培养后行碱性磷酸酶染色鉴定。成脂诱导培养后油红O染色鉴定。
1.3 3种体外诱导方法培养大鼠BMSCs ①5-氮胞苷(5-aza)组: 3代BMSCs接种于6孔板内(孔内预置无菌盖玻片),24 h后换用含10 μmol·L-15-aza、10%FBS的L-DMEM培养基培养,培养24 h后弃去培养液更换为正常培养基继续培养。②DCM模型大鼠心肌细胞裂解液组:处死DCM模型大鼠,迅速取出心脏,预冷生理盐水冲洗后,置于冰上,按150 mg组织加入1 mL L-DMEM培养基比例加入L-DMEM培养基,制备心肌细胞裂解液。采用DCM大鼠心肌细胞裂解液诱导培养大鼠BMSCs,诱导培养基为含10%心肌细胞裂解液和10%FBS的L-DMEM培养基。③DCM模型大鼠血清+5-aza组:腹主动脉采集DCM模型大鼠全血,分离血清,采用DCM大鼠血清+5-aza诱导培养BMSCs,诱导培养方法为5 μmol·L-15-aza干预培养24 h后去培养液,改用含20%DCM大鼠血清的L-DMEM培养基继续培养。对照组BMSCs始终采用含10%FBS 的L-DMEM培养基在同等条件下培养,每3~4 d换液1次。
1.4 RT-PCR法检测BMSCs中cTnT mRNA表达 采用Trizol试剂盒提取细胞总RNA,检测总RNA纯度,A(260)/A(280)为1.9~2.1,说明RNA纯度比较好,一步法RT-PCR试剂盒将RNA逆转录成cDNA, PCR扩增cDNA,取20 μL PCR产物于3%琼脂糖凝胶电泳检测扩增产物。β-actin引物:147 bp,P1 5′-GTCAGGTCATCACTATCGGCAAT-3′,P2 5′-AGAGGTCTTTACGGATGTCAACGT-3′;cTnT引物: 202 bp,P1 5′-GCAGGCTCTTCATGCCCAACT-3′,P2 5′-CGC-
TCTGCCCGACGCTTTT-3′。
1.5 Western blotting法检测BMSCs中 cTnT蛋白表达 冰浴下刮取细胞并裂解,4℃离心获得的上清液即是总蛋白,BCA法测定蛋白浓度。制作蛋白电泳浓缩胶及分离胶,取30 μg蛋白上样,进行十二烷基苯磺酸钠凝胶电泳2 h,半干式转膜,5%脱脂奶粉封闭1 h,一抗溶液(兔抗大鼠cTnT单抗,稀释度为1∶100) 4℃过夜孵育,辣根过氧化物酶标记二抗溶液室温孵育1 h,DAB显色,凝胶成像系统摄片,观察cTnT蛋白表达情况。
1.6 免疫组织化学法检测BMSCs中cTnT阳性表达率 取出细胞爬片 PBS冲洗2 min×3次,4%多聚甲醛固定30 min,3%过氧化氢甲醇液浸泡30 min,封闭内源性过氧化物酶,1%Triton X-100破膜,PBS冲洗后,按照免疫组织化学试剂盒说明书操作。结果判定:细胞胞浆内出现棕褐色颗粒为阳性,每组观察计数5个低倍视野,计算cTnT阳性表达率。
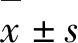
2 结 果
2.1 大鼠BMSCs的分离培养及鉴定 分离获得的细胞培养48 h后换液,镜下可见部分呈梭形生长的贴壁细胞,少数细胞为多角形;培养7~10 d单层生长细胞达80%~90%融合,呈旋涡状排列(图 1)。第3代BMSCs高表达MSCs的特征性表面标记CD44、CD29和CD105,不表达造血干细胞的特征性表面标志CD34(图 2)。BMSCs成骨诱导培养基培养下分化为成骨细胞,碱性磷酸酶染色阳性,胞浆内有灰黑色沉淀;在成脂肪诱导培养基培养下分化为脂肪细胞,油红O染色阳性,胞浆内有橘红色脂肪滴(图3,见插页五)。

A:BMSCs (4 d); B:BMSCs (10 d);C: Subculture for 24 h(passage 3); D: Subculture for 7 d (passage 3).图1 BMSCs的形态表现 (×40)Fig.1 Morphology of BMSCs(×40)

A:FITC-control;B:CD44;C:CD105;D:PE-control;E:CD29;F:CD34.图2 流式细胞术检测BMSCs表面抗原的表达Fig.2 Expressions of surface antigens of BMSCs detected by flow cytometry
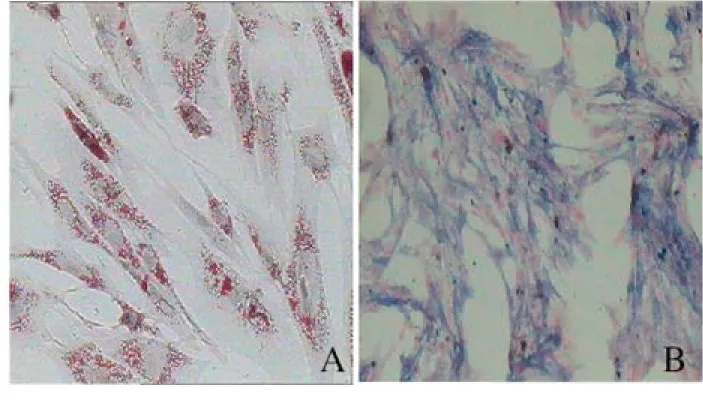
A:Oil red O staining; B: Alkaline phosphates staining.
图3 BMSCs的脂肪和成骨分化 (×100)
Fig.3 Adipogenic and osteogenic differentiation of BMSCs(×100)
2.2 3种体外培养方法诱导培养的大鼠BMSCs形态表现 对照组BMSCs呈成纤维细胞样整齐排列,未发生形态改变(图4)。5-aza组BMSCs诱导培养7 d,细胞增大明显,逐渐变为短柱状,排列方向一致,细胞增殖减慢,部分细胞脱壁死亡;随着培养时间的延长,贴壁细胞数量较同期对照组明显减少,形态多样,胞浆粗糙,2周后出现肌丝样结构(图5);DCM模型大鼠心肌细胞裂解液组BMSCs生长状态较5-aza组好,诱导培养7 d,细胞变宽,呈柱状,排列具有方向性,2周后出现肌丝样结构(图 6)。DCM模型大鼠血清+5-aza组BMSCs生长状态明显优于前2组,7 d后细胞形态发生明显变化,多紧密平行排列生长,体积变大;随着培养时间的延长梭形细胞的比例下降,多呈杆状,少数细胞呈不规则外形,相邻细胞间的胞膜有接触,逐渐相连呈肌管状(图7)。

A: Culture 7 d; B: Culture 14 d; C: Culture 21 d; D: Culture 28 d.图4 对照组大鼠BMSCs形态表现 (×100)Fig.4 Morphology of rat BMSCs in control group(×100)

A: Culture 7 d; B: Culture 14 d; C: Culture 21 d; D: Culture 28 d.图5 5-aza组大鼠BMSCs形态表现 (×100)Fig.5 Morphology of rat BMSCs in 5-aza group(×100)

A:Culture 7 d; B: Culture 14 d; C: Culture 21 d; D: Culture 28 d.图6 DCM模型大鼠心肌细胞裂解液组BMSCs形态表现 (×100)Fig.6 Morphology of rat BMSCs in DCM model rat myocardial cell cleavage group(×100)

A: Culture 7 d; B: Culture 14 d; C: Culture 21 d; D: Culture 28 d.图7 DCM模型大鼠血清+5-aza组BMSCs形态表现(×100)Fig.7 Morphology of rat BMSCs in DCM model rat serum +5-aza group(×100)
2.3 各组大鼠BMSCs 中cTnT mRNA和蛋白表达 5-aza组、DCM模型大鼠心肌细胞裂解液组和DCM模型大鼠血清+5-aza组BMSCs诱导培养28 d后,均可见cTnT mRNA和蛋白表达,对照组BMSCs中未见cTnT mRNA和蛋白表达(图 8)。免疫组织化学染色结果显示:5-aza组、DCM模型大鼠心肌细胞裂解液组和DCM模型大鼠血清+5-aza组BMSCs体外诱导培养7、14、21和28 d时cTnT均呈阳性表达,随时间延长,cTnT阳性表达率明显增高,DCM模型大鼠血清+5-aza组BMSCs中cTnT阳性表达率最高; 21和28 d时,与5-aza组和DCM模型大鼠心肌细胞裂解液组比较,DCM模型大鼠血清+5-aza组 BMSCs中cTnT阳性表达率明显升高(P=0.048,P=0.036;P=0.026,P=0.020)。对照组BMSCs中未见cTnT表达。见图9(插页五)和表1。

Lane 1: Control group; Lane 2: 5-aza group; Lane 3: DCM model rat myocardial cell cleavage group;Lane 4: DCM model rat serum +5-aza group.
图8 各组BMSCs中cTnT mRNA(A)和蛋白表达(B)电泳图
Fig.8 Expressions of cTnT mRNA(A) and protein (B) in BMSCs in various groups
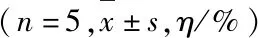
表1 各组大鼠BMSCs中cTnT阳性表达率Tab.1 Positive expression rates of cTnT in BMSCs in various groups
*P<0.05 compared with 5-aza group;△P<0.05 compared with DCM model rat myocardial cell cleavage group.
3 讨 论
BMSCs来源广泛,具有低免疫原性、可以分化为多种组织细胞且分离培养较为容易,在组织器官损伤性疾病、组织器官退行性疾病和遗传缺陷疾病等领域具有广泛的应用前景。研究[9]表明:BMSCs可以分化为心肌细胞和血管内皮细胞,已经成为心血管疾病细胞移植治疗的理想种子细胞,是近年来心血管疾病领域的研究热点。
5-aza是胞嘧啶核苷的一个类似物,是一种去甲基化药物,可引起DNA中某些胞嘧啶的低甲基化,从而使控制向心肌分化的特定调控基因阻遏蛋白去甲基化而发生构型改变,促进BMSCs向心肌细胞分化。1995年WAKITANI等[10]首先证实间充质干细胞(marrow mesenchymal stem cells, MSCs)在体外经5-aza诱导后分化成心肌样细胞,分化率约为30%。有文献[11-14]报道:5-aza能诱导BMSCs分化为心肌表型,10 μmol·L-1为5-aza诱导BMSCs的最佳剂量,但是随着诱导时间的延长,其对细胞的毒性也会越来越大,可以引起干细胞的凋亡。干细胞进入体内不同器官能在不同的环境及生长因子作用下发生定向分化,其中微环境是诱导干细胞分化的关键因素。在体外模拟心肌微环境,可高效诱导BMSCs分化为心肌细胞。如通过体外心肌细胞与MSCs共同培养、添加心肌细胞裂解液和添加心肌细胞条件培养液等体外模拟心肌微环境的方法均可诱导BMSCs分化为心肌细胞[15-16]。本研究中,大鼠BMSCs分为3组,5-aza组采用10 μmol· L-15-aza进行诱导,DCM模型大鼠心肌细胞裂解液组采用DCM大鼠心肌细胞裂解液进行诱导,DCM模型大鼠血清+5-aza组采取减少5-aza用量(5 μmol·L-1)并结合DCM大鼠血清进行诱导,观察采用不同诱导方法培养后BMSCs向心肌细胞分化的效果。本研究结果显示:DCM模型大鼠血清+5-aza组BMSCs生长状态明显优于5-aza组和DCM模型大鼠心肌细胞裂解液组,7 d后细胞形态出现变化,多紧密平行排列生长,体积变大,随着培养时间的延长梭形细胞的比例下降,多呈杆状,少数细胞呈不规则外形,相邻细胞间的胞膜有接触,排列具有方向性,逐渐相连呈肌管状。cTnT是心肌肌钙蛋白中具有较高特异性的亚型,是鉴定心肌源性细胞的特异性标志物[17-20]。本研究中RT-PCR法和Western blotting法检测结果显示:3组BMSCs体外诱导培养后均可见cTnT mRNA和蛋白表达;免疫组织化学染色结果显示:随时间延长,cTnT阳性表达率逐渐升高,DCM模型大鼠血清+5-aza组cTnT表达阳性率最高。研究[21-23]表明:心肌微环境中的各种因素为MSCs向心肌细胞定向分化提供了关键的信号,即“环境诱导分化”,包括化学性因素和物理性因素。化学因素包括细胞因子、激素、离子梯度和其他可溶性因子;物理性因素可能包括细胞间的直接/间接接触,刚性细胞外基质,流体剪切应力和机械张力等[24]。本研究在体外采用DCM模型大鼠心肌细胞裂解液和DCM模型大鼠血清+5-aza培养BMSCs均显示出较好的向心肌细胞分化的结果,均比单纯应用5-aza诱导效果好,其机制考虑与心肌损伤后产生的细胞因子、激素和可溶性因子等有关。本研究采用10 μmol·L-15-aza 对BMSCs进行诱导,可以使其向心肌细胞分化,但在培养过程中呈现细胞生长状态差,出现较多的细胞脱壁死亡,考虑与5-aza的细胞毒性有关;但DCM模型大鼠心肌细胞裂解液和DCM模型大鼠血清+5-aza(5 μmol·L-1)诱导组细胞生长状态良好,出现细胞脱壁死亡的数量较少,考虑DCM模型大鼠心肌细胞裂解液及血清均可诱导BMSCs向心肌细胞分化。本研究中DCM模型大鼠血清+5-aza(5 μmol·L-1)组细胞生长状态及向心肌细胞分化的结果最佳。推测其原因可能为:一方面DCM大鼠模型血清可能含有相关细胞因子等诱导BMSCs向心肌细胞分化;另一方面与减少5-aza的剂量,降低了5-aza的细胞毒性有关。

A: Control group;B: 5-aza group;C: DCM rat model myocardial cell cleavage group;D: DCM rat serum +5-aza group.
图9 各组大鼠BMSCs中cTnT的表达情况(免疫组织化学,×100)
Fig.9 Expressions of cTnT in BMSCs of rats in various groups (Immunohistochemistry,×100)
综上所述,本研究采用5-aza、DCM模型大鼠的心肌细胞裂解液、DCM模型大鼠血清+5-aza 3种方法体外诱导大鼠BMSCs向心肌细胞分化,DCM模型大鼠血清+5-aza组细胞生长状态最佳,心肌源性细胞的特异性标志物cTnT表达最高,向心肌细胞分化的结果最佳。本研究结果为BMSCs移植治疗DCM奠定了基础。
