苦草粉对草鱼幼鱼生长性能与生理生化性能的影响*
2020-02-13黄仲园何文辉彭自然刘玉超华雪铭悦李向左琳1
黄仲园何文辉 彭自然 刘玉超华雪铭 冯 悦李 向左 琳1,
苦草粉对草鱼幼鱼生长性能与生理生化性能的影响*
黄仲园1,2,3何文辉4彭自然4刘玉超5华雪铭2,3①冯 悦1,2,3李 向1,2,3左 琳1,2,3
(1. 上海海洋大学 农业农村部鱼类营养与环境生态研究中心 上海 201306;2. 上海海洋大学 农业农村部淡水水产种质资源重点实验室 上海 201306;3. 上海海洋大学 水产科学国家级实验教学示范中心 上海 201306;4. 上海海洋大学海洋生态与环境学院 上海 201306;5. 上海太和水环境科技有限公司 上海 200433)
本研究评价了苦草()粉在草鱼()饲料中的应用效果。以不含苦草粉的基础饲料(VN0组)为对照,分别用10%(VN1组)、20%(VN2组)和30%(VN3组)的苦草粉替代基础组饲料中的次粉和米糠,配制出4种实验饲料,另设置1组只投喂新鲜苦草的青饲料组(VN组)。选用初始体重为(18.85±0.20) g的草鱼幼鱼在室内水泥池网箱进行为期56 d的养殖实验。结果显示,添加苦草粉不影响草鱼的生长性能、存活率和饲料系数。随着苦草粉添加量的增加,内脏指数及肝胰脏指数显著降低;前肠淀粉酶活力显著增强,中、后肠淀粉酶活力显著降低;对照组前、中、后肠蛋白酶活力依次增强,随着苦草粉含量的增加,前肠蛋白酶活力显著增强,中肠蛋白酶活力表现出先增强再减弱再增强的变化,VN1组显著高于其他组,后肠蛋白酶活力呈现显著降低的趋势;肝胰脏SOD活力显著提高,MDA含量先下降后上升,VN3组最高。血清总蛋白含量有上升的趋势,VN3组显著高于其他组;血清白蛋白含量呈现先增加后降低的趋势,VN1组最高;血清ALT活力先增强后减弱;与对照组相比血清AST活力显著降低,各苦草粉组之间没有显著性差异。添加苦草粉显著降低了饲料表观消化率,但在一定程度上增强了草鱼对嗜水气单胞菌的抗感染能力。VN组出现负增长现象,内脏指数及肝胰脏指数、血清白蛋白、球蛋白及ALT都显著低于其他组;肠道各段淀粉酶活力显著高于各实用饲料组;中肠蛋白酶活力显著高于对照组,后肠蛋白酶活力显著低于对照组。研究表明,饲料中添加10%~30%苦草粉对草鱼生长没有影响,且有利于鱼体健康,可以作为草鱼饲料原料进行资源化的利用;苦草粉的使用效果明显优于新鲜苦草。
草鱼幼鱼;苦草;生长性能;肝胰脏指标;消化率;抗感染能力
苦草()隶属于水鳖科苦草属,是一种多年生无茎沉水草本植物,广泛分布于我国的河流、湖泊等水域。因为苦草适应环境的能力强,在修复水生态过程中对维护生态完整性与稳定性、净化水质、抑制藻类生长等具有重要作用,是生态修复工程上常用的一种沉水植物(Horppila, 2003; 潘慧云等, 2008)。然而,沉水植物生长迅速,形成的生物量相当可观,在其腐烂分解时会释放出大量的有机物质和营养盐,易造成水体的二次污染(李文朝等, 2001; Chimney, 2006; 杨清心, 1998)。生态工程上一般采用人工打捞的方法来适时迁出富营养化水体中的水草,迁出的这些水草的处理处置便成了当务之急。
目前对于沉水植物资源化利用的研究大多集中在高投入且工艺不成熟的固体发酵、堆肥上(王艳丽等, 2006; 杨柳燕等, 2016; 陈专专, 2013; 查国君等, 2008)。研究发现,凤眼莲草粉可用作鲶鱼()的饲料源(Liang, 1971)。由于沉水植物是野生或湖泊放流河蟹()的重要食物来源,对其生长发育起着重要作用(张蕾等, 2016),因此,轮叶黑藻()、伊乐藻()、马来眼子菜()、苦草和金鱼藻()可以开发成饲料原料被中华绒螯蟹利用(孙丽萍, 2011)。
草鱼()是我国第一大淡水养殖鱼类,肉质细嫩,深受人们喜爱。草鱼具有摄食沉水植物的习性,摄食优先选择次序为:轮叶黑藻>苦草>菹草()>金鱼藻>穗花狐尾藻()(孙健等, 2015)。研究发现,沉水植物的构造和次生代谢产物是影响其适口性的主要原因(Sun, 2017);而水温、沉水植物的粗蛋白含量以及黄酮类物质的种类和含量则影响摄食量(Sun, 2018)。苦草经干燥处理后粗蛋白含量为20%,粗脂肪含量约为5%,氨基酸种类齐全且含量丰富,氨基酸构成比例优良,有较高的营养价值 (孙丽萍, 2011)。因此,本实验以草鱼为研究对象,探讨饲料中添加苦草粉对其生长性能、组织生化指标、消化酶、饲料表观消化率和抗感染能力的影响,为苦草的资源化利用提供新的思路。
1 材料与方法
1.1 实验设计与实验饲料
取苦草叶子,经晒干后粉碎、过60目,其粗蛋白含量为16.8%,粗脂肪含量为4.5%。在基础饲料(VN0)中分别添加10%(VN1)、20%(VN2)和30%(VN3)的苦草粉,相应减少米糠和次粉的添加量,共配制出4组等氮等能的实验饲料(表1)。所有原料经粉碎后过60目筛,逐级混匀制成粒径为2 mm的沉性颗粒饲料(单螺杆挤压机SLP-45,中国水产科学研究院渔业机械仪器研究所,中国;制粒温度为90℃~95℃),避光晾干,塑料自封袋保存备用;另设置只投喂新鲜苦草的青饲料组(VN)。
表1 实验饲料配方及营养组成(%, 风干样品)
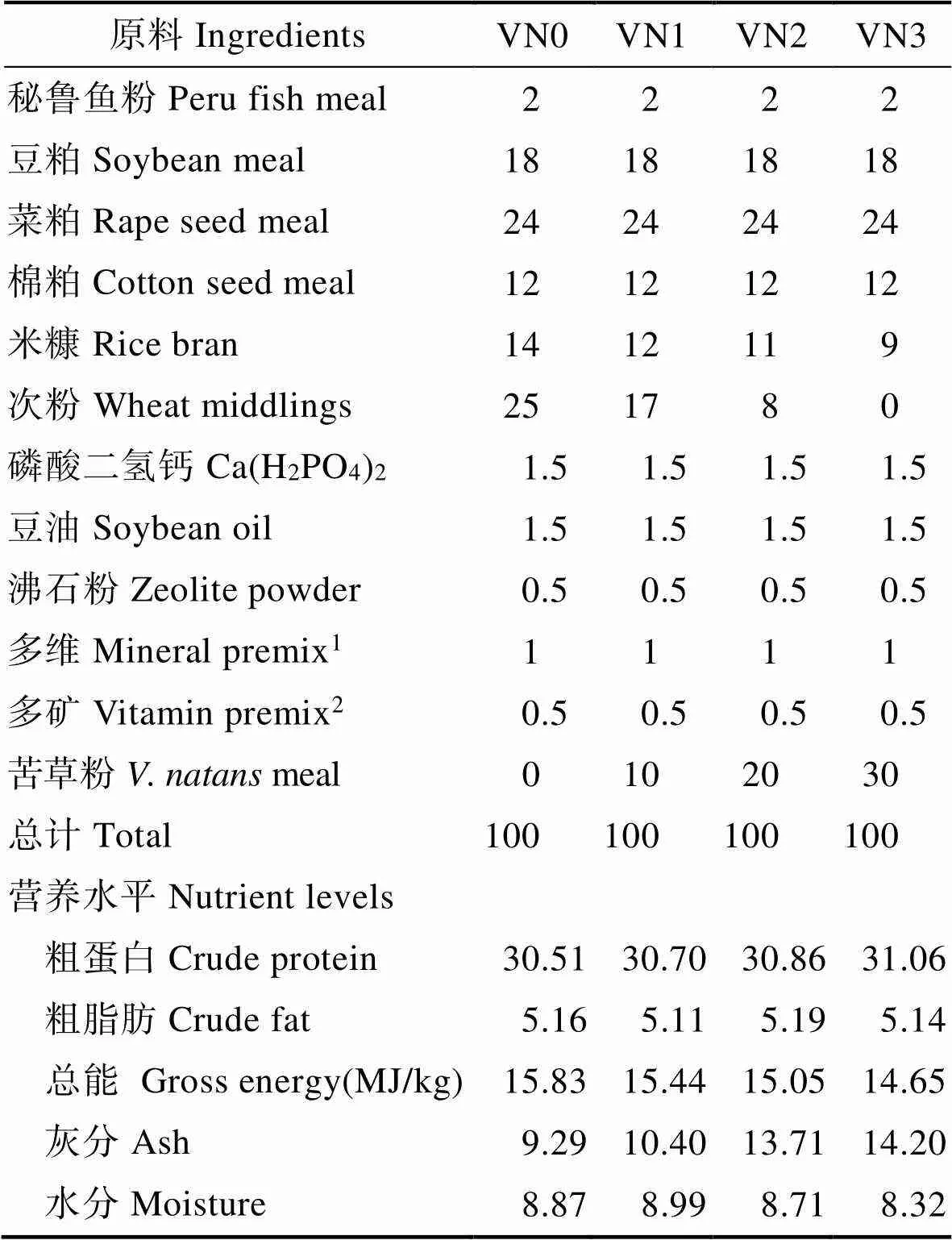
Tab.1 Composition and nutrient levels of diets (%, air dry basis)
注:1. 维生素预混料向每千克饲料提供:维生素A, 6000 IU; 维生素D3, 2000 IU; 维生素C, 200 mg; 维生素E, 50 mg; 维生素K3, 5 mg; 维生素B1, 15 mg; 维生素B2, 15 mg; 维生素B3, 30 mg; 维生素B5, 35 mg; 维生素B6, 6 mg; 维生素B12, 0.03 mg; 生物素, 0.2 mg; 叶酸, 3 mg; 肌醇, 200 mg 2. 矿物元素预混料向每千克饲料提供: 碘, 0.4 mg; 铜, 4 mg; 锌, 80 mg; 铁, 150 mg; 锰, 20 mg; 镁, 100 mg; 钴, 0.1 mg; 硒, 0.1 mg
Note: 1.The vitamin premix provided the following per kg of diets: VA, 6000 IU; VD3, 2000 IU; VC, 200 mg; VE, 50 mg; VK3, 5 mg; VB1, 15 mg; VB2, 15 mg; VB3, 30 mg; VB5, 35 mg; VB6, 6 mg; VB12, 0.03 mg; biotin, 0.2 mg; folic acid, 3 mg; inositol, 200 mg 2. The mineral premix provided the following per kg of diets: I, 0.4 mg; Cu, 4 mg; Zn, 80 mg; Fe, 150 mg; Mn, 20 mg; Mg, 100 mg; Co, 0.1 mg; Se, 0.1 mg
1.2 实验用鱼与饲养管理
实验用草鱼平均初始体重为(18.85±0.20) g,购买自浙江省湖州淡水鱼苗场。取750尾体格健壮,规格整齐的个体,随机分到25个网箱(2.0 m×1.2 m×1.2 m),每个网箱30尾,共5组,每组5个重复,网箱随机置于7个室内水泥池(5.0 m×2.0 m×1.2 m)中。养殖实验在上海海洋大学滨海基地进行,养殖周期为56 d。
在养殖期间,每天按体重的3%~5%分3次(07:30, 12:30, 17:00)限量投喂,各网箱保持基本一致的投饲量,VN组按体重的20%~30%限量投喂新鲜苦草,并依据天气、水温和鱼体增重等情况作适当调整。饲喂期间,每5 d更换1/3池水,7 d吸污1次,水体24 h不间断充气,溶解氧>5.0 mg/L,pH为7.3~7.8,水温为26℃~33℃,氨氮浓度低于0.2 mg/L。
1.3 样品采集与指标测定
养殖结束后,停食24 h,统计每个网箱草鱼数量并称总重,计算相对增重率(WGR)和饲料系数(FCR);每个网箱随机取9尾鱼,测体重和体长,计算肥满度(CF);尾静脉取血,4℃静置24 h后以3500 r/min离心10 min,取上层血清;之后将实验鱼解剖,分离肝胰脏,并称重以计算肝胰脏指数;分离前、中、后肠并剔除脂肪组织;最后,将所有样品置于-80℃保存用于后续检测分析。
1.3.1 生长性能和形体指标
存活率(Survival rate, SR, %)=实验结束时鱼尾数/实验初始时鱼尾数×100
相对增重率(Weight gain rate, WGR, %)=(终末平均体重-初始平均体重)/初始平均体重×100
饲料系数(Feed conversion ratio, FCR)=平均摄食量/(终末平均体重-初始平均体重)
肥满度(Condition factor, CF)=100×终末鱼体重/终末鱼体长3
内脏指数(Viscerosomatic index, VSI, %)=内脏重/ 鱼体总重×100
肝胰脏指数(Hepatosomatic index, HSI, %)=肝胰脏重/鱼体总重×100
1.3.2 血清样品分析 碱性磷酸酶(AKP)活性、总蛋白(TP)、白蛋白(ALB)、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)活性均采用南京建成生物的试剂盒检测,具体操作按照说明书进行。
1.3.3 肝胰脏样品分析 肝胰脏匀浆液制备∶取部分新鲜肝胰脏称重,按照质量体积比1∶9加入生理盐水,1000 r/min匀浆3 min,3500 r/min冷冻离心 10 min,取上清液分装,4℃保存,24 h内测定完成。
肝胰脏超氧化物歧化酶活力(SOD)、丙二醛(MDA)含量采用南京建成试剂盒测定。
1.3.4 消化酶活力的分析测定 肠道组织匀浆液的制备同肝胰脏组织匀浆液制备。
蛋白酶活力的测定参照Folin酚法进行;淀粉酶活力采用南京建成生物的试剂盒检测。
1.3.5 表观消化率的测定 在养殖实验的中后期VN0、VN1、VN2和VN3组开始投喂含有Cr2O3的饲料,适应7 d后开始在每次投喂2 h后收集新鲜、外表带有包膜的完整粪便;VN组无法采用相同的方法测定表观消化率,故不提供相应的结果。
表观消化吸收率(%)=(1-F/S)×100
F为饲料中Cr2O3含量;S为粪便中Cr2O3含量。
1.4 攻毒实验
嗜水气单胞菌活化后,经预实验确定攻毒浓度为5×108CFU/ml,注射剂量为0.2 ml。待养殖实验中各组样本采集完成后,随机将各实用饲料组剩余草鱼分成4重复,每重复20尾鱼,用预实验确定的嗜水气单胞菌攻毒浓度和剂量对各实用饲料组草鱼进行急性攻毒,攻毒4 d后,草鱼死亡趋于稳定。详细记录内各组草鱼累计死亡数,并计算累计死亡率(Accumulative death rate)和相对免疫保护率(Relative percent survival rate, RPS)。
RPS(%)=(1-免疫组死亡率/对照组死亡数率)×100
1.5 数据处理与分析
实验结果用平均值±标准差(Mean±SD)表示,采用SPSS 17.0对数据进行单因素方差分析(One-way ANOVA),影响显著时用Duncan氏法进行多重比较,<0.05表示差异显著。
2 结果
2.1 饲料中苦草粉含量对草鱼生长性能与形体指标的影响
饲料中添加苦草粉对草鱼生长性能和形体指标的影响见表2。研究表明,除VN组外,其他各组在WGR、FCR和SR上都无显著性差异(>0.05);VN0、VN1和VN2三组鱼体CF没有显著性差异(>0.05),都显著高于VN3组(<0.05);随饲料中苦草粉含量的增加VSI和HSI显著降低,VN0组的VSI和HSI显著高于其他各组(<0.05),VN3组最小。VN组草鱼出现反常的负增长现象,其VSI和HSI都显著低于其他各组(<0.05)。
2.2 饲料中苦草粉含量对草鱼消化酶活力和表观消化率的影响
由表3可见,淀粉酶活力后肠最高,前肠最低;与VN0组相比,苦草粉组前肠淀粉酶活力显著增强(<0.05),中、后肠淀粉酶活力则显著降低(中肠VN1除外,<0.05),VN组前、中、后肠淀粉酶活力均显著高于其他组(<0.05)。
对照组前、中、后肠蛋白酶活力依次增强,随着苦草粉含量的增加,前肠蛋白酶活力显著增强(< 0.05);中肠蛋白酶活力表现出先增再降再增的变化,VN1组显著高于其他组(<0.05);后肠蛋白酶活力呈现显著降低的趋势(<0.05);VN组中肠蛋白酶活力显著高于对照组(<0.05),后肠蛋白酶活力显著低于对照组(<0.05)。
表2 苦草粉对草鱼生长性能和形体指标的影响指标

Tab.2 Effects of V. natans meal on growth performance and physical indicators of grass carp
注:同行数据肩标相同表示差异不显著(>0.05),不同小写字母表示差异显著(<0.05)。下同
Notes: In the same row, values with the same small letter superscripts mean no significant difference (>0.05), while with different small letter superscripts mean significant difference (<0.05). The same as following
表3 苦草干粉对草鱼肠道消化酶活力的影响(U/mg prot)
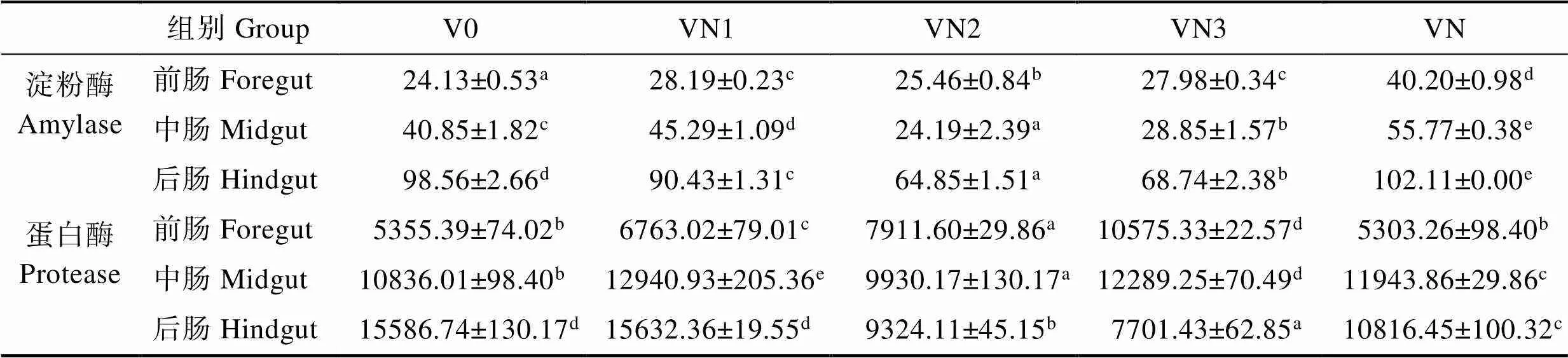
Tab.3 Effects of V. natans meal on intestinal digestive enzymes of grass carp (U/mg prot)
由图1可知,随着饲料中苦草粉含量的增加,饲料表观消化率显著降低(<0.05),当添加量达到20%以后逐渐趋于稳定。
2.3 饲料中苦草粉含量对草鱼生化指标的影响
由表4可知,随着苦草粉用量的增加,肝胰脏SOD活力显著提高(<0.05);MDA含量显著降低而后又升高(<0.05)。
随着饲料中苦草粉含量的上升血清总蛋白含量有上升的趋势,VN3组显著高于其他组(<0.05);血清白蛋白含量先增后降,各添加组都显著高于对照组(<0.05),VN1组最高;血清球蛋白含量先降后增,VN2组最低;血清AKP活力显著下降(<0.05);血清ALT活力先增后降,VN2组显著高于其他各组(<0.05);与对照组相比,添加苦草后血清AST活力显著降低(<0.05),VN1、VN2和VN3组之间没有显著性差异(>0.05)。
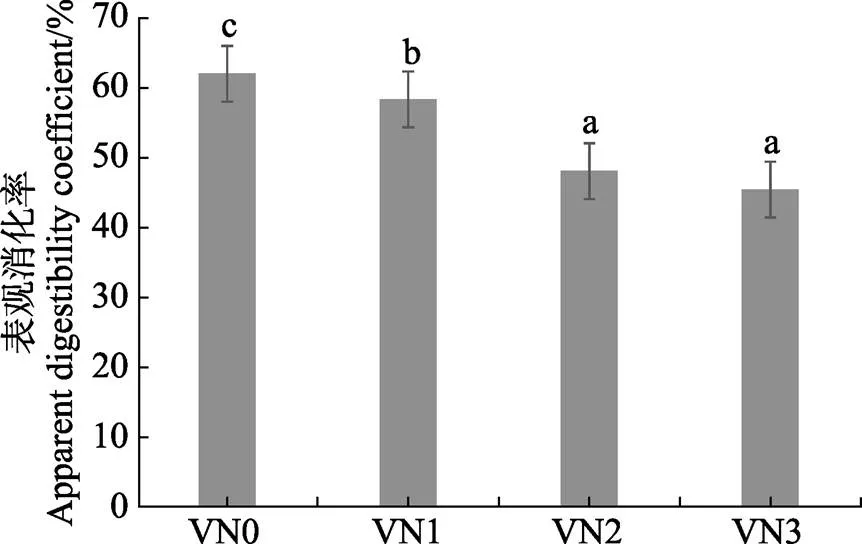
图1 苦草粉对饲料表观消化率的影响
图中相同小写字母表示差异不显著(>0.05),不同小写字母表示差异显著(<0.05)
Columns with the same small letter superscripts mean no significant difference (>0.05), while with different small letter superscripts mean significant difference (<0.05)
VN组的肝胰脏SOD显著低于其他各组(< 0.05),肝胰脏MDA含量、血清球蛋白和总蛋白含量显著高于其他各组(<0.05),而血清白蛋白含量与血清ALT显著低于其他各组(<0.05);血清AKP及AST普遍低于VN0、VN1与VN2组。
表4 苦草粉对草鱼血清、肝胰脏指标的影响
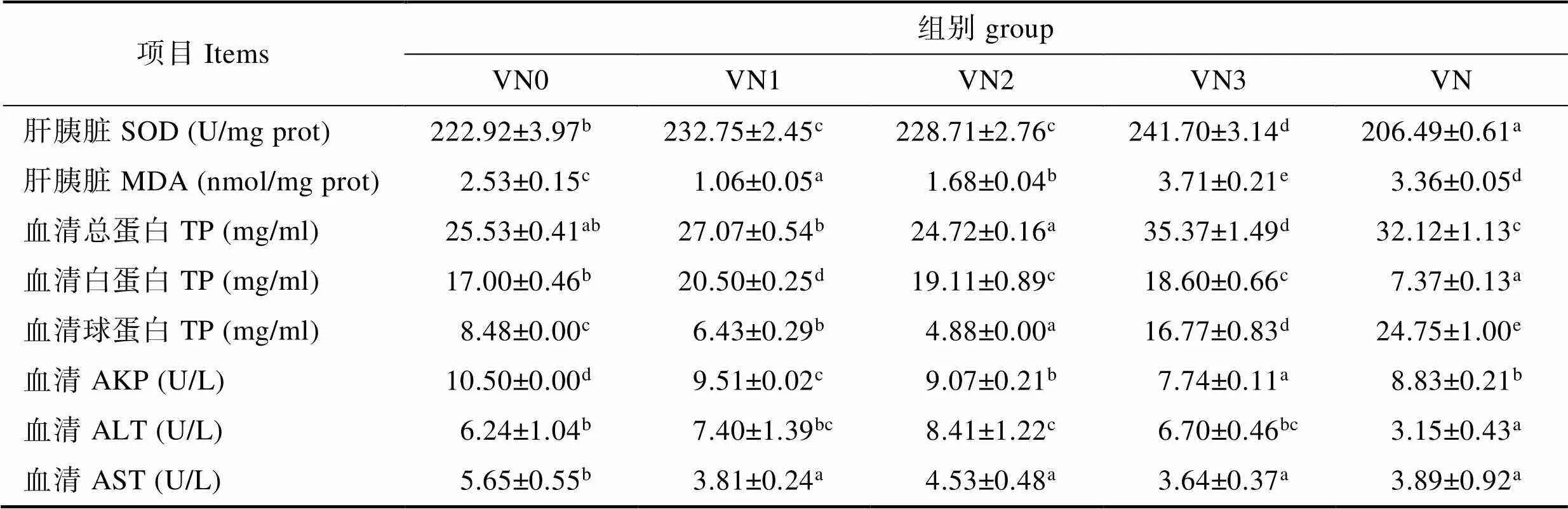
Tab.4 Effects of V. natans meal on biochemical indicators in serum and hepatopancreas of grass carp
2.4 饲料中苦草粉含量对草鱼抗感染能力的影响
草鱼受到嗜水气单胞菌感染后,相继出现死亡,24~48 h死亡最为严重,死鱼表现出肛门红肿溃烂、腹腔肿胀有积液、眼球红肿、肝胰脏发黑等症状,第72 h之后不再死亡。表5显示,各组累计死亡率没有显著性差异,VN2组的免疫保护率显著高于其他各组(<0.05)。
表5 苦草对草鱼死亡率和免疫保护率的影响
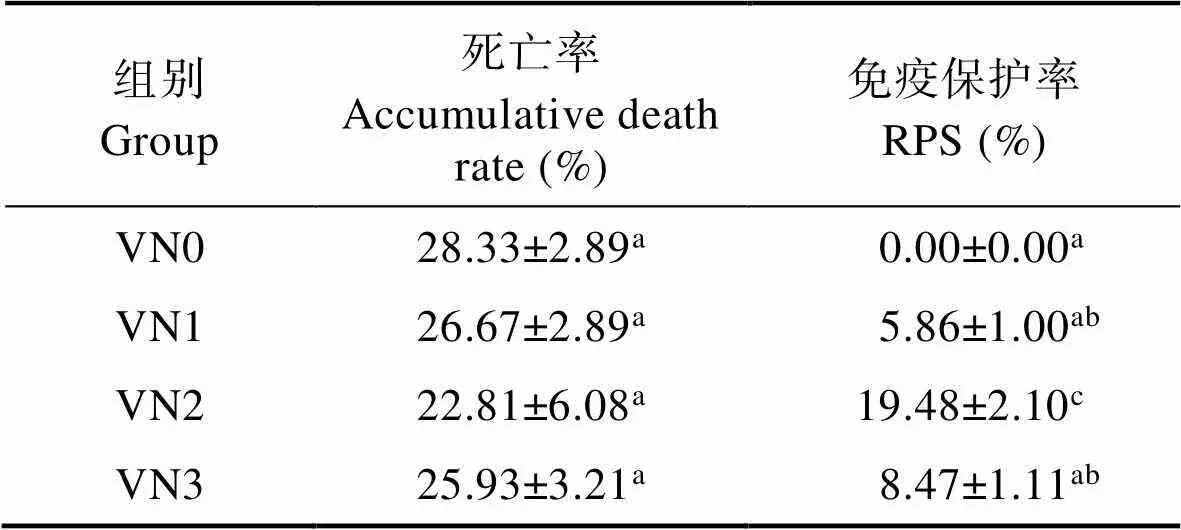
Tab.5 Effects of V. natans meal on accumulative death and relative percent survival of grass carp
注:同列数据肩标相同表示差异不显著(>0.05),不同小写字母表示差异显著(<0.05)
Notes: In the same column, values with the same small letter superscripts mean no significant difference (>0.05), while with different small letter superscripts mean significant difference (<0.05)
3 讨论
3.1 苦草粉作为饲料原料对草鱼生长性能的影响
目前,关于沉水植物对动物生长影响的报道主要见于中华绒螯蟹(孙丽萍等, 2012)、尼罗罗非鱼()(El-Sayed, 2003)、鲶鱼(Liang, 1971)等。在中华绒螯蟹饲料中按15%的量分别添加5种不同的沉水植物,平均WGR从高到低依次为轮叶黑藻组>伊乐藻组>对照组>苦草组>金鱼藻组>马来眼子菜组(孙丽萍等, 2012);10%凤眼莲茎叶草粉替代饲料中的麦麸,对尼罗罗非鱼的体组成没有显著的影响,但是显著降低了生长性能,替代量增加至20%时,罗非鱼的生长性能进一步受到抑制(El-Sayed, 2003);然而在饲料中添加5%~10%的凤眼莲草粉可显著提高鲶鱼的生长速度和存活率,添加到20%也不影响饲料的适口性(Liang, 1971)。本研究中,随着苦草粉含量的上升,草鱼WGR有增长的趋势,但差异并不显著,与上述报道存在差异,同时,本研究还观察到,添加苦草粉的饲料组草鱼抢食迅速,食欲旺盛,可见添加苦草粉对草鱼可以起到一定的诱食作用。各种沉水植物所含营养物质不同 (孙丽萍, 2011; Sun2018),且中华绒螯蟹、罗非鱼和鲶鱼均属于杂食性水产动物,而草鱼是典型的草食性鱼类,营养物质和食性不同均可能引起饲料的适口性差异。
本研究中随着苦草粉含量的增加,草鱼HSI和VSI显著降低(<0.05),这可能是由于实验中米糠和次粉被草粉所替代,饲料的糖源总量减少,而饲料中糖源对鱼的HSI有显著影响(Cui, 2010; Hutchins, 1998; 吴小易等, 2007)。本研究中,在没有其他饵料来源、只投饲新鲜苦草的情况下,草鱼WGR为负值,这是因为沉水植物的含水量很高,一般超过90%,苦草的水分含量更高达95%,干物质只有5%,即便苦草干物质蛋白含量可以达到20%,干物质粗脂肪含量可以达到5%(尚士友等, 1997),也远远不能满足草鱼的生长需求。
3.2 苦草粉作为饲料原料对草鱼肠道部分消化酶及饲料表观消化吸收率的影响
草鱼无胃,肠道是食物容纳、运输、消化吸收的主要场所,肠壁表皮能够吸收营养物质,通过血液和淋巴循环运输到全身(隗黎丽, 2009)。鱼类肠道消化酶活性与其食性和饲料营养成分密切相关,也反映了其对不同营养物质的利用能力(徐介民, 2008; 李弋等, 2015)。研究发现,草鱼肠道蛋白酶活力高于肝胰脏,且后肠活力最强,鱼类淀粉主要在肠道被消化和吸收(黄耀桐等, 1988)。本研究结果中,在对照组,无论是蛋白酶还是淀粉酶,都是前肠活力最弱,后肠活力最强,与上述研究结果一致。
已有研究表明,草食性鱼类的淀粉酶活力要高于肉食性鱼类(Zanotto, 1997; Fu, 2015),淀粉酶活性主要由遗传因素决定,饲料中的糖水平对其活性没有显著影响(Ugolev, 1983),也有研究表明,饲料中添加淀粉可以提高淀粉酶的活力(李弋等, 2015),饲料中过高的糖含量可以抑制鲈鱼蛋白酶的活力(Moyano, 1996)。本研究中,苦草粉替代饲料中的次粉和米糠,饲料中淀粉种类及含量都发生变化,而糖水平的下降可能是导致淀粉酶活力下降的主要原因(胡毅等, 2018; 蒋阳阳等, 2016)。关于沉水植物对鱼类消化酶活力影响的报道甚少,有报道称大型沉水植物所含有的黄酮类物质可以限制草鱼对植物当中蛋白的吸收,同时抑制消化酶的活力(Sun2018), 这可能是导致本研究后肠蛋白酶活力变化的一个重要原因。
由草鱼对饲料干物质和沉水植物表观消化率的结果可知(罗莉等, 2001;陈少莲等, 1993),草鱼对苦草、次粉和米糠的表观消化率依次为:苦草(63.05%)>次粉(61.64%)>米糠(47.41%)。本研究中,苦草粉主要替代原料中的次粉和米糠,随着苦草粉用量的增加,饲料干物质表观消化率显著降低,可能与消化酶的活力有关,但这与上述结果存在一定差异,具体原因有待进一步研究。
3.3 苦草粉作为饲料原料对草鱼组织生化指标的影响
SOD是氧自由基的自然天敌,广泛分布于细胞内和各种体液间,能阻止并消除自由基的连锁反应,以保护机体免受损害,SOD活力水平与机体免疫水平有密切关联(张笑天等, 2014)。检测SOD活力能够比较准确地反映机体内自由基的代谢及组织的氧化损伤情况,对判断机体的健康状况以及免疫防御能力具有重要价值。当机体处于氧化损伤时,会产生丙二醛、4-羟基壬烯醛(4-Hydroxynonenal)等脂质过氧化产物(Melin, 2000; Michiels, 1994),抑制蛋白质的合成和酶活性(Szymonik-Lesiuk, 2003)。本研究中,苦草粉添加量不超过30%时,草鱼肝胰脏SOD活性增强,MDA含量显著降低,表明肝胰脏细胞受到损伤的可能性减小,这与孙丽萍等(2012)的研究结果一致。其原因可能是和苦草中含有阿魏酸、乌头酸等抗菌、抗肝毒、抗雌激素及抗有丝分裂等功效的化合物有关,阿魏酸还能抗氧化和清除自由基,保护内膜不受损伤(孙文基等, 1998; 鲜启鸣等, 2004)。鱼体摄食过多的糖类物质,势必会造成肝脏损伤和免疫力下降(许霄霄, 2017; 蒋利和等, 2013),本研究中,随着苦草粉用量的增加,饲料总糖水平下降,这也可能是肝胰脏损伤程度降低的另一原因。
血清中酶活力的改变通常意味着机体组织的病理损伤,当肝通透性改变或者肝细胞破裂时,谷丙转氨酶(ALT)、谷草转氨酶(AST)及碱性磷酸酶(ALP)会溢出细胞进入血液循环,导致血液中三者的活力上升。本研究中,草鱼摄食不同含量的苦草粉饲料后,血清ALT活力稍有升高,而血清AST与ALP活力显著降低,进一步说明苦草能降低草鱼肝胰脏损伤。
血清总蛋白(TP)是由白蛋白(ALB)与球蛋白(GLB)组成,其浓度是鱼体健康状况的基本指标(Misra, 2006),较高的血清白蛋白标志着较快的生长速度,较高的球蛋白含量对应着较强的免疫力(Li, 2012)。在本研究中,饲料中添加苦草粉血清总蛋白含量显著提高,各苦草粉组草鱼血清ALB含量均显著高于对照组,这说明在生长上添加苦草粉要优于对照组,各组生长性能结果得到了进一步验证;10%(VN1)和20%(VN2)组血清GLB含量低于对照组,当苦草粉添加量达到30%时,血清GLB含量显著高于对照组,说明适量使用苦草粉在一定程度上可以提高草鱼的免疫力。这可能与苦草中的β-谷甾醇具有较强的抗炎作用和表皮渗透性、并促进血纤维蛋白溶酶原激活因子产生等功效有关(王艳丽等, 2006)。
4 结论
本研究表明,饲料中添加30%以下的苦草粉对草鱼生长性能没有影响,且有利于鱼体健康,可以作为草鱼饲料原料进行资源化的利用;苦草粉的使用效果明显优于新鲜苦草;饲料中添加苦草粉使草鱼抢食迅速,食欲旺盛,苦草或可以作为草食性鱼类诱食剂来开发利用。
Chen SL, Liu XF, Su ZG. Nutrition and bioenergetics of the Chinese herbivorous fishes with important food values, II. Maximun consumption and digestion of seven aquatic plants byand. Acta Hydrobiologica Sinica, 1993, 17(1): 1–12 [陈少莲, 刘肖芳, 苏泽古. 我国淡水优质草食性鱼类的营养和能量学研究Ⅱ. 草鱼、团头鲂对七种水生高等植物的最大摄食量和消化率的测定. 水生生物学报, 1993, 17(1): 1–12]
Chen ZZ. Nutrient mineralization of compost of aquatic plants and its agricultural utilization approaches. Master′s Thesis of Yangzhou University, 2013, 1–51 [陈专专. 水生植物混合堆腐料养分矿化规律及农业利用途径. 扬州大学硕士研究生学位论文, 2013, 1–51]
Chimney MJ, Pietro KC. Decomposition of macrophyte litter in a subtropical constructed wetland in south Florida (USA). Ecological Engineering, 2006, 27(4): 301–321
Cui XJ, Zhou QC, Liang HO,. Effects ofdietary carbohydrate sources on the growth performance and hepatic carbohydrate metabolic enzyme activities of juvenilecobia (Linnaeus). Aquaculture Research, 2010, 42(1): 99–107
El-Sayed AFM. Effects of fermeniation methods on the nutritive value of water hyacinth for Nile tilapia (L.) fingerlings. Aquaculture, 2003, 218(1–4): 471–478
Fu SJ. The growth performance of southern catfish fed diets with raw, precooked cornstarch and glucose at two levels. Aquaculture Nutrition, 2015, 11(4): 257–261
Horppila J, Nurmnen L. Effects of submerged macrophytes on sediment resuspension and internal phosphorus loading in Lake Hiidenvesi (southern Finland). Water Research, 2003, 37(18): 4468–4474
Hu Y, Chen YF, Zhang DH,. Effects of different dietary carbohydrate and protein levels on growth, intestinal digestive enzymes and serum indexes in large-size grass carp (). Journal of Fisheries of China, 2018, 42(5): 777–786 [胡毅, 陈云飞, 张德洪, 等. 不同碳水化合物和蛋白质水平膨化饲料对大规格草鱼生长、肠道消化酶及血清指标的影响. 水产学报, 2018, 42(5): 777–786]
Huang YT, Liu YJ. Study on protease activity in the intestinal and hepatopancreas of grass carps. Acta Hydrobiologica Sinica, 1988, 12(4): 328–333 [黄耀桐, 刘永坚. 草鱼肠道肝胰脏蛋白酶活性的初步研究. 水生生物学报, 1988, 12(4): 328–333]
Hutchins CG, Rawles SD, Gatlin DMⅢ. Effects of dietary carbohydrate kind and level on growth, body composition and glycemic response of juvenile sunshine bass (♀×♂). Aquaculture, 1998, 161(1–4): 187–199
Jiang LH, Wu HY, Huang K,. Effects of dietary carbohydrate levels on growth performance and liver metabolism functions of juvenile tilapia (). Journal of Fisheries of China, 2013, 37(2): 245–255 [蒋利和, 吴宏玉, 黄凯, 等. 饲料糖水平对吉富罗非鱼幼鱼生长和肝代谢功能的影响. 水产学报, 2013, 37(2): 245–255]
Jiang YY, He JX, Li HY,Effect of protein to carbohydrate ratios on growth performance, body composition and digestive enzymes activities of juvenile grass carp (). Journal of Southern Agriculture, 2016, 47(5): 753–758 [蒋阳阳, 何吉祥, 李海洋, 等. 不同饵料蛋糖比对草鱼幼鱼生长性能、体组成和消化酶活性的影响. 南方农业学报, 2016, 47(5): 753–758]
Li WC, Chen KN, Wu QL,. Experimental studies on decomposition process of aquatic plant material from East Taihu Lake. Journal of Lake Sciences, 2001, 13(4): 331–336 [李文朝, 陈开宁, 吴庆龙, 等. 东太湖水生植物生物质腐烂分解实验. 湖泊科学, 2001, 13(4): 331–336]
Li XF, Liu WB, Lu KL,. Dietary carbohydrate/lipid ratios affect stress, oxidative status and non-specific immune responses of fingerling blunt snout bream,. Fish and Shellfish Immunology, 2012, 33(2): 316–323
Li Y, Zhou PP, Qiu H,. Effects of dietary carbohydrate sources on growth performance, digestive enzyme and carbohydrate metabolic key enzyme activities of large yellow croaker (Richardson). Chinese Journal of Animal Nutrition, 2015, 27(11): 3438–3447 [李弋, 周飘苹, 邱红, 等. 饲料中糖源对大黄鱼生长性能及消化酶、糖代谢关键酶活性的影响. 动物营养学报, 2015, 27(11): 3438–3447]
Liang JK, Lovell RT. Nutritional value of water hyacinth in channel catfish feeds. Hyacinth Control Journal, 1971, 9(1): 40–44
Luo L, Lin SM, Ye YT. The apparent digestibility of grass carp in the dry matter, protein and fat of nine feeds. Freshwater Fisheries, 2001, 31(3): 47–50 [罗莉, 林仕梅, 叶元土. 草鱼对九种饲料的干物质、蛋白质和脂肪的表观消化率. 淡水渔业, 2001, 31(3): 47–50]
Melin AM, Perromat A, Déléris G. Pharmacologic application of Fourier transform IR spectroscopy:toxicity of carbon tetrachloride on rat liver. Biopolymers, 2000, 57(3): 160–168
Michiels C, Raes M, Toussaint O,. Importance of Se-glutathione peroxidase, catalase, and Cu/Zn-SOD for cell survival against oxidative stress. Free Radical Biology and Medicine, 1994, 17(3): 235–248
Misra S, Sahu NP, Pal AK,. Pre- and post-challenge immuno- haematological changes injuveniles fed gelatinised or non-gelatinised carbohydrate with n-3 PUFA. Fish and Shellfish Immunology, 2006, 21(4): 346–356
Moyano FJ, Diaz M, Alarcon FJ,. Characterization of digestive enzyme activity during larval development of gilthead seabream (). Fish Physiology and Biochemistry, 1996, 15(2): 121–130
Pan HY, Xu XH, Gao SX. Study on process of nutrition release during the decay of submerged macrophytes. Environmental Science Research, 2008, 21(1): 64–68 [潘慧云, 徐小花, 高士祥. 沉水植物衰亡过程中营养盐的释放过程及规律. 环境科学研究, 2008, 21(1): 64–68]
Shang SY, Du JM, Zhang ZY,. Exploitation of submersed macrophytes resources and lake protection. Transactions of the Chinese Society of Agricultural Engineering, 1997(3): 16–20 [尚士友, 杜建民, 张志毅, 等. 沉水植物资源开发与湖泊保护的研究. 农业工程学报, 1997(3): 16–20]
Sun J, He F, Zhang Y,. The feeding behavior of grass carp () on different types of submerged plants. Acta Hydrobiologica Sinica, 2015, 39(5): 997–1002 [孙健, 贺锋, 张义, 等. 草鱼对不同种类沉水植物的摄食研究. 水生生物学报, 2015, 39(5): 997–1002]
Sun J, Wang L, Ma L,. Determinants of submerged macrophytes palatability to grass carpEcological Indicators, 2018, 85: 657–663
Sun J, Wang L, Ma L,. Factors affecting palatability of four submerged macrophytes for grass carp. Environmental Science and Pollution Research, 2017, 24(36): 1–9
Sun LP, Song XH, Zhu JR,. Effects of submerged plants on growth performance and non-specific immunity of Chinese mitten crab (). Freshwater Fisheries, 2012, 42(1): 35–40 [孙丽萍, 宋学宏, 朱金荣, 等. 沉水植物对中华绒螯蟹生长和非特异性免疫力的影响. 淡水渔业, 2012, 42(1): 35–40]
Sun LP. Assessment of common submerged macrophytes in east Taihu Lake as feed resources for. Master′s Thesis of Soochow University, 2011, 1–65 [孙丽萍.东太湖常见沉水植物作为中华绒螯蟹饲料源的可行性研究. 苏州大学硕士研究生学位论文, 2011, 1–65]
Sun WJ, Sheng JF. A concise manual for natural active ingredients. Beijing: China Medical Science and Technology Press, 1998, 536 [孙文基, 绳金房. 天然活性成分简明手册. 北京: 中国医药科技出版社, 1998, 536]
Szymonik-Lesiuk S, Czechowska G, Stryjecka-Zimmer M,. Catalase, superoxide dismutase, and glutathione peroxidase activities in various rat tissues after carbon tetrachloride intoxication.Journal of Hepato-Biliary-Pancreatic Surgery, 2003, 10(4): 309–315
Ugolev AM, Egorova VV, Kuzmina VV,. Comparative- molecular characterization of membrane digestion in fish and mammals. Comparative Biochemistry and Physiology, Part B: Comparative Biochemistry, 1983, 76(3): 627–635
Wang YL, Xiao Y, Pan HY,. Analysis of nutrient composition and comprehensive utilization of submersed aquatic macrophytes (). Journal of ecology and rural environment, 2006, 22(4): 45–47, 70 [王艳丽, 肖瑜, 潘慧云, 等. 沉水植物苦草的营养成分分析与综合利用. 生态与农村环境学报, 2006, 22(4): 45–47, 70]
Wei LL. Subchronic effects of microcystin-LR on the ultrastructure of liver of grass carp. Acta Agriculturae Universitatis Jiangxiensis, 2009, 31(5): 812–817 [隗黎丽. 微囊藻毒素-LR对草鱼肝脏超微结构的亚急性毒性影响. 江西农业大学学报, 2009, 31(5): 812–817]
Wu XY, Liu YJ, Tian LX,. Utilization of several different carbohydrate sources by juvenile yellowfin seabream (). Journal of Fisheries of China, 2007, 31(4): 463–471 [吴小易, 刘永坚, 田丽霞, 等. 黄鳍鲷幼鱼对几种不同糖源的利用. 水产学报, 2007, 31(4): 463–471]
Xian QM, Chen HD, Zhou HX,. Analysis of organic acids in aqueous leachates of three submerged macrophytes. Journal of Plant Resources and Environment, 2004, 13(3): 57–58 [鲜启鸣, 陈海东, 邹惠仙, 等. 3种沉水植物水浸提液中有机酸成分分析. 植物资源与环境学报, 2004, 13(3): 57–58]
Xu JM. Effcets of chitosan on growth of grass carps. Master′s Thesis of Hunan Agricultural University, 2008, 1–43 [徐介民. 壳聚糖对草鱼生长影响的研究. 湖南农业大学硕士研究生学位论文, 2008, 1–43]
Xu XX. Effects of high carbohydrate levels in the dietary on growth properties, glucose and lipid metabolisms, intestinal health and immune performance of GIFT,. Master′s Thesis of Shanghai Ocean University, 2017, 1–80 [许霄霄. 高糖饲料对吉富罗非鱼生长性能、糖脂代谢、肠道健康以及免疫性能的影响. 上海海洋大学硕士研究生学位论文, 2017, 1–80]
Yang LY, Zhang W, Chen QK,. Resources utilization of macrophytes. Water Resources Protection, 2016, 32(5): 5–10, 28 [杨柳燕, 张文, 陈乾坤, 等. 大型水生植物的资源化利用. 水资源保护, 2016, 32(5): 5–10, 28]
Yang QX. Ecological functions of aquatic vegetation in east Taihu Lake and its reasonable regulation. Journal of Lake Sciences, 1998, 10(1): 67–72 [杨清心. 东太湖水生植被的生态功能及调节机制. 湖泊科学, 1998, 10(1): 67–72
Zanotto F, Gouveia S, Simpson S,. Nutritional homeostasis in locusts: Is there a mechanism for increased energy expenditure during carbohydrate overfeeding? Journal of Experimental Biology, 1997, 200(18): 2437–2448
Zha GJ, Zhang WD, Yin F,. Seperating solid and liquid of Dianchi’sfor biogas generation. Chinese Wild Plant Resources, 2008, 27(1): 36–38 [查国君, 张无敌, 尹芳, 等. 滇池水葫芦固液分离后的沼气发酵研究. 中国野生植物资源, 2008, 27(1): 36–38]
Zhang L, Zhang WQ, Wu RF,. The comparasion of nutritional composition of commonly used aquatic plants in aquaculture ponds of adult Chinese mitten crabJournal of Zhejiang Ocean University (Natural Science), 2016, 35(2): 113–121 [张蕾, 章文琪, 吴仁福, 等. 中华绒螯蟹成蟹养殖池塘常用水草的营养成分比较. 浙江海洋学院学报(自然科学版), 2016, 35(2): 113–121]
Zhang XT, Zheng XY. Oxidative free radical scavenger superoxide dismutase and disease. Chinese Journal of Public Health, 2014, 30(10): 1349–1352 [张笑天, 郑晓瑛. 氧化自由基清除剂超氧化物歧化酶与疾病. 中国公共卫生, 2014, 30(10): 1349–1352]
Effects of AddingMeal to Diet on Growth Performance, Physiological and Biochemical Properties of Juvenile Grass Carps ()
HUANG Zhongyuan1,2,3, HE Wenhui4, PENG Ziran4, LIU Yuchao5, HUA Xueming2,3①, FENG Yue1,2,3, LI Xiang1,2,3, ZUO Lin1,2,3
(1. Centre for Research on Environmental Ecology and Fish Nutrition of the Ministry of Agricultureand Rural Affairs, Shanghai Ocean University, Shanghai 201306; 2. Key Laboratory of Freshwater Aquatic Genetic Resources, Ministry of Agricultureand Rural Affairs, Shanghai Ocean University, Shanghai 201306; 3. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306; 4. College of Marine Ecology and Environment, Shanghai Ocean University, Shanghai 201306; 5. Shanghai Taihe Water Environment Technology Development Co.Ltd., Shanghai 200433)
In this study, the effect ofmeal used as feed ingredient in the diet of grass carp () on growth, physiological, and biochemical properties was evaluated. Four isonitrogenous and isoenergic diets were formulated by replacing the secondary powder and rice bran with 0 (VN0, control), 10% (VN1), 20% (VN2), and 30% (VN3)meal. In addition, a group that was fed only with freshwas designed. Juvenile grass carp of initial weight (18.85±0.20) g were selected to be cultured for 56 days in indoor cement tank cages. The results showed that addition ofmeal did not affect the growth performance, survival rate of grass carp, and feed coefficient. With the increase in the amount ofmeal, the visceral index and hepatopancreas index significantly decreased, the activity of amylase in the foregut was significantly increased, and that in the middle and rear intestines was significantly decreased. In the control group, the protease activity of foregut, and middle and rear intestines, in turn, strengthened, and with the increase in the content ofmeal the activity of foregut protease was significantly increased; meanwhile, midgut proteinase activity increased first, then decreased, and increased again. The highest value was observed in group VN1, and protease activity in the posterior intestine showed a significant decrease trend. The superoxide dismutase (SOD) activity of the hepatopancreas was significantly increased, whereas malondialdehyde (MDA) content decreased first and then increased, and that in group VN3 was the highest. The content of serum total protein increased significantly, whereas the serum albumin content increased first and then decreased, and the highest value was found in group VN1. Compared with the control group, serum alanine aminotransferase (ALT) activity increased and then recovered to the control level, and serum aspartate aminotrasferase (AST) activity significantly decreased inmeal groups, and there was no significant difference among themeal groups. The addition ofmeal resulted in significantly reduced apparent digestibility of the diets and enhanced resistance ability of grass carp toto some extent. Group VN showed negative growth and depressed visceral index, hepatopancreas index, serum albumin, globulin, and ALT. The activity of amylase in the intestinal segments was significantly higher than that in all practical formulated diets. The activity of midgut protease in VN group was significantly higher than that in the control group, and that of hindgut protease was significantly lower than that of the control group. The above results showed that the addition of 10%~30%meal in the diet had no effect on the growth of grass carp, but was beneficial to the health of the fish body. The results indicated thatmeal used as the raw material of grass carp feed for resource utilization would be much better than fresh
Juvenile;; Growth performance; Hepatopancreas index; Apparent digestibility; Ability of anti-infection
S963
A
2095-9869(2020)01-0169-09
10.19663/j.issn2095-9869.20181106001
* 水体污染控制与治理科技重大专项子课题(2014ZX07101-012-04)资助[This work was supported by the Subproject of the National Water Pollution Control and Treatment Science and Technology Major Project (2014ZX07101-012-04)]. 黄仲园,E-mail: 1099889240@qq.com
华雪铭,副教授,E-mail:xmhua@shou.edu.cn
2018-11-06,
2018-12-10
http://www.yykxjz.cn/
黄仲园, 何文辉, 彭自然, 刘玉超, 华雪铭, 冯悦, 李向, 左琳. 苦草粉对草鱼幼鱼生长性能与生理生化性能的影响. 渔业科学进展, 2020, 41(1): 169–177
Huang ZY, He WH, Peng ZR, Liu YC, Hua XM, Feng Y, Li X, Zuo L. Effects of addingmeal to diet on growth performance, physiological and biochemical properties of juvenile grass carps (). Progress in Fishery Sciences, 2020, 41(1): 169–177
HUA Xueming, E-mail: xmhua@shou.edu.cn
(编辑 陈辉)
