白三烯受体拮抗剂联合丙酸倍氯米松气雾剂治疗咳嗽变异性哮喘患儿的临床研究
2020-02-12丁玉华赵晓晴吴修辉
丁玉华,赵晓晴,吴修辉
(1.枣庄市中医医院,山东 枣庄277000;2.枣庄矿务局中心医院,山东 枣庄277800)
目前,咳嗽变异性哮喘(cough variant asthma,CVA)尚无统一治疗措施,临床常用糖皮质激素及支气管扩张剂对其进行治疗[1-2]。丙酸倍氯米松气雾剂作为强效糖皮质激素类药物,具有抗过敏、调节免疫及减少炎症物质渗出等多种作用[3]。但有研究指出,CVA 发生过程中气道高反应及持续气道炎症反应与白三烯、组胺、前列腺素及血栓素等多种炎症介质活化、释放有关[4-5]。孟鲁司特钠作为白三烯受体拮抗剂之一,属于非激素类抗炎药物,具有使用方便、副反应小、改善哮喘症状及扩张气道明显等效果[6-7]。本研究将白三烯受体拮抗剂(孟鲁司特钠)与丙酸倍氯米松气雾剂联合应用于CVA 患儿,观察临床疗效,现报道如下。
1 资料与方法
1.1 一般资料
选取2016年1月—2018年3月在枣庄市中医医院治疗的114 例CVA 患儿,用随机数字表法分为对照组和观察组,每组57 例。所有患儿符合《咳嗽的诊断与治疗指南(2015)》[8]中CVA 诊断标准。纳入标准:①伴有咳嗽反复发作,白天轻微,夜间加重;②受凉、运动后加剧;③支气管舒张实验或激发实验阳性。排除标准:①心、肝及肾等功能严重异常;②合并其他感染性疾病;③对本研究药物过敏,急性感染及其他原因无法配合治疗。本研究通过医院伦理委员会批准。两组性别、体重指数、年龄、病程及病情严重程度等一般资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。
1.2 方法
两组均给予止咳、平喘、抗感染及化痰等常规治疗。
1.2.1 对照组 采用吸入性丙酸倍氯米松气雾剂(意大利凯西制药,国药准字H20130214)治疗,50μg/次,2 次/d。
1.2.2 观察组 在对照组基础上加用白烯受体拮抗剂[孟鲁司特钠咀嚼片(鲁南贝特制药有限公司,国药准字H20083330)]治疗。3~6 岁4 mg/次,7~12 岁5 mg/次,>12 岁10 mg/次,均1 次/d,温水口服;两组均持续用药8 周。
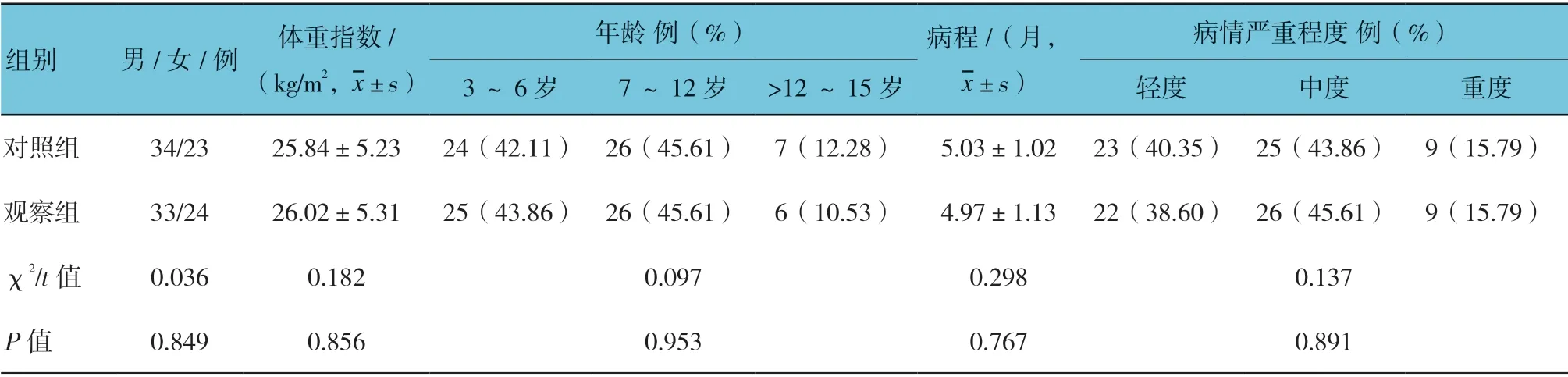
表1 两组患儿一般资料比较 (n =57)
1.3 疗效评估标准
临床痊愈:患儿慢性咳嗽基本消失,停药后2 周内未复发。①显效:患儿慢性咳嗽症状改善明显,咳嗽频次降低≥80%;②有效:患儿慢性咳嗽频次降低50%~79%;③无效:不符合上述标准者。临床痊愈、显效及有效计入总有效率[9]。
1.4 血清IL-5、TNF-α、IL-8、TNF-α、EOS及Eotaxin 水平检测
抽取患者空腹静脉血,离心取血清,用酶联免疫吸附试验检测血清血清白细胞介素-5(Interleukin-5,IL-5)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-8(Interleukin-8,IL-8)和嗜酸性粒细胞(Eosinophil,EOS)、嗜酸性粒细胞趋化因子(Eotaxin)水平,试剂盒由深圳市博锐德生物科技有限公司提供,用全自动血液分析仪(日本SYSMEX CORPORATION 公司,规格型号:XT-2000i)计数血液EOS 个数。
1.5 观察指标
①临床疗效。②日间、夜间咳嗽积分变化[10]:0 分为日间无咳嗽症状;1 分为日间偶尔出现咳嗽症状;2 分为日间偶尔出现咳嗽症状,对患儿活动影响轻微;3 分为日间咳嗽频繁,严重影响患儿活动。③夜间咳嗽症状积分变化:0 分为夜间无咳嗽症状;1 分为临睡前短暂咳嗽或夜间偶尔出现咳嗽;2 分夜间咳嗽,轻微影响患儿睡眠;3 分夜间咳嗽,严重影响患儿睡眠。④治疗前后肺功能[第1 秒用力呼气容积(forced expiratory volume in one second,FEV1)、 用力肺活量(forced vital capacity,FVC)及第1 秒用力肺活量占用力肺活量百分比(FEV1/FVC)]。⑤血清IL-5、TNF-α、IL-8 及EOS、Eotaxin 水平。⑥对治疗有效患儿随访6 个月,统计复发情况。
1.6 统计学方法
数据分析采用SPSS 22.0 统计软件。计量资料以均数±标准差(±s)表示,比较用t检验;计数资料以率(%)表示,比较用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组临床疗效比较
两组患儿治疗总有效率比较,经χ2检验,差异有统计学意义(χ2=6.218,P=0.013),观察组高于对照组。见表2。
2.2 两组日间、夜间咳嗽积分比较
两组治疗前日间、夜间咳嗽积分比较,经独立样本t检验,差异无统计学意义(P>0.05);而治疗后日间、夜间咳嗽比较,差异有统计学意义(P<0.05)。两组治疗前后日间、夜间咳嗽积分差值比较,经独立样本t检验,差异有统计学意义(P<0.05),观察组高于对照组。见表3。
2.3 两组肺功能指标比较
两组治疗前FEV1、FVC 及FEV1/FVC 比较,经t检验,差异无统计学意义(P>0.05),而治疗后FEV1、FVC 及FEV1/FVC 比较,差异有统计学意义(P<0.05)。两组治疗前后FEV1、FVC 及FEV1/FVC 差值比较,经独立样本t检验,差异有统计学意义(P<0.05),观察组高于对照组。见表4。

表2 两组临床疗效对比 [n =57,例(%)]
表3 两组日间、夜间咳嗽积分变化 (n =57,分,±s)
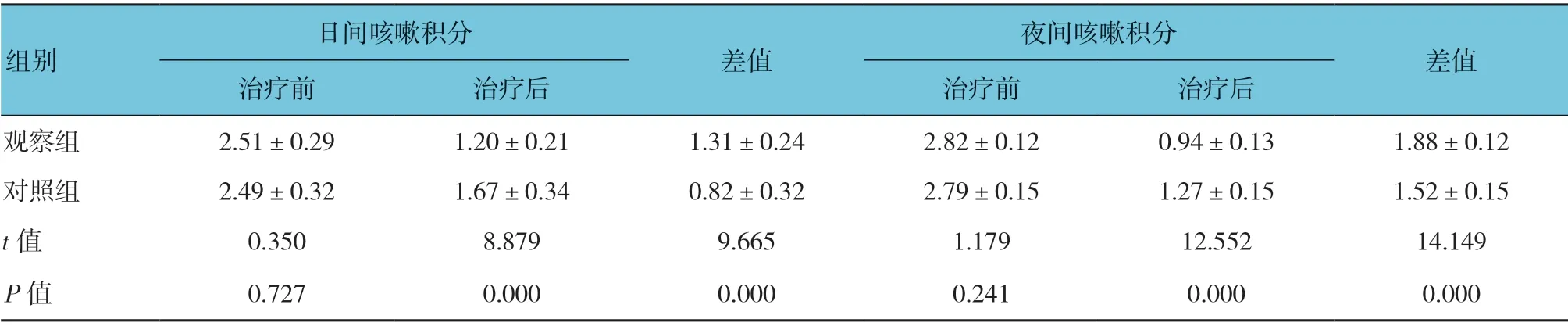
表3 两组日间、夜间咳嗽积分变化 (n =57,分,±s)
日间咳嗽积分夜间咳嗽积分差值治疗前 治疗后 治疗前 治疗后观察组 2.51±0.29 1.20±0.21 1.31±0.24 2.82±0.12 0.94±0.13 1.88±0.12对照组 2.49±0.32 1.67±0.34 0.82±0.32 2.79±0.15 1.27±0.15 1.52±0.15 t 值 0.350 8.879 9.665 1.179 12.552 14.149 P 值 0.727 0.000 0.000 0.241 0.000 0.000组别差值
表4 两组肺功能指标比较 (n =57,±s)

表4 两组肺功能指标比较 (n =57,±s)
组别 FEV1/L FVC/L FEV1/FVC/%治疗前 观察组 0.98±0.21 1.27±0.24 77.17±3.02 对照组 1.02±0.19 1.30±0.31 78.46±4.29 t 值 1.067 0.578 1.856 P 值 0.289 0.565 0.066治疗后 观察组 1.77±0.28 1.94±0.35 91.24±5.32 对照组 1.53±0.23 1.77±0.29 86.44±4.54 t 值 5.001 2.824 5.182 P 值 0.000 0.006 0.000治疗前后差值 观察组 0.79±0.24 0.67±0.29 14.07±4.42 对照组 0.51±0.21 0.47±0.30 7.98±4.37 t 值 6.629 3.619 7.397 P 值 0.000 0.000 0.000
2.4 两组炎症因子比较
两组治疗前血清IL-5、TNF-α 及IL-8 比较,经t检验,差异无统计学意义(P>0.05),而治疗后血清IL-5、TNF-α 及IL-8 比较,差异有统计学意义(P<0.05)。两组治疗前后IL-5、TNF-α 及IL-8差值比较,经独立样本t检验,差异有统计学意义(P<0.05),观察组高于对照组。见表5。
2.5 两组血清EOS、Eotaxin 水平比较
两组治疗前血清EOS、Eotaxin 水平比较,经t检验,差异无统计学意义(P>0.05);而治疗后血清EOS、Eotaxin 水平比较,差异有统计学意义(P<0.05)。两组治疗前后EOS、Eotaxin 差值比较,经独立样本t检验,差异有统计学意义(P<0.05)。观察组高于对照组。见表6。
表5 两组血清IL-5、TNF-α 及IL-8 水平比较 (n =57,ng/L,±s)

表5 两组血清IL-5、TNF-α 及IL-8 水平比较 (n =57,ng/L,±s)
组别 IL-5 TNF-α IL-8治疗前 观察组 150.01±25.05 132.45±31.57 458.30±89.42 对照组 146.78±21.52 129.02±28.03 463.28±78.38 t 值 0.738 0.613 0.316 P 值 0.462 0.541 0.752治疗后 观察组 112.68±16.56 92.89±21.37 279.57±63.26 对照组 128.68±18.54 115.68±27.05 368.07±54.02 t 值 4.859 4.991 8.032 P 值 0.000 0.000 0.000治疗前后差值 观察组 37.33±19.38 39.56±27.53 178.73±73.48 对照组 18.10±19.45 13.34±27.68 95.21±67.53 t 值 5.288 5.071 6.318 P 值 0.000 0.000 0.000
2.6 两组患儿复发情况
观察组治疗有效54 例,失访3 例,复发2 例;对照组治疗有效45 例,失访2 例,复发9 例。观察组和对照组复发率分别为3.92%和20.93%。两组复发率比较,差异有统计学意义(χ2=6.532,P=0.011),观察组低于对照组。
表6 两组血清EOS、Eotaxin 水平比较 (n =57,±s)
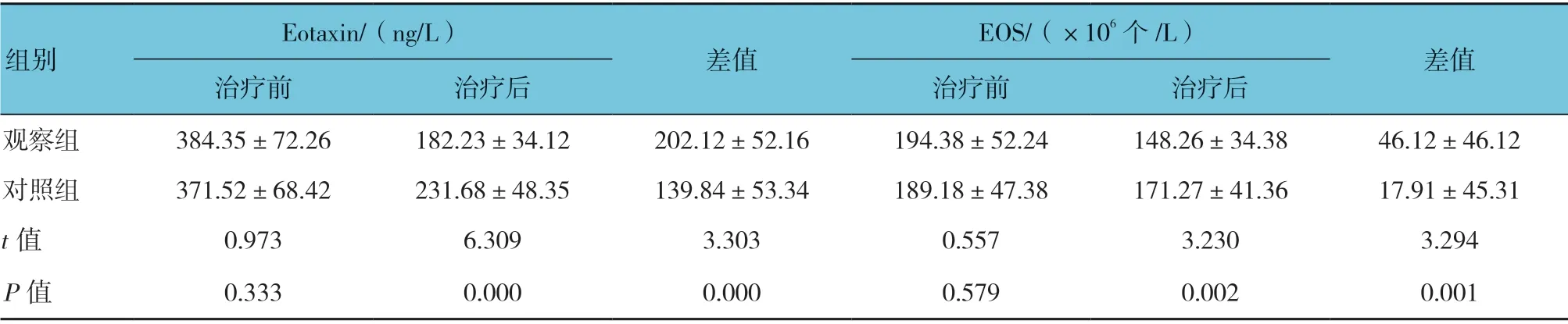
表6 两组血清EOS、Eotaxin 水平比较 (n =57,±s)
Eotaxin/(ng/L)EOS/(×106 个/L)差值治疗前 治疗后 治疗前 治疗后观察组 384.35±72.26 182.23±34.12 202.12±52.16 194.38±52.24 148.26±34.38 46.12±46.12对照组 371.52±68.42 231.68±48.35 139.84±53.34 189.18±47.38 171.27±41.36 17.91±45.31 t 值 0.973 6.309 3.303 0.557 3.230 3.294 P 值 0.333 0.000 0.000 0.579 0.002 0.001组别差值
3 讨论
炎症反应引起的气管高反应是诱发CVA 主要因素,因此常用糖皮质激素类药物来抑制炎症反应、控制疾病进展[11]。丙酸倍氯米松气雾剂作为强效局部外用糖皮质激素,可减少引起支气管收缩物质的合成及释放、促使支气管舒张。但长期实践发现,单用丙酸倍氯米松气雾剂等糖皮质激素类药物虽能降低CVA患儿气道高反应性,但有研究指出,单一雾化吸入糖皮质激素尚无法有效阻止白三烯在CVA 患儿体内的合成及释放[12-13]。
白三烯作为重要致炎因子,在CVA 发生进展过程中起着重要作用,其参与嗜酸性粒细胞等促炎症细胞因子的聚集、收缩平滑肌及增加血管通透性等一系列重要环节。白三烯受体拮抗剂孟鲁司特钠不但能抑制白三烯和其受体结合,而且还能抑制肽素生长因子合成,减缓对嗜碱性、嗜酸性干细胞的促成熟作用,进一步减轻气道炎症反应、缓解气道阻力,在哮喘及CVA 中取得的治疗效果受到临床重视。本研究结果显示,观察组治疗总有效率高于对照组,治疗后日、夜间咳嗽积分低于对照组,且FEV1、FVC 及FEV1/FVC值较高,提示白三烯受体拮抗剂与丙酸倍氯米松气雾剂联合治疗CVA,可快速改善患儿临床症状及肺功能,提高临床治疗效果。白三烯受体拮抗剂、丙酸倍氯米松气雾剂联合可起到协同、互补作用,快速控制咳嗽症状及肺功能,提高临床治疗效果。
CVA 和哮喘发病机制十分相似,是由多种炎症细胞及炎性介质参与的气道慢性炎症,尤其以EOS 浸润为主。EOS 是过敏反应及免疫反应过程极为重要的细胞,可导致哮喘患者肺组织损伤及功能紊乱[14]。同时近年来随着临床研究不断深入,发现Eotaxin 可招募EOS,并使其在肺中聚集,促使EOS 黏附在血管内皮细胞,将其活化成颗粒蛋白、加快肺组织损伤及炎症反应,在EOS 活化、黏附及募集过程中发挥着重要作用[15-16]。本研究在常规血清炎症IL-5、TNF-α 及IL-8 基础上,对EOS、Eotaxin 进行研究,结果发现治疗后观察组IL-5、TNF-α、IL-8、EOS 及Eotaxin 水平低于对照组,提示白三烯受体拮抗剂与丙酸倍氯米松气雾剂联合治疗CVA,可降低血清EOS、Eotaxin水平,抗炎作用显著。本研究还发现,治疗后随访6个月,观察组复发率低于对照组,白三烯受体拮抗剂与丙酸倍氯米松气雾剂联合治疗CVA,可降低复发率。
综上所述,白三烯受体拮抗剂与丙酸倍氯米松气雾剂联合治疗CVA,可降低血清EOS、Eotaxin 水平;加强抗炎作用,快速改善患儿临床症状及肺功能;提高临床治疗效果,降低复发率。本研究因时间原因,仅观察8 周联合用药的治疗效果。但有研究指出,糖皮质激素与白三烯受体拮抗剂联合治疗12 周后与单一用药相比,已不再具有优势[17]。基于以上研究发现,临床可考虑单一用药或减量,其具体治疗方案,还有待临床依据患儿实际病情,进一步深入研究。
