急性Standford A型主动脉夹层围手术期患者发生低血氧症的危险因素及其预测价值
2020-02-12弓华张海燕靳津鸽
弓华,张海燕,靳津鸽
(河南省胸科医院 心血管外科,河南 郑州 450008)
急性主动脉夹层(acute aortic dissection,AAD)是一种病死率极高的急性主动脉综合征,在发病最初48 h 内的每小时病死率呈1%递增[1]。根据临床上常用的Stanford 分型方法,AAD 可按是否累及升主动脉而分为A 和B 型,A 型最为常见,几乎一经确诊均需行急诊手术治疗。有文献报道,A 型AAD 患者术后低氧血症的发病率为51%[2]。围手术期低氧血症对患者手术的进行及术后恢复均不利,甚至影响患者的长期生存率。为降低A 型AAD 患者围手术期低氧血症的发病率,减少机械通气时间,本文探讨围手术期低氧血症的危险因素及其预测价值。
1 资料与方法
1.1 一般资料
选取2014年9月—2017年10月河南省胸科医院收治的急性Stanford A 型主动脉夹层患者128 例。患者均经心脏超声和胸腹主动脉电子计算机断层血管造影(CTA)明确诊断,术前均给予降血压、控制心率等治疗,部分危重患者术前行气管插管呼吸机辅助呼吸及镇静治疗。
1.2 方法
采用回顾性研究方法,收集患者的一般资料和临床资料。一般资料包括患者的性别、年龄、体重指数、既往史等;临床资料包括患者术前动脉血氧饱和度、实验室检查指标(白细胞计数、中性粒细胞百分比、超敏C反应蛋白、红细胞计数、血红蛋白、凝血酶原时间),术中停循环时间、输血总量、最低直肠温度、术后24 h 内患者氧合指数、血红蛋白浓度及体外循环转流时间等。低氧血症定义为术后24 h 内患者氧合指数<300。根据是否存在术前低氧血症将研究对象分为术前低氧血症组和术前非低氧血症组,分别有52 和76 例;根据是否存在术后低氧血症将患者分为术后低氧血症组和术后非低氧血症组,分别有91 和 37 例。
1.3 统计学方法
数据分析采用SPSS 22.0 统计软件。计数资料以构成比表示,比较用χ2检验;计量资料以均数±标准差(±s)表示,比较用t检验,采用Logistic 回归对影响因素进行分析,绘制受试者工作特征(receiver operating characteristic,ROC)曲线,P<0.05 为差异有统计学意义。
2 结果
2.1 术前低氧血症组与术前非低氧血症组临床资料比较
两组患者术后24 h 内患者氧合指数、体重指数、慢性阻塞性肺疾病史及术前超敏C 反应蛋白比较,差异有统计学意义(P<0.05)。见表1。
2.2 术后低氧血症组与术后非低氧血症组临床资料比较
两组患者慢性阻塞性肺疾病史、术中输血总量、术中体外循环转流时间及术后24 h 内患者氧合指数比较,差异有统计学意义(P<0.05)。见表2。
2.3 影响术前低氧血症的多因素Logistic 回归分析
将术前低氧血症组和术前非低氧血症组患者术后24 h 内患者氧合指数、体重指数、慢性阻塞性肺疾病史及术前超敏C 反应蛋白作为自变量,进行多因素Logistic 回归分析。以术前是否发生低氧血症(赋值:发生=1,不发生=0)作为因变量。结果显示:体重指数、慢性阻塞性肺疾病史及超敏C 反应蛋白是影响术前低氧血症的独立危险因素(P<0.05)。见表3。
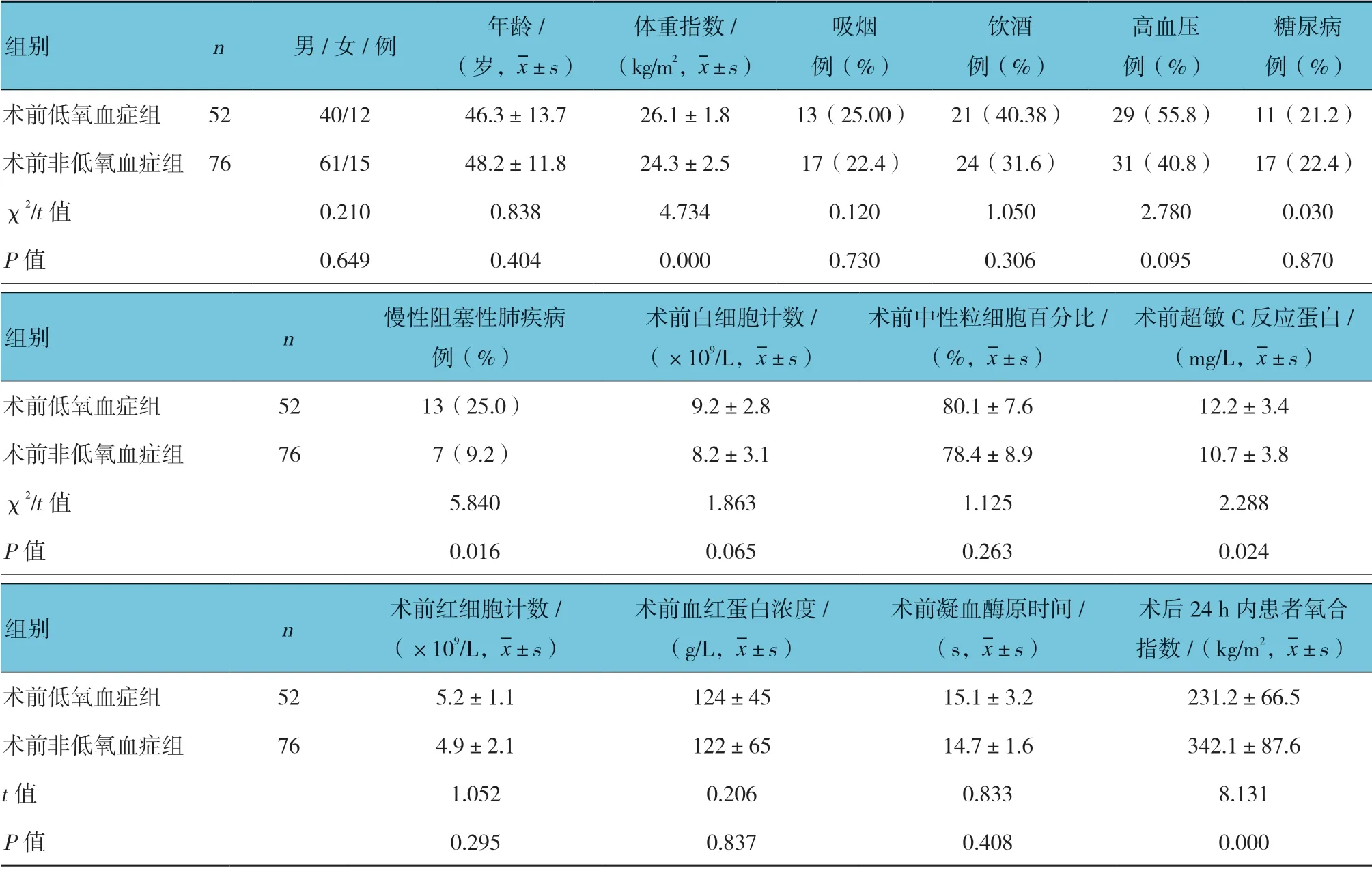
表1 术前低氧血症组与术前非低氧血症组临床资料比较

表2 术后低氧血症组和术后非低氧血症组临床资料比较
2.4 影响术后低氧血症的多因素Logistic 回归分析
将术后低氧血症组和术后非低氧血症组慢性阻塞性肺疾病史、术中输血量、术中体外循环转流时间及术后24 h 内患者氧合指数作为自变量,进行多因素Logistic 回归分析。结果显示:术中输血总量、术中体外循环转流时间是影响术后低氧血症的独立危险因素(P<0.05)。见表4。

表3 影响术前低氧血症的多因素Logistic 回归分析参数

表4 影响术后低氧血症的多因素Logistic 回归分析参数
2.5 超敏C 反应蛋白、术中输血总量及术中体外循环转流时间对低血氧症的预测价值
采用ROC 曲线分析超敏C 反应蛋白对术前低氧血症的预测价值,术中输血总量及术中体外循环转流时间对术后低氧血症的预测价值。最佳切点定义为敏感性和特异性最大值点对应的预测值。结果显示:超敏C 反应蛋白预测术前低氧血症的曲线下面积为0.814(95% CI:0.761,0.867),最佳切点为7.01 mg/L,敏感性为82.45%(95% CI:76.13%,86.75%),特异性为79.32%(95% CI:71.19%,86.72%)(见图1); 术中输血总量及术中体外循环转流时间可以预测术后低氧血症,术中输血总量曲线下面积为0.678(95% CI:0.604,0.753),最佳切点为2 310 ml,敏感性为72.22%(95% CI:62.43%,80.35%),特异性为70.19%(95% CI:60.42%,78.39%);术中体外循环转流时间曲线下面积为0.877(95% CI:0.836,0.918),最佳切点为231.2 min,敏感性为87.55%(95% CI:81.67%,92.83%),特异性为83.16%(95% CI:78.69%,89.64%)(见图2)。

图1 超敏C 反应蛋白的ROC 曲线
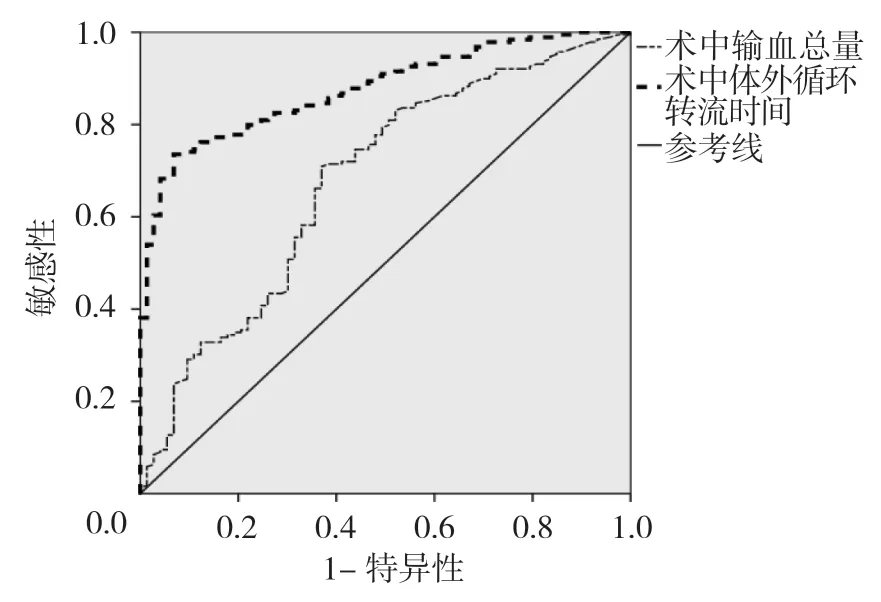
图2 术中输血总量及术中体外循环转流时间的ROC 曲线
3 讨论
急性Standford A 型主动脉夹层是一种病情危重、发展迅速的临床大血管疾病急症。有研究显示急性Standford A 型主动脉夹层在血流动力学不稳定时行手术治疗病死率为31.4%[3]。而围手术期低氧血症是一种较常见的严重并发症,会影响患者的预后和 转归[4]。
急性Standford A 型主动脉夹层患者发生术前低氧血症与年龄、糖尿病及高血压等相关性小,而与肥胖、慢性阻塞性肺疾病及慢性血管炎症等密切相关[5-8]。本研究结果显示,术前低氧血症组与术前非低氧血症组术后24 h 内患者氧合指数、体重指数、慢性阻塞性肺疾病史及术前超敏C 反应蛋白比较有差异。多因素分析显示,体重指数、超敏C 反应蛋白及慢性阻塞性肺疾病是影响术前低氧血症的危险因素,提示术前低氧血症的发生与炎症反应密切相关。有研究表明多种炎症指标,如C 反应蛋白、肿瘤坏死因子-α、白细胞介素-6 等在急性主动脉夹层患者术前明显上升,表明非特异性炎症与术前低氧血症的发生息息相关[9]。通过ROC 曲线分析验证,超敏C 反应蛋白对术前低氧血症的曲线下面积为0.814,具有较好的预测 价值。
术后低氧血症影响术后恢复,甚至造成死亡,因此探讨其发生的危险因素对提高临床疗效尤为重要。术后低氧血症的发生可能与肥胖、吸烟、手术创伤大、输血量大及术中体外循环转流时间较长相关[10-12]。而本研究显示,术后低氧血症组与术后非低氧血症组慢性阻塞性肺疾病史、术中输血量、术中体外循环转流时间及术后24 h 内患者氧合指数比较有差异。多因素分析显示,术中输血总量、术中体外循环转流时间是影响术后低氧血症的独立危险因素。因此术中输血总量、术中体外循环转流时间可以用于术后低氧血症发生的预判。术中大量输血时,因过敏、微栓子形成等可导致急性肺部损伤,易引起术后低氧血 症[13]。而术中体外循环时间过长可引起严重的全身性炎症反应,导致肺微血管通透性增加,引起肺泡及肺间质水肿,造成肺部无通气,出现低氧血症[14-15]。通过ROC 曲线分析验证,术中输血总量、术中体外循环转流时间对术后低氧血症的曲线下面积分别为0.678 和0.877,均具有较好的预测 价值。
综上所述,超敏C 反应蛋白是术前低氧血症发生的独立危险因素,术中输血总量、术中体外循环转流时间是术后低氧血症发生的独立危险因素,其可作为急性Standford A 型主动脉夹层围手术期低氧血症发生的预测因子。
