五味子酯甲通过调节肝脏Nrf2/ARE抗氧化通路改善小鼠疲劳的作用
2020-02-08张馨芸林慧娇蒋维海王春梅孙靖辉陈建光
张馨芸,林慧娇,李 欣,敬 舒,孙 微,蒋维海,王春梅,孙靖辉,李 贺,陈建光,
(1.北华大学药学院,吉林 吉林 132013;2.北华大学附属医院,吉林 吉林 132013)
统计资料表明,我国目前有半数以上的人群处于经常疲劳的状态,在城市人口中已占70%[1]。氧化应激损伤是疲劳产生的主要原因之一[2-5],以保护机体氧化损伤为靶点的抗疲劳产品,尤其是中药抗疲劳保健食品日益受到人们的关注。五味子(Schisandra chinensis(Turcz.)Baill)是木兰科植物五味子的干燥成熟果实,其主要活性成分为多糖、木脂素等[6-7]。目前,关于五味子多糖具有抗疲劳及耐缺氧作用的报道较多[8-10],而五味子木脂素的相关研究较少。前期研究发现,五味子总木脂素能显著提高小鼠的抗疲劳能力[11-12],但其中发挥主要作用的活性成分并未知晓。五味子酯甲(schisantherin A,SCA)是五味子木脂素的主要单体化合物成分,已有研究证实SCA具有较强的抗氧化功能[13-15],但关于其抗疲劳作用的研究鲜有报道。本实验通过观察SCA对小鼠的抗疲劳作用及其与Nrf2/ARE抗氧化通路的相关机制,以验证五味子总木脂素抗疲劳作用的主要活性成分,为开发辅助抗疲劳功能的药物及保健食品提供理论依据。
1 材料与方法
1.1 动物、材料与试剂
ICR小鼠,雄性,体质量(19f 2)g,吉林大学实验动物研究中心提供,实验动物生产许可证号SCXK(吉)-2016-0003。
SCA 四川省维克奇生物科技有限公司;吐温20(分析纯) 天津永大试剂公司;血尿素氮(blood urea nitrogen,BUN)试剂盒、乳酸(lactic acid,LA)试剂盒、乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒、肌酸激酶(creatine kinase,CK)试剂盒、肝糖原(liver glycogen,LG)试剂盒、肌糖原(muscle glycogen,MG)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、8-羟基脱氧鸟苷(8-hydroxy-2’-deoxyguanosine,8-OHdG)试剂盒 南京建成生物工程研究所;HCl-Tris、过硫酸铵、30%丙烯酰胺、甘氨酸、四甲基乙二胺 北京鼎国试剂公司;脱脂奶粉 美国BD公司;Keap1、Nrf2、HO-1 武汉ABclone公司;电化学发光(electro-chemiluminescence,ECL)显色液 美国Vazyme公司。
1.2 仪器与设备
Western blot凝胶电泳仪、转膜仪 美国Bio-Rad 公司;全自动多色荧光及化学发光凝胶成像系统 北京赛智创业科技有限公司;infinite M200全自动酶标仪 瑞士TECAN集团。
1.3 方法
1.3.1 动物分组及给药
将120 只ICR小鼠随机分为4 组:CON组:蒸馏水灌胃及静坐实验;MOD组:蒸馏水灌胃及负重游泳训练;SCA(C)组:SCA(2.5 mg/kg)灌胃及静坐实验; SCA(M)组:SCA(2.5 mg/kg)灌胃及负重游泳训练。各组小鼠每天给药1 次(0.1 mL/10 g)。
1.3.2 动物造模方案
静坐实验,不施加其他外界刺激干扰,不进行运动训练,保持小鼠正常活动状态。负重游泳训练,将小鼠置于(15f 2)℃、水面高度20 cm的塑料容器中,第一天30 min,第二天45 min,然后,每天60 min,每周训练5 d。游泳训练第2~6周每天保持1 h,负重为体质量的10%。每周称量体质量,并且相应地增加负荷。
1.3.3 小鼠负重游泳实验
在末次给予药物30 min之后,进行负重游泳实验(方法同1.3.2节),至小鼠沉于水面下10 s后不能浮出水面的时间作为力竭游泳时间[16]。
1.3.4 小鼠疲劳转棒实验
在末次给予药物30 min之后,进行疲劳转棒实验(转速30 r/min)。正式实验前进行适应性训练3 次,开始记录小鼠由于肌肉疲劳产生后,从转棒上跌下的时间[17]。
1.3.5 SCA对小鼠体内疲劳相关生化指标的测定
在末次给予药物30 min之后,小鼠不负重游泳60 min(温度(15f 2)℃),休息60 min后进行摘眼球取血,制备血清。采血后即刻取小鼠的肝脏,用生理盐水漂洗后滤纸吸干,备用。检测血清中BUN、LA、LDH、CK的水平以及肝脏、肌肉中LG、MG的含量。
1.3.6 SCA对小鼠体内氧化相关生化指标的测定
取1.3.5节中制备的血清,按照试剂盒提供的方法检测MDA、8-OHdG水平和SOD、GSH-Px活力。
1.3.7 Western blot法检测血清中Keap1、Nrf2及HO-1的表达情况
在末次给予药物30 min之后,小鼠不负重游泳60 min(温度(15f 2)℃),休息60 min后,每组取3 只小鼠肝组织,冰上加入裂解液裂解1 h,离心后取上清液。测定肝组织蛋白浓度(二喹啉甲酸法[18]),十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离Keap1、Nrf2、HO-1蛋白。电转移至偏聚氟乙烯膜(2 h),封闭1 h(含质量分数5%脱脂奶粉的TBST缓冲液)。室温孵育后弃去封闭液,分别加入一抗Keap1(1∶1 000)、Nrf2(1∶1 000)、HO-1(1∶1 000),4 ℃温育过夜后使用TBST洗5 次,每次5 min。二抗(1∶2 000)室温温育1 h,TBST洗5 次,每次5 min,ECL显影液显色。
1.4 数据统计分析
2 结果与分析
2.1 负重游泳实验和转棒实验观察SCA对小鼠运动耐力的影响
负重游泳实验结果显示(图1A),与CON组相比,MOD组小鼠负重游泳时间极显著缩短(P<0.01),SCA(C)组小鼠负重游泳时间显著延长(P<0.05);与MOD比较,SCA(M)组小鼠负重游泳时间显著延长(P<0.05)。如图1B所示,转棒实验中,与CON组相比,MOD转棒时间极显著缩短(P<0.01),SCA(C)组小鼠转棒时间显著延长(P<0.05),与MOD组比较, SCA(M)组小鼠转棒时间显著延长(P<0.05)。
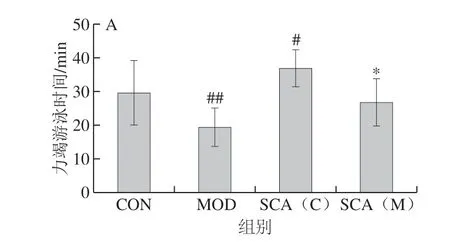
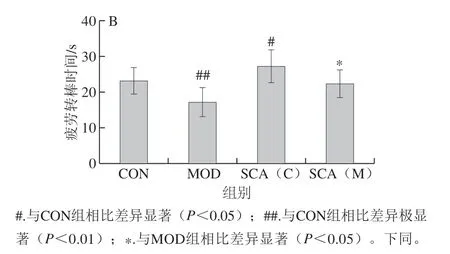
图 1 负重游泳实验(A)和转棒实验(B)观察SCA对小鼠运动耐力的影响(n= 15)Fig. 1 Effect of SCA on exercise endurance in mice by weight-bearing swimming test (A) and rotarod test (B) (n = 15)
2.2 SCA对小鼠血清中BUN、LA浓度,LDH、CK活力以及肝脏与肌肉组织中LG、MG含量的影响
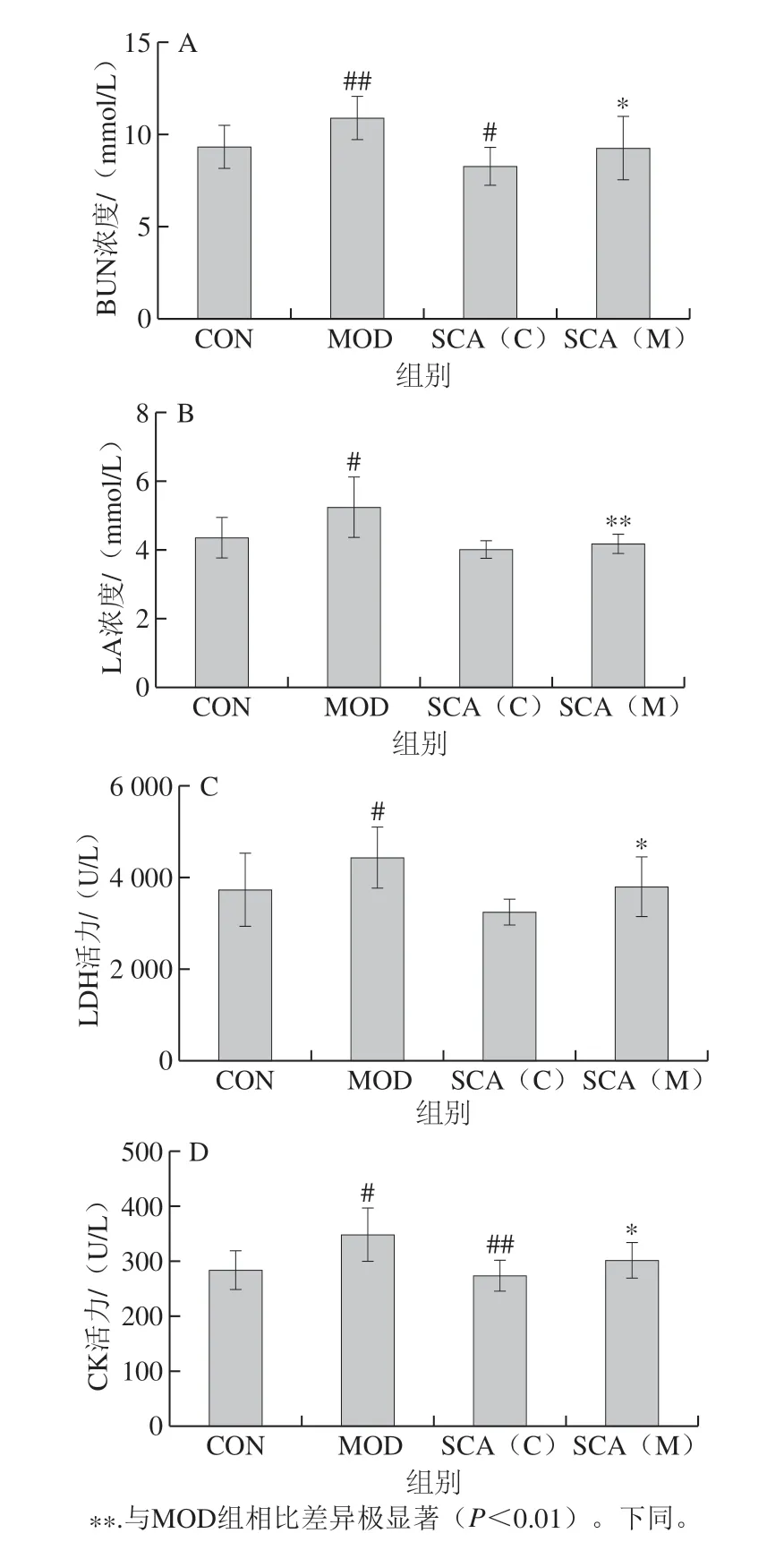
图 2 SCA对疲劳小鼠血清中BUN(A)、LA(B)、LDH(C)、CK(D)水平的影响(n= 15)Fig. 2 Effect of SCA on the levels of BUN (A), LA (B), LDH (C) and CK (D) in serum of fatigue mice (n =15)
小鼠血清中B U N 浓度结果显示(图2 A),与CON组相比,MOD组小鼠血清BUN浓度极显著增加 (P<0.01),SCA(C)组小鼠血清BUN浓度显著降低(P<0.05);与MOD组相比,SCA(M)组小鼠血清BUN浓度显著降低(P<0.05)。对各组小鼠血清LA浓度检测结果显示(图2B),与CON组相比,MOD组小鼠血清中LA浓度显著增加(P<0.05),SCA(C)组小鼠血清LA浓度降低,无统计学差异;与MOD组相比,SCA(M)组小鼠血清LA浓度极显著下降(P<0.01)。对各组小鼠血清LDH活力检测结果显示(图2C),与CON组相比,MOD组小鼠血清中LDH活力显著升高 (P<0.05),SCA(C)组小鼠血清LDH活力降低,但无统计学差异;与MOD组相比,SCA(M)组小鼠血清LDH活力显著下降(P<0.05)。对各组小鼠血清CK活力检测结果显示(图2D),与CON组相比,MOD组小鼠血清CK活力升高(P<0.05),SCA(C)组小鼠血清CK活力极显著降低(P<0.01);与MOD组相比, SCA(M)组小鼠血清CK活力显著降低(P<0.05)。
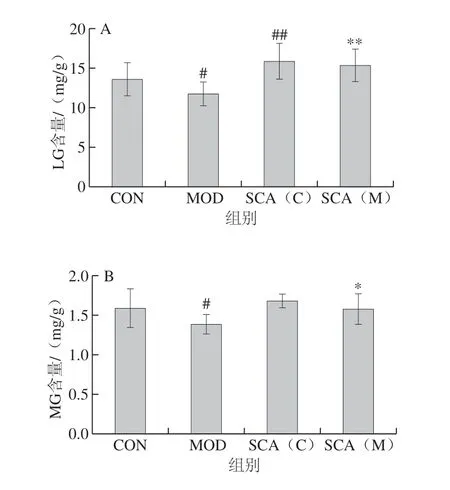
图 3 SCA对疲劳小鼠肝组织及肌肉组织中LG(A)及 MG(B)含量的影响(n= 15)Fig. 3 Effect of SCA on the contents of LG (A) and MG (B) in liver and muscle tissues of fatigue mice (n = 15)
由图3A可知,与CON组相比,MOD组小鼠LG含量显著降低(P<0.05),SCA(C)组小鼠LG含量极显著升高(P<0.01);与MOD组相比,SCA(M)组小鼠LG含量极显著升高(P<0.01)。对肌肉组织中MG含量检测结果显示(图3B),与CON组相比,MOD组小鼠MG含量显著降低(P<0.05),SCA(C)组小鼠MG含量无统计学差异;与MOD组相比,SCA(M)组小鼠MG含量显著升高(P<0.05)。
2.3 SCA对小鼠血清中SOD、GSH-Px活力及MDA、8-OHdG水平的影响
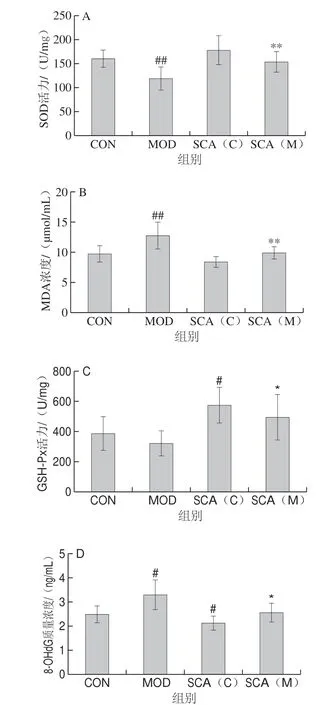
图 4 SCA对疲劳小鼠血清中SOD(A)、MDA(B)、GSH-Px(C)、8-OHdG(D)水平的影响(n=15)Fig. 4 Effect of SCA on the levels of SOD (A), MDA (B), GSH-Px (C), and 8-OHdG (D) in serum of fatigue mice (n = 15)
由图4A可知,与CON组相比,MOD组小鼠血清中SOD活力极显著下降(P<0.01),SCA(C)组小鼠血清中SOD活力升高,但无统计学差异;与MOD组相比,SCA(M)组小鼠血清中SOD活力极显著升高 (P<0.01)。各组小鼠血清中MDA浓度检测结果显示(图4B),与CON相比,MOD组小鼠血清中MDA浓度极显著升高(P<0.01),SCA(C)组小鼠血清中MDA浓度降低,无统计学差异;与MOD组相比,SCA(M) 组小鼠血清中MDA浓度显著降低(P<0.05)。各组小鼠血清中GSH-Px活力检测结果显示(图4C),与CON组相比,MOD组小鼠血清中GSH-Px活力降低,但无统计学差异,SCA(C)组小鼠血清中GSH-Px活力显著升高(P<0.05);与MOD组相比,SCA(M)组小鼠血清中GSH-Px活力显著升高(P<0.05)。各组小鼠血清中8-OHdG质量浓度检测结果显示(图4D),与CON组相比,MOD组小鼠血清中8-OHdG质量浓度显著升高 (P<0.05),SCA(C)组小鼠血清中8-OHdG质量浓度显著降低(P<0.05);与MOD组相比,SCA(M)组小鼠血清中8-OHdG质量浓度显著降低(P<0.05)。上述结果提示SCA可能通过提高小鼠机体的抗氧化能力而发挥抗疲劳作用。
2.4 SCA对疲劳小鼠肝组织中Keap1、Nrf2、HO-1蛋白表达影响
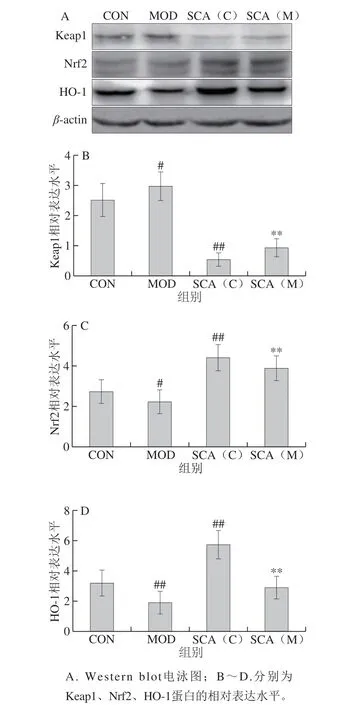
图 5 SCA对疲劳小鼠肝组织中Keap1、Nrf2、HO-1蛋白表达的 影响(n= 3)Fig. 5 Effect of SCA on the expression of Keap1, Nrf2 and HO-1 proteins in liver tissue of fatigue mice (n = 3)
本研究应用Western blot方法从蛋白水平观察各组小鼠Keap1、Nrf2、HO-1的表达情况。Western blot结果如图5所示,与CON组相比,MOD组小鼠肝组织Keap1蛋白表达水平上升,Nrf2、HO-1蛋白表达水平极显著下降(P<0.01);SCA(C)组小鼠Keap1蛋白表达水平极显著下降(P<0.01),Nrf2、HO-1蛋白表达水平极显著上升(P<0.01);与MOD组相比,SCA(M)组Keap1蛋白表达水平极显著下降(P<0.01),Nrf2、HO-1蛋白表达水平极显著上升(P<0.01)。进一步验证了SCA有可能通过影响Keap1/Nrf2/ARE信号通路中Keap1、Nrf2、HO-1表达而发挥相关作用。
3 讨 论
运动耐力是评价受试动物疲劳程度的重要指标[19-20]。本研究应用负重游泳及疲劳转棒实验两种方法观察SCA对小鼠运动耐力的影响。实验设立慢性疲劳模型SCA给药组,即SCA(M)组,通过持续28 d的冷水负重游泳训练致小鼠慢性疲劳,用以对照观察SCA给药对小鼠慢性疲劳的影响;此外,本实验另设SCA未训练鼠给药组即SCA(C)组,旨在观察SCA对急性运动疲劳小鼠运动耐力的影响。实验结果显示,无论在负重游泳实验还是疲劳转棒实验中,SCA(M)及SCA(C)组小鼠均表现出明显的机体抗疲劳作用,提示SCA能够提高慢性疲劳及急性疲劳小鼠的运动耐力。
BUN的浓度反映了蛋白质分解代谢和身体对运动的耐受性,在剧烈运动的过程中,有氧能量供应变为肌肉中的无氧糖酵解,肌糖原被迅速消耗,产生大量的LA。LA在肌肉和血液中的累积会导致肌肉疲劳,而血清中LDH、CK的水平反映机体运动肌肉损伤的程度。MG在运动中直接提供能量,LG储备能量,它们的氧化产物是运动能量的主要来源[21]。本研究结果显示,SCA(M)组小鼠(与MOD组比较)及SCA(C)组小鼠(与CON组比较)血清BUN、LA、LDH及CK的水平均明显降低,而肝糖原、肌糖原的浓度明显增加。血清中LDH和CK的水平显著降低,表明可能是由于SCA在强烈运动期间保护细胞免受损伤,且SCA加快了乳酸的分解,降低BUN浓度,延缓了疲劳的发生。MG与LG的含量增加为运动提供了更多的能量。进一步证实SCA具有抗疲劳作用。
小鼠的剧烈运动加速自由基的产生,并诱发氧化应激损伤[22-24]。SOD是最主要的抗氧化酶,在机体氧化与抗氧化平衡中起重要的作用;MDA是脂质过氧化的产物,是反应自由基所致的机体损伤的重要指标,其在血清中的含量随着机体的疲劳累积而升高;GSH-Px作为机体内广泛存在的一种重要的过氧化物分解酶,能够催化GSH变为GSSG,还原有毒的过氧化物变为无毒的羟基化合物,进而保护细胞不受过氧化物的损伤;8-OHdG可以反映机体细胞DNA氧化损伤的程度,该值越高提示DNA氧化损伤越严重[25-27]。本实验结果显示,SCA可以提高疲劳小鼠血清中SOD、GSH-Px的活力,降低MDA、8-OHdG水平,提示SCA在慢性疲劳小鼠及急性疲劳小鼠中都表现出显著的抗氧化作用,该结果与其他研究酯甲抗氧化功能的结果[28]是一致的。
Nrf2/ARE信号通路是参与机体抗氧化反应的重要调节通路,Nrf2是细胞氧化的关键调节因子[29]。据报道,Nrf2缺陷小鼠表现出对肝脏组织中氧化应激的极端易感性,通过改善体内Nrf2的活性,可以有效地对抗氧化应激损伤,进而减轻疲劳[30-31]。Keap1是Nrf2负调控因子,其自身的泛素化、磷酸化以及核穿梭机制都能影响Nrf2的活力[32]。HO-1是体内较强的抗氧化剂,受Nrf2调控[33-34]。 本研究显示SCA能够下调慢性疲劳小鼠肝脏组织中Keap1蛋白的表达,并上调Nrf2、HO-1蛋白的表达,提示SCA可能通过调节Nrf2/ARE信号通路减轻氧化应激以产生抗疲劳作用。后续研究将继续探讨SCA对肝脏以外其他组织中Nrf2/ARE信号通路的影响,以进一步探明SCA抗疲劳作用机制。
综上,SCA对小鼠具有显著的抗疲劳作用。该作用可能与其提高小鼠能量储备、抗氧化能力及调节肝脏Nrf2/ARE抗氧化通路有关。
