绿桐增殖、生根培养及炼苗移栽研究*
2020-02-07张红岩莫勇生申乃坤
张红岩,莫勇生,欧 娜,谢 唯,申乃坤
(1.广西科学院生物研究所,广西南宁 530007;2.广西民族大学海洋与生物技术学院,广西南宁 530006)
0 引言
绿桐(Paulowniafortunei×Paulowniatomentosa)也叫青桐,是玄参科泡桐属(Paulownia)植物,因树皮呈绿色而得名,是由白花泡桐Paulowniafortunei与毛泡桐Paulowniatomentosa通过杂交培育出来的泡桐新品种。绿桐具有适应性强、生长迅速、成材量大、木材物理性能好、可高密度种植等优点[1-4],故其幼苗的市场需求量极大。由于绿桐种子较小且发芽率低,因此目前主要采用埋根或埋条等无性繁殖方式来获得绿桐幼苗。但是,绿桐无性繁殖速度慢且需要较大的人力及占地面积,导致在短期内难以获得大量优质苗木。另外,在无性繁殖过程中易造成苗木体内病毒的“累积”效应,致使丛枝病(通过种根和种苗传播)逐代加重,严重影响绿桐的生长速度和成材率。通过组织培养技术快速获得大量的绿桐组培苗,可以解决当前在种植区苗木带菌率高、病害随繁殖材料传播蔓延等问题,满足当前市场需求。有关泡桐属其他树种的组织培养研究较多,如范国强等对白花泡桐的愈伤诱导[5]及体细胞胚诱导[6-8]等组织培养技术进行研究,认为泡桐最适诱导愈伤组织培养基为MS+0.1 mg/L萘乙酸(NAA)+14 mg/L 6-苄氨基嘌呤(6-BA);幼芽生根最优培养基为1/2 MS+0.1 mg/L NAA。刘飞等[9]对组培苗离体开花体系进行了研究。孔德广等[10]采取温度处理组培苗后结合茎尖培养脱去植物菌原体的脱毒方法,既能保证种苗无病,又能保持泡桐原来的优良特性。田国忠等以泡桐成年树上茎段为外植体,获取再生植株,并结合茎尖培养方法进行脱毒试验[11],同时还对泡桐组培脱毒苗和规模化生产关键技术进行优化和完善[12,13],结果表明使用0.1%升汞(HgCl2)对外植体进行消毒(茎尖消毒7-8 min,茎段消毒10-12 min),消毒效果较好,且对外植体伤害较小,萌发较快,易获得无菌苗;春季营养杯苗移栽适宜时间为3月中旬至5月初,秋季移栽时间为8月下旬至10月上旬。杨晨星等[14]对大岩桐外植体消毒进行研究,结果显示10% H2O2消毒处理,外植体污染和褐化率较高;消毒效果较好的2个组合为75%乙醇30 s+0.1% HgCl2消毒10 min和75%乙醇30 s+5% NaClO消毒10 min,该研究为其他类似植物外植体消毒提供参考。江香梅等[15]以“桐优1”等3个泡桐品种的叶片、茎段、根萌条为外植体材料进行诱导试验,结果发现根萌条是建立泡桐无菌体系的理想材料。苏江等[16]建立白花泡桐的组织培养技术,认为最佳培养基如下:初代诱导培养基为MS+2.0 mg/L 6-BA+0.2 mg/L IBA,芽诱导率超70%;继代增殖培养基为MS+4.0 mg/L 6-BA+0.4 mg/L IBA和MS+0.4 mg/L 6-BA+0.04 mg/L IBA中交替培养,增殖系数可达6.0以上,且芽长势健壮,外植体发生玻璃化的概率小于5%;生根培养基为1/2 MS+0.2 mg/L NAA,生根率达98%以上。这些研究为泡桐的快速扩大繁殖奠定了良好技术基础,为绿桐的组织培养提供了丰富的理论参考。但由于植物组织培养存在种属特异性,不同种属之间差别很大[17],因此不同泡桐优良单株的最优组培脱毒技术和方法也不尽相同[18]。另外,幼苗从生根到室外移栽成活率极低,因此需要对绿桐组织培养技术进一步研究。目前有关绿桐组织培养的研究还鲜有报道,加之市场上绿桐组培苗供应量小,价格奇高(每株高达几十元),完全满足不了市场需求。因此,本研究拟建立绿桐快繁技术体系,通过对外植体消毒方式、不定芽诱导及增殖继代、组培苗生根及室外移栽等因素进行系统性研究,为工厂化生产绿桐组培苗提供技术参考。
1 材料与方法
1.1 材料
供试材料绿桐1号由广西瑞谱生物科技有限公司提供,选取当年生嫩枝或从大树旁长出的嫩枝作为外植体,取材期为2018年4月。所用琼脂,蔗糖,MS培养基所需的微量元素、大量元素,有机物试剂,以及植物生长调节剂如6-苄氨基嘌呤(6-BA)、赤霉素(GA3)、2,4-对氯苯氧乙酸(2,4-D)、萘乙酸(NAA)、吲哚-3-丁酸(IBA)均为国产分析纯。
1.2 方法
1.2.1 外植体消毒
选取健壮的速生绿桐当年生枝条。截取前端30 cm左右,剪去叶片,保留叶柄2-3 cm,修整后的枝条置于加有2滴洗洁精的水中浸泡5 min;流水冲洗20 min,转入超净台,剪成长4-5 cm且带有一个或者2个叶柄的小段,用75%酒精浸泡30 s。然后分成3等份分别进行以下处理:(1)0.1%升汞浸泡8 min;(2)10%次氯酸钠和0.1%升汞等体积混合,浸泡8 min;(3)10%次氯酸钠和0.1%升汞等体积混合消毒处理5 min,无菌水冲洗1次,然后用0.1%升汞消毒3 min。最后分别用无菌水冲洗3次后待用。每个处理10瓶,每瓶接种10个外植体,外植体得率(%)=无污染外植体数/外植体总数×100%。
1.2.2 植物生长调节剂及其用量对腋芽萌发的影响
将消毒外植体(茎段)两端各斜切小部分并除去叶柄,然后接种于含有不同浓度6-BA (0.8,1.0,1.2 mg/L)、GA3(0,0.8 mg/L)和2,4-D (0.5,1.0 mg/L)的MS培养基中诱导腋芽,每个处理3个重复,每个重复接种外植体50个。培养过程中统计污染率,培养30 d后统计腋芽诱导率。诱导率(%)=萌发腋芽数/接种茎段数×100%。
1.2.3 植物生长调节剂及其用量对不定芽增殖的影响
初代培养诱导出的不定芽离体后,分别接种于含有不同浓度的6-BA (0.6,0.8,1.0,1.2 mg/L)和NAA (0,0.2,0.4 mg/L)的MS增殖培养基上,每个处理3个重复,每个重复接种不定芽60个。培养30 d后统计不定芽的增殖系数,期间定期观察不定芽的长势。
1.2.4 植物生长调节剂及其用量对不定芽生根的影响
剪取继代增殖培养中长势较好、株高3 cm以上的不定芽,分别接种于含不同浓度的IBA (0.4,0.6,0.8,1.0 mg·L-1)和NAA (0.2,0.4,0.6 mg/L)的1/2 MS生根培养基中,每个处理3个重复,每个重复接种不定芽50个,每个组培瓶接种不定芽5个。培养15 d后,统计平均根长、根数、生根率及芽生长情况。生根率(%)=生根的不定芽数/接种的总芽数×100%。
上述培养基均添加30 g/L蔗糖,4.5 g/L琼脂粉,调整pH值为5.8。培养室温度为26-28℃,光强为2 200 lx,光照周期为12 h/d。
1.2.5 组培苗室外移栽
组培苗生根培养约30 d后,选择株高8-10 cm,根长约3 cm且根系发育良好的绿桐无菌苗,将根部培养基清洗干净,清洗时应避免根部断裂或受伤,然后移栽至无菌营养土中。采取以下移栽方式移栽:①直接移栽——将组培移栽至无直射光照室内培养7 d,然后室外正常自然光照;②先炼苗后再移栽——将组培苗在自然通风及光照条件下的实验室炼苗7 d,然后移栽并进行覆膜保湿7 d,转入室外正常自然光照;③不炼苗,移苗后覆膜——组培苗移苗后覆膜保湿7 d,室外正常自然光照。35 d后统计各个处理的移栽成活率。
2 结果与分析
2.1 消毒方法对绿桐外植体污染及腋芽萌发的影响
消毒处理方式及消毒时间对外植体污染及腋芽萌发有显著影响:消毒剂毒性过大或消毒时间过长,腋芽萌发慢甚至不萌发;消毒剂毒性过小或时间过短,外植体灭菌不彻底,污染率过高。
从表1可以看出,不同消毒方式处理的茎段,其萌发时间不同且茎段的颜色也会受到影响,方法(1)和(2)的萌发时间较长,外植体污染率均超过50%,且外植体颜色由最初的深绿色变为浅绿色,有的甚至变为棕色,说明消毒对外植体伤害较大;方法(3)处理过的茎段得率最高为62%,且腋芽萌发时间也最短(12 d),说明此消毒方法最有效,且对外植体毒害较小,保证了外植体的成活和诱导效果。因此,消毒方法(3)适用于绿桐茎段的消毒。

表1 消毒处理方法对绿桐腋芽萌发的影响
2.2 植物生长调节剂对不定芽诱导的影响
在含不同植物生长调节剂的MS培养基上,茎段腋芽萌动及长势差异明显(表2)。MS培养基中的生长调节剂为1.0 mg/L 6-BA+ 1.0 mg/L 2,4-D + 0.8 mg/L GA3时,茎段腋芽诱导效果最好,诱导率可达78%;诱导时间约12 d时,叶柄基部的芽点开始萌动,约20 d逐渐生长成不定芽,且长势最好,诱导出的不定芽比较健壮。而其他配方诱导率较低,腋芽长势弱,萌发较慢。

表2 植物生长调节剂对不定芽诱导的影响
2.3 植物生长调节剂对绿桐不定芽增殖的影响
将诱导产生的不定芽切段转接到含不同浓度6-BA和NAA的MS增殖培养基上,不定芽出现时间及增殖系数随着培养基中6-BA、NAA组成及含量的变化而不同(表3)。当培养基中无植物生长调节剂时,无法实现不定芽增殖。培养基中只添加6-BA时,茎段均能诱导产生不定芽,当6-BA浓度为1.0 mg/L,不定芽增殖系数最高(1.08);而其浓度高于1.0 mg/L时,增殖系数开始下降。培养基中只添加NAA时,无法实现不定芽增殖,但接种的不定芽茎段长势良好,有明显的伸长现象,并产生较多的根。当培养基中6-BA和NAA浓度分别为0.8,0.4 mg/L时,不定芽增殖效果最好,增殖系数可达2.02,继代培养周期约为21 d,不定芽生长粗壮(图1a);当6-BA和NAA浓度分别为 0.8,0.6 mg/L时,新的不定芽叶片出现玻璃化现象,增殖系数降低。以上结果表明:绿桐不定芽增殖的最适植物生长调节剂为0.8 mg/L 6-BA+0.4 mg/L NAA。
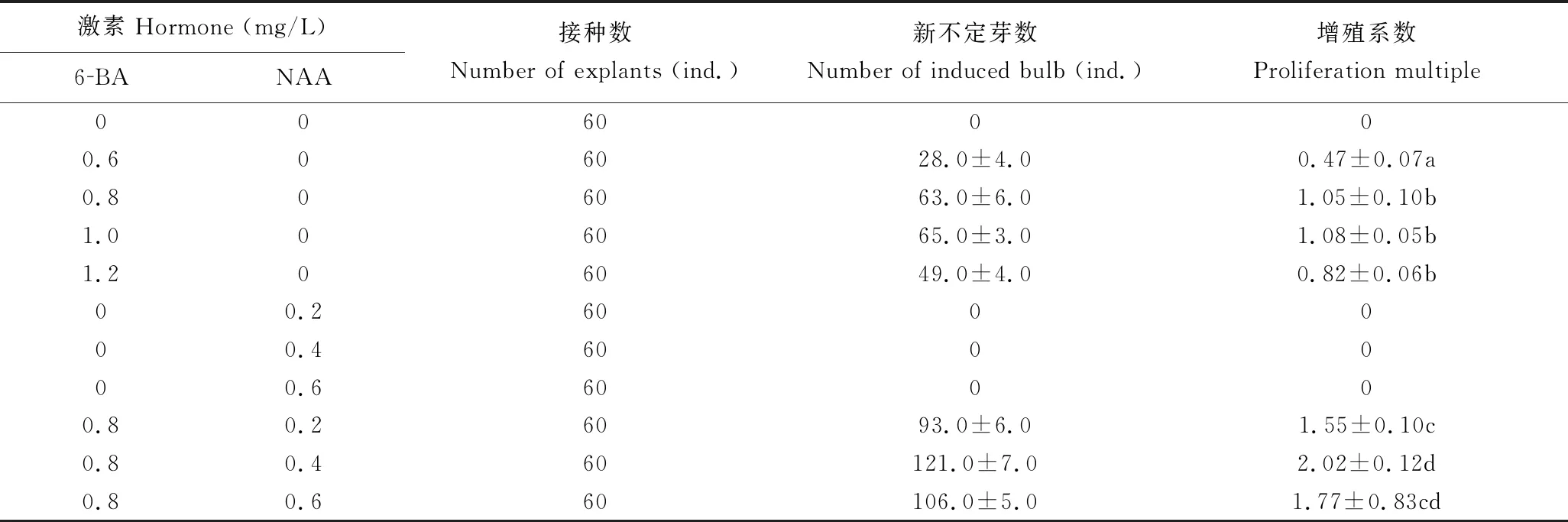
表3 激素(NAA、6-BA)组合对绿桐不定芽增殖的影响
2.4 植物生长调节剂对绿桐不定芽生根的影响
剪取株高3 cm以上且带有4片左右叶片的绿桐小芽转入生根培养基上诱导生根,7 d左右有的小芽基部开始出现白色凸起,然后逐渐成长为根系,15 d后统计生根实验结果。由表4可以看出,不添加任何激素时,绿桐小芽根点出现时间晚,根数量少且长势弱;而在添加植物生长调节剂的培养基上,小苗的生根率都较高。当植物生长调节剂组合为0.6 mg/L NAA+0.2 mg/L IBA,以及0.4 mg/L NAA+0.4 mg/L IBA时,小芽在8-10 d出现根点,但根生长较慢,粗短、丛生,植株生长也较慢;当组合为0.8 mg/L NAA+0.2 mg/L IBA,以及0.8 mg/L NAA+0.4 mg/L IBA时,小芽出现根点需要8-10 d,根生长较快,但基部会有愈伤组织出现,有的根呈海绵状,植株长势旺盛,但不利于后期移栽;当植物生长调节剂组合为0.6 mg/L NAA +0.4 mg/L IBA时,7 d即可观察到大量根长出,培养30 d时生根率可达100%,且根长势均匀、数量多且健壮,根系长满培养基;叶片肥厚,呈深绿色,株高可达10 cm以上(图1b)。以上结果表明,绿桐不定芽生根最适植物生长调节剂为0.6 mg/L NAA+0.4 mg/L IBA。

图1 绿桐组织培养再生及炼苗

表4 IAA或IBA激素浓度对不定芽生根的影响
2.5 炼苗及移栽方式对绿桐无菌苗成活的影响
炼苗及不同的移栽方式对绿桐幼苗成活率有显著影响(表5)。移栽方式①中,绿桐幼苗未经炼苗,且未进行任何保湿措施,绿桐无菌苗成活率较低,只有35%;方式③虽然进行了膜覆盖保湿保温处理,但未进行炼苗,绿桐无菌苗成活率为52%;而移栽方式②先对绿桐幼苗进行自然光炼苗处理后再移苗,并用保湿膜覆盖,以保持幼苗湿度和温度,其存活率可达92%(图1c)。绿桐幼苗生长2个月可高达30 cm,可进行移栽(图1d)。

表5 不同移栽方法对绿桐幼苗存活率的影响
3 讨论
3.1 消毒方式对绿桐外植体消毒效果影响
获得无菌外植体是植物组织培养成功的必要前提,常通过化学药剂如酒精、升汞、次氯酸钠等对植物材料表面进行消毒,不同消毒方式对植物的消毒机理和伤害不同,消毒剂及消毒时间对植物外植体的消毒效果、存活率及出芽率有显著影响[5]。为降低对外植体的伤害且达到消毒目的,通常将消毒剂组合使用。另外,消毒时间过长对外植体的毒害作用较大,会褐化外植体或者直接将其杀死,进而使腋芽无法萌发,无法建立组培体系;若消毒时间过短,则无法获得无菌外植体[19]。田国忠等[12]研究发现,酒精对泡桐外植体伤害较大,消毒剂可以只用0.1%升汞,但污染率偏高。本研究在借鉴前人经验的基础上,对绿桐消毒方式进行研究,结果发现:只是用酒精,消毒效果较差且容易褐化,这与前人研究结果一致[11,18];当使用3种消毒剂组合(先用75%酒精消毒后,再用10%的次氯酸钠与0.1%升汞等体积混合液消毒,最后用0.1%升汞消毒)时,外植体污染率低于40%,且受到的伤害最小,易于腋芽萌发,这与一些文献报道结果类似[14]。
3.2 植物生长调节剂在绿桐组织培养中的作用
植物生长调节剂的组成及浓度对离体组织的诱导、增殖及生根等生长发育起关键作用[20]。其中细胞分裂素可引起细胞分裂并诱导芽的萌发和生长,生长素则促进植物细胞伸长和根系分化。在特定范围内,外植体芽的诱导、增殖及根的分化由细胞分裂素与生长素的种类和浓度决定[21]。本研究发现6-BA对绿桐不定芽产生起到关键作用,不添加6-BA时无法诱导出不定芽,这与一些研究结果类似[5,14]。但单纯的6-BA不利于绿桐芽的诱导分化,诱导率较低,芽生长比较缓慢;而6-BA过高时,虽可诱导产生大量不定芽,但玻璃化严重;本实验在借鉴前人研究[10,13]的基础上,通过额外添加激素GA3,获得最优诱导培养基为MS+1.0 mg/L 6-BA+1.0 mg/L 2,4-D+0.8 mg/L GA3,该培养基配方提高了绿桐出芽诱导率,且芽生长健壮。另外,在生根诱导实验时发现:NAA浓度偏高会导致绿桐组培苗产生大量愈伤组织和畸形根,而过低又会导致生根率偏低、生根慢,且根比较细弱,这与许多报道类似[5,21,22]。在添加NAA的基础上,再添加0.4 mg/L IBA,可使绿桐生根率达100%,且植株更加健壮和整齐,所以绿桐生根诱导培养基为1/2 MS+0.6 mg/L NAA+0.4 mg/L IBA,这与前人报道[5,9]稍有出入,可能是不同基因型和外植体差异造成。
3.3 绿桐组培苗移栽
植物组培苗的炼苗和移栽是快繁体系最后一个核心环节。移栽成活率的高低直接影响组培快繁的生产成本[23]。组培苗不经过炼苗直接进行移栽,由于植株过于幼嫩,移栽后易引起烂根死亡,影响幼苗的成活率[24]。基质的选择、灭菌及移栽后的保温、保湿等措施对苗的成活也起到重要作用。试管苗比较幼嫩,从无菌转入有菌环境生长,如果没有灭菌、保湿等保护性措施就很难抵御外界杂菌的侵染及干燥等复杂环境,容易染菌或干枯死掉,所以移栽前必须做好基质的消毒及移栽后的覆膜保温、保湿等工作[25]。本实验中,先对绿桐组培苗炼苗7 d后再进行移栽,移栽后用地膜覆盖保湿,组培苗成活率可达92%。
4 结论
本研究对绿桐外植体消毒方式、诱导分化及炼苗条件进行实验,结果表明:最佳消毒方式为依次采用75%乙醇、等体积10%次氯酸钠与0.1%升汞混合液、0.1%升汞消毒;选择当年生嫩条顶端10 cm长度的茎段为最佳外植体;外植体在MS+1.0 mg/L 6-BA+1.0 mg/L 2,4-D+0.8 mg/L GA3的培养基中,能诱导出长势健壮的不定芽;在MS+0.8 mg/L 6-BA+0.4 mg/L NAA的增殖培养基中,增殖系数达2.02;而生根以1/2 MS+0.6 mg/L IBA+0.4 mg/L NAA培养基为最佳,生根率可达100%;组培苗炼苗后移栽,再进行覆膜保湿,移栽存活率可达92%。本研究建立了一整套绿桐快速繁殖体系,为后期绿桐组培苗大规模生产打下良好基础。
