右旋糖酐蔗糖酶纯化及生产应用的研究进展
2020-02-06徐欣东王清齐鹏翔黄双霞梁欣泉
徐欣东,王清,齐鹏翔,黄双霞,梁欣泉
(1.广西大学 轻工与食品工程学院,南宁 530004;2.糖业及综合利用教育部工程研究中心,南宁 530004)
在白砂糖的生产中,常常由于受到菌种感染而形成影响糖品质量的“蔗饭”,其本质是具有一定分子量的葡聚糖,又称右旋糖酐(dextran)。充分利用右旋糖酐对糖品深加工及综合利用具有实际产业意义,受到国内外学者的广泛关注。
目前,右旋糖酐的酶法合成主要采用右旋糖酐蔗糖酶(dextransucrase)作为合成酶,其为GH70家族的一种葡萄糖基转移酶,该酶能够以蔗糖为底物,在适宜的条件下聚合生成右旋糖酐[1]。此外,右旋糖酐蔗糖酶还可用于葡萄糖苷的合成,以及借助基因工程、双酶联用等技术实现低聚葡萄糖的合成。酶合成法相较目前工业上普遍采用的菌种发酵法,在产物分离纯化、产物产率、连续生产等方面具有优势。因此,对右旋糖酐蔗糖酶的深入研究将有助于揭示酶的反应机理,提升酶法合成的整体效率。文章综述了右旋糖酐蔗糖酶的反应机理、纯化手段、生产改造及应用等几个方面的研究进展,对右旋糖酐蔗糖酶与其他先进技术的交叉应用及未来发展进行了阐述和展望。
1 右旋糖酐蔗糖酶的反应机理
右旋糖酐蔗糖酶分子由1250~1600个氨基酸组成,其编码基因大致可分为以下4个区域:A区域为信号肽段,B区域为机动可变区,C区域具有结合和切断蔗糖中葡萄糖和果糖分子及转移糖基的功能,D区域具有连接右旋糖酐链的功能。此外,有学者对右旋糖酐蔗糖酶的氨基酸序列进行了定点突变,发现Asp-511和Asp-551的突变完全抑制了合成右旋糖酐和寡糖的活性,表明至少有两个羧基对催化过程至关重要;然而酶结合右旋糖酐链的活性却未因突变而丧失,表明右旋糖酐蔗糖酶具有与其他葡糖基转移酶一样的双结构域结构[2]。右旋糖酐蔗糖酶的三维结构图见图1。

图1 右旋糖酐蔗糖酶的三维结构图Fig.1 Three-dimensional structure drawing of dextransucrase
一般认为,右旋糖酐蔗糖酶催化蔗糖生成右旋糖酐和果糖的反应可分为分离和连接两个步骤[3],见图2。因此其反应机理可大致分为以下几个过程:(1)葡萄糖基的分离,之后形成葡萄糖基-酶复合物,最后转移到右旋糖酐主链或者支链上;(2)果糖释放,这也是测定酶活力的重要依据;(3)右旋糖酐链整条作为支链连接至另一条链上。对于右旋糖酐链聚合反应终止的原因,可能是由右旋糖酐链与其他受体结合或者空间受限引起的。
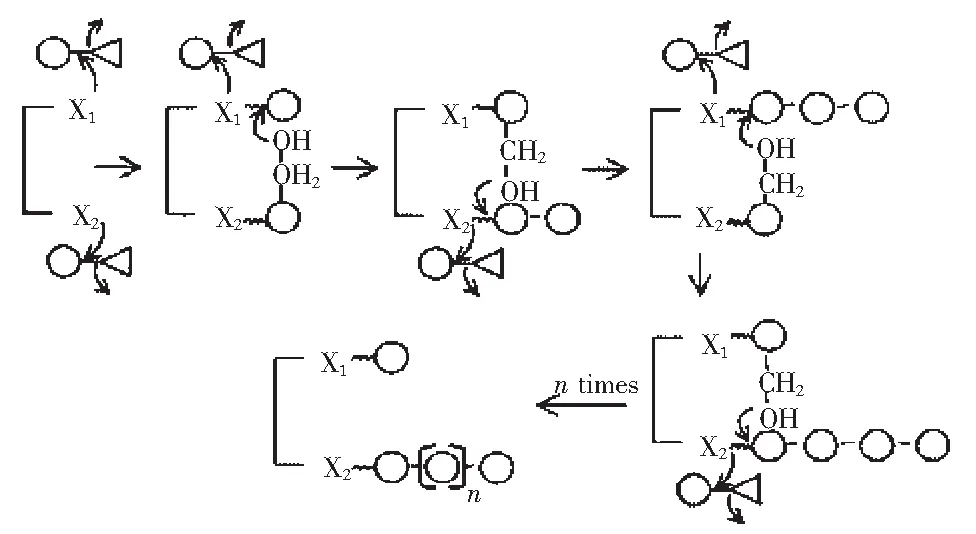
图2 右旋糖酐蔗糖酶合成右旋糖酐的反应机理Fig.2 The reaction mechanism of dextran synthesized by dextransucrase
注:图中○表示葡萄糖,△表示果糖,X1和X2表示右旋糖酐蔗糖酶的亲核部分。
2 右旋糖酐蔗糖酶的酶学性质及纯化
2.1 酶学性质
右旋糖酐蔗糖酶的分子量约为170 kDa,其pI值和米氏常数(Km)通常为4.1和12~16 mmol/L。该酶在纯化后,其最适pH为5.0~5.5,最适温度为30 ℃,其仅能通过分解蔗糖生成右旋糖酐,葡萄糖、蔗糖与葡萄糖的混合物以及其他自然糖都不能作为底物进行生产[4]。在酶的激活方面, Ul-Qader等[5]研究发现当CaCl2的浓度为0.005%时,酶活力提升至108.26 DSU/mL/h,与对照组相比提升了2.03倍;同时也发现添加0.010% CaCl2时,培养液内的总蛋白含量较0.005%时高,但酶活力下降。由此可见,当Ca2+在一定浓度范围内时,Ca2+会优先与酶上的激活位点结合,且激活作用强于抑制作用。
2.2 纯化方法
从肠膜明串珠菌菌种中生产的右旋糖酐蔗糖酶为胞外酶,相比于其他具有相同作用的胞内酶,该酶具有易分离和纯化的优势。此外,右旋糖酐蔗糖酶属于蛋白酶,可根据蛋白质的溶解度、分子大小、带电性质、配体特异性等差异来进行纯化分离,因此在纯化方法上主要有两相分配法、物理过滤法、离子交换法、亲和层析法等。
2.2.1 两相分配法
两相分配法利用两相之间对待分离分子的溶解度差异来实现分离,其实质是待分离分子在两相间达到溶解平衡的过程。Nigam等[6]比较了聚乙二醇PEG6000与PEG400对右旋糖酐蔗糖酶的相分离纯化效果,结果表明PEG6000的三级相分离效果更优,最终回收率为84%,且纯化后的酶比活性及右旋糖酐产率均较高。Paul等[7]采用右旋糖酐和PEG之间的两相分配法对右旋糖酐蔗糖酶进行了纯化,与凝胶过滤及超滤纯化方法相比,两相分配法的酶回收率为95%,比活性大于3500 DSU/mg,均优于两种过滤法。
2.2.2 物理过滤法
物理过滤法主要是通过蛋白质分子大小差异来对酶进行分离,其中常用的方法有透析法、超滤法、分子筛法(凝胶过滤法)等。Baruah等[8]采用基于PEG的离心透析纯化法,该法以物理分离为主要思路,能较好地保留酶的原始性质。Kaboli等[9]在对酶进行固定化前采用超滤与凝胶过滤联用的方法对游离右旋糖酐蔗糖酶进行了纯化,最后得到的酶回收率为54.2%,比活性则为34.3 U/mg。
2.2.3 离子交换法
由于蛋白质带有一定的电荷性质,因此可用电荷性质相反的离子交换剂吸附蛋白质,随后通过调节pH或离子强度的方式使其洗脱,以达到分离纯化的效果。Ghai等[10]在用硫酸铵对粗酶液进行分级沉淀后,将沉淀物溶解并用DEAE-纤维素阴离子交换层析对酶进行纯化,层析后得到3种右旋糖酐蔗糖酶异构体,纯化倍数分别为6.02,5.95,8.55。Guzman等[11]采用固定化酶法对酶进行纯化,首先将右旋糖酐蔗糖酶固定于右旋糖酐链上,经过滤浓缩后再使用右旋糖酐酶对右旋糖酐-酶复合物进行分解,最后用阴离子交换色谱法进行分离,该法使用酶反应产物作为载体来转移目标酶,为基于离子交换法提供了一种新的思路。
2.2.4 亲和层析法
亲和层析法是指利用与待分离蛋白质分子具有特异可逆连接的配体来进行分离纯化的方法,具有较高的特异纯化效果,也可对特定蛋白质进行特异性识别。Miller等[12]使用基于离子交换、亲和层析及与右旋糖酐酶联用的方法来进行纯化,该法的纯化效果较好,并发现存在两种分子量的右旋糖酐蔗糖酶(177,158 kDa),同时研究了两种酶在储藏期间的含量变化关系,为酶纯化后的储存方法提供了参考。Moulis等[13]将右旋糖酐蔗糖酶中dsrS截短片段的重组蛋白与Ni-NTA树脂进行亲和层析,产率为45%,所得的重组dsrS酶具有优良的酶促专一性。
3 右旋糖酐蔗糖酶的生产及改造
3.1 生产优化
3.2 基因改造
随着近些年基因工程的快速发展,出现了采用异源表达法来进行右旋糖酐蔗糖酶改造的研究,这对酶合成的糖苷键、酶活性、产物产率等指标都有重要提升,是目前较为热门的酶改造方法。李秋萍[17]从增强右旋糖酐蔗糖酶的转糖基功能的角度入手,从分子层面对酶进行改造,使突变后的DSR酶具有比原酶更高的转糖基活性。Wang等[18]基于dsrYG基因构建了诱变右旋糖酐蔗糖酶,突变酶所表达的右旋糖酐含有0%~52%的α(1,4)糖苷键,与原酶产物结构有较大差异,该突变酶在合成超支化右旋糖酐方面存在较大潜力。Kang等[19]针对dsrE563基因进行了截短表达,其中发现GBD-CD2重组酶专门负责生成α(1,2)糖苷键,这从基因角度确定了右旋糖酐蔗糖酶上生成支链的活性位点。
得益于基因工程的定点截短及突变能力,可对右旋糖酐蔗糖酶所合成糖苷键的类型、异源表达载体、转糖基功能等方面进行深入研究,这将有助于探索开发支化右旋糖酐等产物。
4 右旋糖酐蔗糖酶的应用
4.1 合成右旋糖酐
右旋糖酐(dextran)是一种由若干分子的葡萄糖经过脱水连接形成的无毒无害的高聚均多糖,其在医药、食品、化妆品等领域有着广泛的应用。其中,高分子量右旋糖酐(Mw>106Da)可作为色谱柱填充剂;中分子量右旋糖酐(105Da 目前工业生产右旋糖酐的主要方式为菌种发酵,但该法存在操作复杂、试剂消耗大等问题。酶法合成具有显著的产物专一性,且右旋糖酐蔗糖酶具有底物特异性,因此该法在产物纯度及提纯难度上均优于发酵法,减少了大量试剂的使用,具有一定的生产优势[22]。Kim等[23]对利用右旋糖酐蔗糖酶合成右旋糖酐作了相关研究,发现当底物中蔗糖含量为4%、温度为25 ℃时,产物中小分子量及高分子量右旋糖酐的占比较高。Goulas等[24,25]构建了右旋糖酐蔗糖酶和右旋糖酐酶的双酶体系,研究发现通过此法可调节右旋糖酐的分子量,且当蔗糖浓度及右旋糖酐酶酶量增大时,产物中低分子量右旋糖酐的产量会上升;此外,其还以双酶体系为基础,制备了一个基于超滤膜技术的膜生物反应,在反应体系中加入两种酶,并将反应液通过切割分子量为10 kDa的超滤膜,将酶进行截留并回流至反应体系中,而产物和果糖等单糖则透过膜进行分离;该法在酶的循环利用和产物-酶分离上具有较好的优势,但还存在膜易堵塞、成本较高等问题。 由此可见,目前右旋糖酐蔗糖酶与右旋糖酐酶联用法可以实现定向制备特定分子量右旋糖酐[26],基于此理论体系,可以再结合膜分离、固定化酶等技术对生产效率及实际可行性进行进一步优化。 低聚糖作为一种新型功能性多糖,广泛应用于食品、保健品、医药等领域,是一种具有良好研究前景的产品[27]。在酶法合成右旋糖酐中,产物分子量普遍在106Da以上,通过双酶联用法或融合酶法可有效降低产物分子量,以实现低聚葡萄糖的合成。Gan等[28]使用右旋糖酐蔗糖酶和右旋糖酐分解酶协同催化的方法制得了分子量为6587 Da的低聚糖,并通过红外光谱及核磁共振表征结果推论该低聚糖由35个α(1,6)糖苷键和1个由α(1,3)糖苷键连接的葡萄糖残基组成,验证了双酶法合成低聚葡萄糖的可行性。Hou等[29]设计了一种基于双酶法的循环超滤膜生物反应器,该装置在0.8 mol/L蔗糖、30 h反应时间的条件下,Mw<104Da的右旋糖酐占比为60.19%,为低聚葡萄糖的批量生产提供了参考。Kim等[30]将两种酶进行融合以应用于低聚葡萄糖的生产,实际研究中发现融合酶法生产低聚糖的产量是同活性下双酶法的30倍。由此可见,低聚葡萄糖可通过工程酶法和双酶法进行合成,如能对低聚糖产物的结构及功能进行表征,则可进一步验证该工艺的生产意义。 由于右旋糖酐蔗糖酶具有转糖基功能,因此有学者以此酶为工具来对特定葡萄糖苷的合成进行研究。Nam等[31]利用来自于肠膜明串珠菌的右旋糖酐蔗糖酶来酶促修饰咖啡酸,经表征后确定合成产物为咖啡酸葡萄糖苷,其相较于咖啡酸,水溶性提升3倍,抗脂质过氧化作用提升1.66倍,抗癌细胞生长作用提升15%,可作为食品或药品的适宜成分。Seo等[32]采用右旋糖酐蔗糖酶酶促合成对苯二酚葡萄糖苷,其得到的产物的抗氧化性及亚硝酸盐清除活性均高于β-熊果苷。由此可见,对于具有酚羟基及醇羟基的部分有机物,可通过右旋糖酐蔗糖酶的转糖基功能来合成相应的葡萄糖苷,而这种糖苷反应对目前多种调味品成分的构建具有重要指导意义[33,34]。 上述研究表明,通过右旋糖酐蔗糖酶催化反应及酶基因改造,可以以蔗糖为原料合成具有更多应用、更高经济价值的右旋糖酐、低聚糖、葡萄糖苷等产物,为蔗糖深加工提供了一条新的路线。从技术强化角度来看,已经能够将右旋糖酐蔗糖酶与基因工程、膜技术等当今热门研究技术相结合,增强或改变右旋糖酐蔗糖酶的特定功能,从而开发出融合酶、酶膜反应器等新产品,进而以此为工具生产更多的高值化物质。 在右旋糖酐蔗糖酶所引发的糖苷化反应方面,目前还缺少糖苷化反应中酶对底物特异性识别的相关机理研究,如能对该方面进行进一步研究,就可从聚合角度对右旋糖酐的改性有更深入的了解,进而实现利用改性单体进行糖苷化聚合形成改性右旋糖酐,以扩展右旋糖酐蔗糖酶的应用潜力。4.2 合成低聚葡萄糖
4.3 合成葡萄糖苷
5 总结与展望
