甲/乙流感病毒感染患儿Th1/Th2相关细胞因子水平变化及临床应用价值
2020-02-05章海峻茅利明陆春琴
章海峻 茅利明* 陆春琴
流感病毒(Influenzaviruses,Flu)是引起全球性流行性感冒的病原体,由流感病毒引起的急性呼吸道传染病,具有较强的传染性,无论是世界范围的大流行还是局限的地区小流行,均对人类健康产生严重的影响[1]。流感的发病机制主要包括机体免疫系统对病毒的免疫应答和肺损伤机制。越来越多的研究表明,细胞因子水平高低与流感免疫应答强弱、疾病的归转及病理损伤有重要的关系[2]。人体抵抗病毒感染主要是以机体细胞免疫为主,而Th1和Th2细胞在介导人体细胞和体液免疫方面发挥重要作用。Th1和Th2细胞失衡常引起疾病发生发展[3]。本文探讨流感病毒感染患儿血清中相关细胞因子水平变化特点及流式细胞微球技术检测相关细胞因子的临床应用价值。
1 资料与方法
1.1 临床资料2017年10月到2018年4月本院因发热、鼻塞、咽痛、流涕头痛、全身乏力酸痛等流感样症状就诊,并经胶体金标记免疫层析技术进行流感病毒抗原检测为阳性的患儿124例为流感组,男76例,女48例;平均年龄(2.73±0.64)岁。经检测分型,甲型流感患儿52例,乙型流感患儿72例。另选取同期本院儿科和体检中心行健康体检且无流感样呼吸道症状及其它疾病86例健康体检幼儿为对照组,男56例,女30例;平均年龄(2.85±0.58)岁。诊断标准参照《流行性感冒诊疗方案》(2018年版)[4]。所有受试对象均同时检测血常规及CRP等感染性指标,两组性别、年龄比较差异无统计学意义(P>0.05),具有可比性。
1.2 方法(1)流感病毒抗原标本采集与检测:标本采集方法以咽喉拭子采样为主,用灭菌拭子从口腔内完全插入咽喉中,以咽后壁、上颚、扁桃体等发红部位为中心以便采集到黏膜表皮,采集标本24h内送检。甲型/乙型流感病毒抗原检测试剂盒由杭州艾博生物医药有限公司提供,检测步骤严格按照说明书。(2)流感病毒抗原试剂盒性能验证:①最小检测灵敏度:本试剂对甲型流感病毒(A2/Aichi/2/68H3N2)的最小检测灵敏度为1.25×103CEID50/每人分检测(egginfectiousdose,EID50,鸡胚半感染数量);对乙型流感病毒(Hongkong5/72)的最小检测灵敏度为0.5×102CEID50/每人分检测;②可检出菌株:甲型流感分别有7个H1N1,5个H3N2,2个H5N1,1个H9N2和1个H7N3亚型,乙型流感有5个亚型,涵盖所有主要的流感病毒亚型;③交叉反应与干扰物质:流感检测试剂与不同浓度的病毒、细菌和真菌行交叉反应,其检测结果均为阴性,庆大霉素、血色素等数十种不同剂量浓度的OTC药物均不会对流感检测产生影响。(3)血常规标本的采集与检测:流感组和对照组均按照标准采血操作静脉采血注入紫色EDTA-K2抗凝管,混匀后2h内上机检测完毕。检测指标为白细胞(WBC)、中性粒细胞(Neu)、淋巴细胞(Lym)、嗜酸性粒细胞(Eos)、血小板(PLT)和C反应蛋白(CRP)等。检测仪器为带CRP功能的迈瑞BC5390全自动血细胞分析仪,仪器、CRP乳胶免疫比浊法试剂盒(鼠单克隆抗CRP抗体)均由深圳迈瑞生物医疗电子股份有限公司提供,日间室内质控均在正常范围内。(4)Th1/Th2的样本处理及检测:仪器为美国BD公司生产的BDFACSCalibur流式细胞分析仪,试剂盒由杭州赛基生物科技有限公司提供的Th1/Th2细胞因子检测试剂盒,项目为Th1分泌的IL-2、IFN-r、TNF-α和Th2分泌的IL-4、IL-6、IL-10。样本处理严格按照Th1/Th2细胞因子检测试剂盒说明书进行操作。
1.3 统计学方法采用SPSS20.0统计学软件。符合正态分布计量资料用(±s)表示,不符合正态分布的用M(Q1,Q3)表示,两组间比较采用Mann-WhitneyU检验,三组间比较采用Kruskal-Wal-lisH检验;计数资料用卡方检验。P<0.05为差异有统计学意义。
2 结果
2.1 流感组和对照组血常规、CRP结果比较见表1。
2.2 三组血清细胞因子检测水平比较见表2。
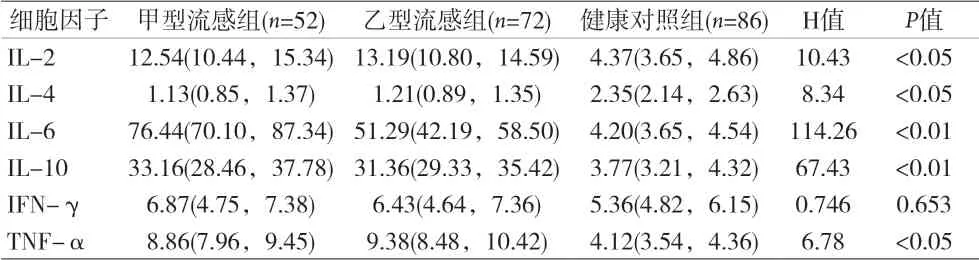
表2 三组血清细胞因子水平比较[ng/L,M(Q1,Q3)]
3 讨论
机体免疫系统对流感病毒感染后所产生的一系列免疫应答及防御措施具有双重性:一方面以Th1/Th2细胞为主的细胞免疫和体液免疫系统通过启动分泌各种细胞因子,通过不同细胞因子生物学抗病毒效应,以及级联放大效应,从而有效控制流感病毒RNA在上皮细胞胞内的复制以及中和胞外病毒的作用;另一方面,肺部炎症细胞的浸润,各种炎性细胞因子的表达及效应产生,造成诸如肺充血、水肿及支气管肺炎样改变等并发症[5]。人体分泌的各种细胞因子是串联起机体宏观和微观生理病理变化的桥梁,是免疫应答和免疫调节等的重要介质。人体内Th1/Th2的平衡是维持机体正常免疫功能的重要因素,Th1/Th2的平衡失调与漂移与疾病的归转密切相关。用流式细胞微球技术能快速准确的检测微观的细胞因子浓度水平,从而能在细胞因子水平对相应疾病进行发病机制的探讨,能对疾病的临床诊断、治疗、研究和防治起重要作用[6]。
本资料显示,与健康对照组比较,流感病毒抗原阳性组血常规中的项目WBC、Eos、Lym、PLT均明显下降,而CRP则明显升高,差异均有统计学意义(P<0.05)。这符合病毒感染性疾病的血象规律,外周血淋巴细胞减少可能是由于淋巴细胞参与病毒灭活引起病毒诱导淋巴细胞凋亡,同时短期内体内病毒超负荷,引起细胞免疫力损伤而降低[7]。此外巨核细胞在病毒感染后破坏增多,以及病毒可能产生循环分子引起血小板粘附聚集也会引起外周血血小板减少[8]。流感病毒感染引起的细胞或体液免疫是由Th细胞通过分泌不同的细胞因子所诱导的[9],人体抗病毒感染一般以Th1细胞为主的细胞免疫起主导作用。本资料显示,与对照组比较,Th1细胞分泌的IL-2和TNF-α均明显升高(P<0.05)。外周血IL-2表达的上调可以促进细胞毒性T细胞(CTL)分化,同时活化NK细胞,以清除流感病毒。此外,IL-2还可以刺激IFN-γ和TNF-α等细胞因子的分泌[10]。Vohra等研究认为,TNF-α等细胞因子对介导炎症反应的发生,调节免疫应答强度起重要作用,其通过激活T细胞,促进IL-2和IL-6的产生和分泌[11]。抗病毒细胞因子IFN-γ能直接抑制病毒复制,由MCH-I类分子表达,活化巨噬细胞,直接杀伤靶细胞[12]。Yu等[13]研究认为,患者处于流感早期IL-2、IFN-γ和TNF-α等细胞因子均有不同程度的上升。而李娟等[6]研究认为,IFN-γ在流行感冒患者发病初期和正常对照组水平无差异性。本资料结果显示,IFN-γ在甲型和乙型流感患儿血清中的水平与对照组比较差异无统计学意义,与李娟等报道结果一致。其机制可能是过高的IL-10水平能造成机体免疫功能的抑制,负反馈抑制IFN-γ的升高,同时使病毒不被免疫系统识别,阻碍病毒清除,导致感染加重[14]。
Th2细胞主要分泌IL-4、IL-6和IL-10、IL-13等,促进抗体产生,介导体液免疫应答[15]。本资料显示,甲/乙型流感感染患儿IL-4在流感组水平明显低于健康对照组(P<0.05)。IL-4是B细胞的激活分化因子,对体液免疫和抗体产生起重要的作用。IL-4在流感组患者降低主要是由于流感病毒抗原容易变异,人体B细胞不能快速产生保护性抗体,只能通过IL-4等细胞因子促进B细胞的增殖和分化,同时免疫平衡逐渐转向以细胞免疫为主,从而消耗IL-4[16]。IL-6和IL-10作为体液免疫的主要细胞因子,在流感患儿组水平明显高于对照组(H为114.26、67.43,P<0.05)。Yu等[13]报道,随着流感病毒的进展,患者体内IL-6和IL-10的表达水平明显上升。IL-6是人体重要的促炎性细胞因子,介导组织炎症反应,调节免疫应答[17];IL-10则是抗炎性细胞因子,主要调节炎症反应强度,诱导T细胞的分化[18]。本资料中,甲/乙型流感患儿组IL-6和IL-10明显高于健康对照组,且甲流组要高于乙流组(P<0.05),这可能与不同流感病毒的致病能力有关。IL-10升高可能是机体自身平衡调节,减轻机体的炎性反应,但过高的IL-10表达,可能会造成机体免疫功能被抑制,妨碍机体流感病毒清除,从而加重病情。LipatovAS等[19]研究认为,由H5N1介导细胞因子失调与其流感病毒的致病能力强弱有关系,高致病的流感病毒更能有效的诱导相应细胞分泌细胞因子。这为流感病毒感染中出现以炎性细胞因子过度表达及功能失调的“细胞因子风暴”提供证据[20]。因感染导致机体产生大量的细胞因子,进入体液,出现系统性整体反应,如急性呼吸窘迫综合征甚至多器官衰竭。细胞因子既有助于免疫系统清除感染,也会对机体造成严重伤害。因此细胞因子过度表达则越来越多的被认为与较差的临床转归和病理损伤密切相关[21]。
