PD-1/PD-L1抑制剂在外周T细胞淋巴瘤治疗中的研究进展
2020-02-04邹立群
骆 倩,邹立群
1.四川大学华西临床医学院,四川 成都 610041;
2.四川大学华西医院肿瘤一科,四川 成都 610041
外周T细胞淋巴瘤(peripheral T-cell lymphoma,PTCL)是一组高度异质性和侵袭性的非霍奇金淋巴瘤(non-Hodgkin’s lymphoma,NHL),其发病率具有明显的地域差异,在中国占NHL的23%~27%,明显高于欧美国家(10%~15%)[1]。中国最常见的PTCL亚型是结外NK/T细胞淋巴瘤(extranodal NK/T-cell lymphoma,ENKTL)鼻型,其次是外周T细胞淋巴瘤非特指型(peripheral T-cell lymphomanot otherwise specified,PTCL-NOS)、间变性大细胞淋巴瘤(anaplastic large cell lymphoma,ALCL)、血管免疫母细胞性T细胞淋巴瘤(angioimmunoblastic T-cell lymphoma,AITL)[2-3]。目前化疗仍是PTCL的主要治疗方式,含蒽环类药物的化疗如CHOP(环磷酰胺+长春新碱+多柔比星+泼尼松)和CHOP样方案是除了ENKTL的所有PTCL亚型常用的一线治疗方案,但是一线治疗普遍反应率低,预后较差。CD30阳性的PTCL采用抗CD30单抗联合化疗取得了一定效果,但是CD30在PTCL不同亚型的表达情况差异较大[4]。因此需要积极探索新药来改善PTCL的整体预后。近年来,肿瘤微环境(tumor microenvironment,TME)在多种肿瘤中的生物学作用被逐渐认识,程序性死亡[蛋白]-1(programmed death-1,PD-1)/程序性死亡[蛋白]配体-1(programmed death ligand-1,PD-L1)信号通路是参与肿瘤免疫逃逸的重要途径之一,针对PD-1/PD-L1免疫检查点的抑制剂在多种肿瘤的临床试验中疗效显著且耐受性良好,美国食品药品监督管理局(Food and Drug Administration,FDA)已批准3种PD-1单克隆抗体[纳武单抗(nivolumab)、派姆单抗(pembrolizumab)和西米单抗(cemiplimab)]以及3种PD-L1单克隆抗体[阿特珠单抗(atezolizumab)、阿维鲁单抗(avelumab)和德瓦鲁单抗(durvalumab)]用于治疗恶性黑色素瘤、非小细胞肺癌、霍奇金淋巴瘤等[5-6]。虽然PD-1/PD-L1通路抑制剂目前暂未被批准用于治疗PTCL,但已有部分临床试验显示出较好的疗效,进一步的临床试验也正在进行。本文就PD-1/PD-L1在PTCL中的表达情况和其抗体的治疗进展作一综述。
1 PD-1/PD-L1信号通路
PD-1属于CD28超家族成员,是一种重要的免疫抑制性受体,主要在T细胞表面表达[7]。PD-1具有PD-L1和PD-L2两种配体,其中PD-1和PD-L1的相互作用在抑制T细胞体内反应中起主导作用。PD-L1在正常组织中广泛表达,主要见于树突状细胞等抗原呈递细胞和胎盘滋养细胞、血管内皮细胞等表面,也在活化的T细胞上表达,当其与T细胞表面的PD-1结合后,可抑制T细胞的激活,是生理性外周免疫耐受的主要机制[8]。但是,PD-1/PD-L1在多种肿瘤细胞及TME中表达上调,通过PD-1/PD-L1通路活化减弱T细胞介导的细胞毒性作用,发生免疫逃逸,促进肿瘤的生长[9]。PD-1/PD-L1通路活化促进肿瘤进展的具体机制正在探索中,已知机制主要有:通过PD-1/PD-L1通路活化阻断磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase,AKT)大鼠肉瘤病毒基因(rat sarcoma virus gene,ras)/丝裂原活化蛋白激酶激酶(mitogen-activated protein kinase,MEK)/细胞外调节蛋白激酶(extracellular signal-regulated kinase,ERK)通路激活,抑制糖代谢和脂肪酸氧化,阻碍白细胞介素-2(interleukin-2,IL-2)产生和分泌等多种方式阻断T细胞活化[10]。此外,PD-L1将幼稚CD4+T细胞转化为诱导性调节T细胞(regulatory T cell,Treg),从而抑制T细胞反应[11]。
2 PD-1/PD-L1在PTCL中的表达
PD-1/PD-L1可在多种人类肿瘤中表达,但在PTCL不同亚型中表达差异较大。PD-L1在有些肿瘤中的表达情况与应用PD-1抑制剂的疗效相关[12-13],在PTCL中仍存在争议。最近几项较大型的临床研究聚焦于PD-1和PD-L1在PTCL不同亚型中的表达情况(表1)。Zaja等[14]分析了173例PTCL肿瘤组织中PD-1和PD-L1的表达情况,发现PD-1在61%的PTCL-NOS及70%的AITL肿瘤组织中表达,且接近一半患者大于50%肿瘤细胞染色,仅在2例ALCL(ALK+)肿瘤组织中表达阳性。而PD-L1在46%的间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)阳性的ALCL和72%的ALCL(ALK-)肿瘤组织中表达,在AITL和PTCLNOS肿瘤组织中不表达。这可能与易位产生的ALCL(ALK+)肿瘤组织中NPM-ALK融合蛋白表达导致依赖STAT3途径的PD-L1表达有关[15]。在最近的一项单中心研究中发现,AITL中PD-1的表达率为84%,PD-L1的表达率为88%,并发现高表达PD-L1预后更差[16]。在一项对135例PTCL罕见亚型的成人T细胞白血病/淋巴瘤(adult T-cell leukemia/lymphoma,ATLL)的大型研究中,肿瘤组织中PD-1阳性率为18.5%,PD-L1阳性率为7.4%,研究人员还根据TME中非恶性基质细胞和肿瘤细胞上PD-L1的表达情况将ATLL分为4个亚组,其中58%的患者在肿瘤细胞中PD-L1表达阴性而在基质细胞中大量表达PD-L1为miPD-L1阳性组,34%的患者在两种细胞中均不表达PD-L1为miPD-L1阴性组,miPD-L1阳性组中位生存时间为18.6个月,明显优于miPD-L1阴性组的10.2个月[17]。这与ATLL肿瘤组织中PD-L1 mRNA的3’非翻译区异常截短导致PD-L1异常表达为阳性有关[18]。
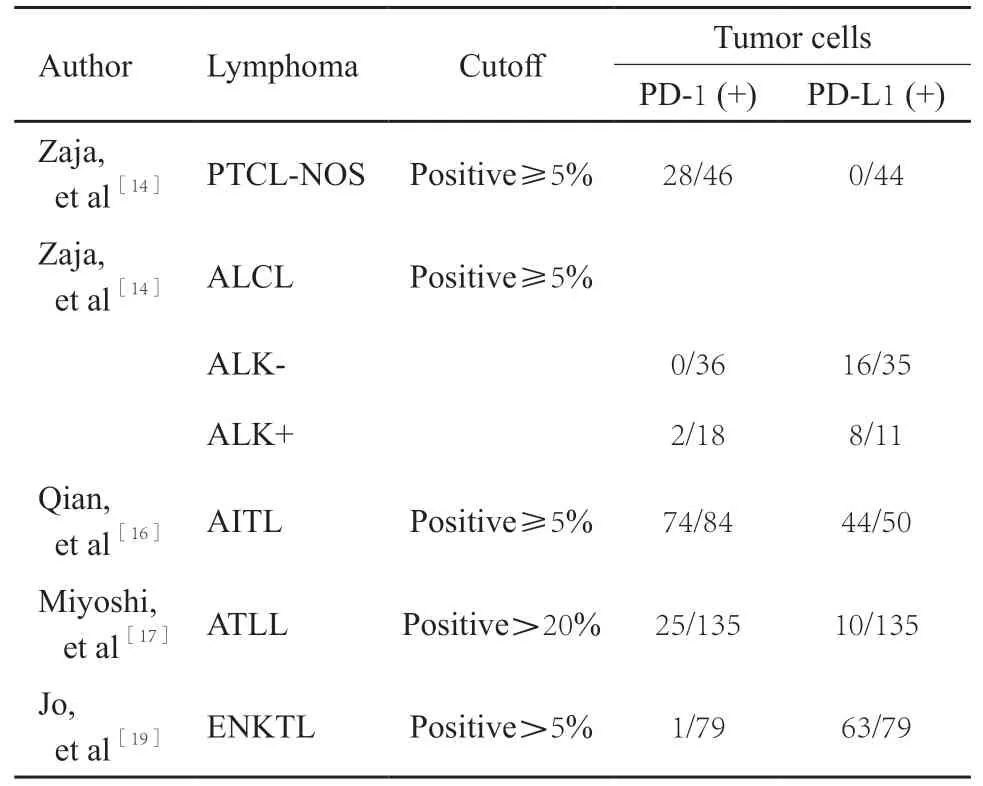
表1 PD-1/PD-L1在PTCL不同亚型中的表达情况Tab.1 The expression of PD-1/PD-L1 in different subtypes of PTCL
Jo等[19]报道,PD-1在79例ENKTL肿瘤细胞及肿瘤浸润淋巴细胞中的表达率分别为1.3%和11.4%,PD-L1表达分别为79.3%和78.1%[19]。这可能与PD-1作为免疫球蛋白超家族的细胞表面受体在T细胞和前体B细胞上表达,而不在NK细胞上表达有关。该研究还发现血清乳酸脱氢酶在正常范围的患者肿瘤细胞PD-L1阳性率更高,与肿瘤细胞和浸润性免疫细胞中PD-L1阴性的患者相比,PD-L1阳性患者有更低的国际预后指数(international prognostic index,IPI)和更好的总体生存趋势。Kim等[20]同样发现PD-L1表达是晚期(Ⅲ/Ⅳ期)ENKTL获得更长的总生存期(overall survival,OS)和5年无进展生存期(progression-free survival,PFS)的唯一独立预后因素。研究发现PD-L1表达与EB病毒(Epstein-Barr virus,EBV)阳性NK/T细胞淋巴瘤(NK/T-cell lymphoma,NKTL)中潜伏膜蛋白-1(latent membrane protein-1,LMP1)表达正相关,可能是由丝裂原活化蛋白激酶(mitogenactivated protein kinase,MAPK)/核因子κB(nuclear factor kappa-B,NF-κB)途径介导;在具有STAT3热点突变的NKTL细胞系中PD-L1过表达与增多的磷酸化STAT3结合PD-L1基因启动子有关[21-22]。PD-L1的表达有两种形式,膜结合型和可溶型(soluble programmed death ligand 1,sPD-L1),近年研究发现血清sPD-L1表达水平在有些恶性肿瘤中与患者免疫抑制和较差的预后有关[23]。在多项NKTL的研究中也发现血清sPD-L1的水平与肿瘤组织中PD-L1的表达正相关,治疗前血清sPD-L1水平与PFS及OS呈负相关,表明sPD-L1表达水平也可以作为NKTL早期复发和预后不良的因素之一[21,24-25],在37例不同亚型的PTCL研究中也发现治疗前血清sPD-L1水平越高预后越差[26]。
3 PD-1抑制剂单药治疗
PD-1/PD-L1抑制剂通过特异性结合PD-1/PD-L1受体,抑制PD-1/PD-L1通路,重新激活T细胞对肿瘤的免疫应答,发挥抗肿瘤作用。美国FDA分别于2016年和2017年批准PD-1抗体纳武单抗和派姆单抗用于治疗复发难治性(relapsed or refratory,R/R)霍奇金淋巴瘤,开启了PD-1单抗在淋巴瘤治疗中的新征程。但关于PD-1单抗治疗PTCL的相关临床试验较少,主要临床研究的结果列于表2。其中,在一项Ⅰ期、开放性、剂量递增的临床研究中,共纳入81例患者(包含5例PTCL,5例其他T细胞淋巴瘤),采用纳武单抗单药治疗,63%的患者发生了药物相关不良反应,主要是1~2级不良反应[27]。在5例PTCL中,2例患者有治疗反应,客观缓解率(objective response rate,ORR)为40%,反应持续时间分别为10.6周和78.6周以上,但在其他5例T细胞淋巴瘤中没有治疗反应[27]。在另一项Ⅱ期临床研究中,共纳入18例患者(包含7例PTCL-NOS和1例ALCL),采用派姆单抗单药治疗,皮疹是最常见的不良反应,发生率为17%,在可评估疗效的患者中,2例PTCL-NOS达到部分缓解(partial response,PR),1例ALCL达到完全缓解(complete response,CR)[28]。在一项病案报告[29]中,3例R/R ALCL患者接受PD-1抑制剂治疗有持续反应,1例是接受干细胞移植后复发的ALCL(ALK-)在经过3个疗程派姆单抗治疗后达CR,另外2例是难治性ALCL(ALK+)患者且PD-L1阳性表达在接受纳武单抗治疗后达CR。然而在一项Ⅱ期临床研究中,3例ATLL患者在接受了一次剂量的纳武单抗治疗后出现疾病的快速进展,后续研究也证实这些患者在PD-1抑制剂治疗后肿瘤快速增长,并揭示了ATLL细胞和肿瘤内调节性T细胞之间的新联系以及PD-1在ATLL中的作用[30-31]。目前多项PD-1单抗单药治疗R/R PTCL的Ⅱ期临床试验正在进行(NCT03021057、NCT03502629、NCT03075553及NCT03493451)中。国产全人源化PD-L1单抗治疗R/R NK/T淋巴瘤的Ⅱ期临床试验也正在进行中(NCT03595657)。
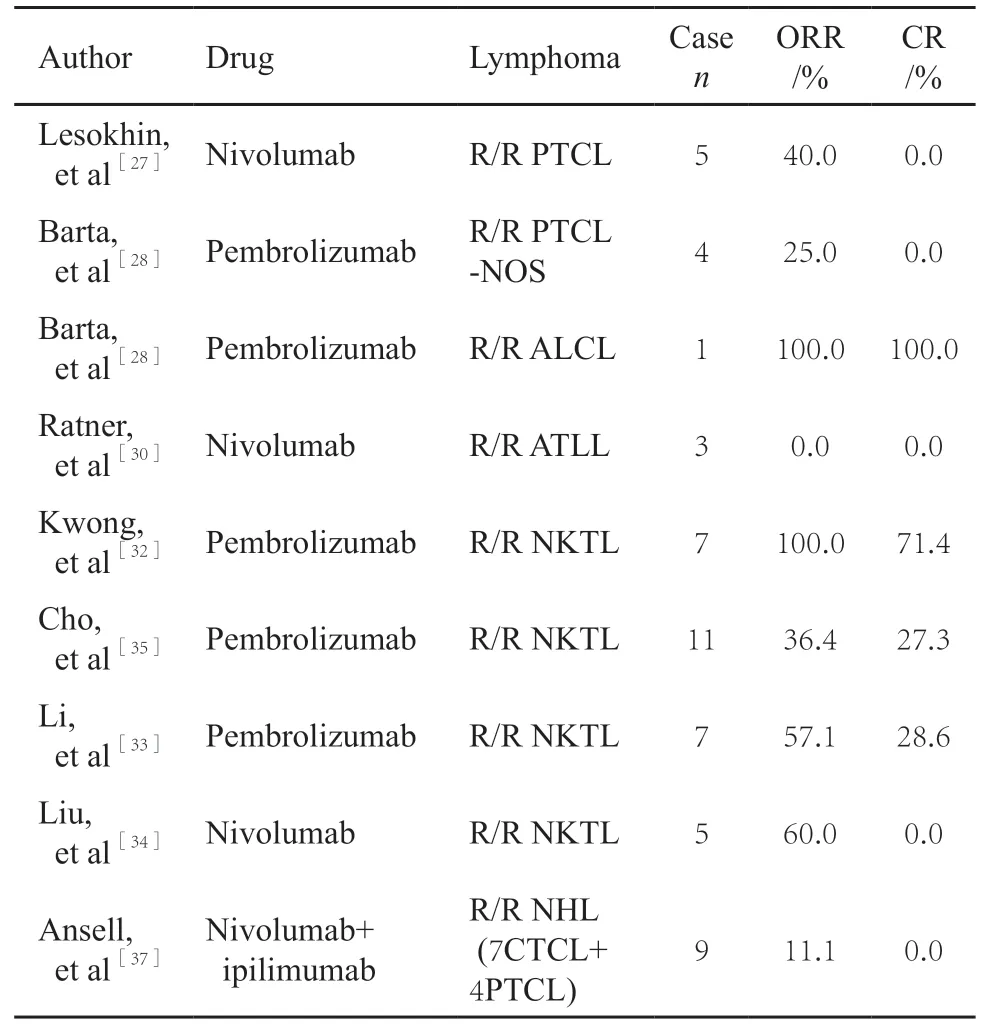
表2 PD-1抑制剂治疗PTCL主要临床研究结果Tab.2 The main clinical results of PD-1 inhibitor therapy for PTCL
PD-1单抗在多个NKTL的Ⅰ/Ⅱ期临床试验和一些回顾性研究中已被证明疗效显著且患者耐受性良好,有较好的应用前景。有研究报道[32],7例NK/T细胞淋巴瘤患者在含门冬酰胺酶方案化疗失败后接受派姆单抗治疗,全部有治疗反应,其中5例患者达到CR,在经历平均7个周期的派姆单抗治疗和6个月的随访后仍处于缓解期,这其中4例患者高表达PD-L1,1例患者表达较弱。在另一项研究中7例R/R NKTL患者接受派姆单抗治疗,2例CR,2例PR,ORR达57%[33]。在用纳武单抗进行治疗的5例ENKTL中,ORR为60%,1例患者出现发热,考虑为药物不良反应[34]。两项采用PD-1单抗治疗R/R NKTL的类似设计Ⅱ期临床试验正在进行中(NCT03363555,NCT03107962)。在最近的一项研究中,使用3种免疫组织化学标志物(FoxP3、PD-L1和CD68)将NKTL分为4个肿瘤免疫微环境亚组,其中免疫耐受组的特点为大量Treg浸润;而免疫逃避组的特点为高细胞毒性T细胞聚集,高PD-L1表达,Treg数量减少;免疫沉默组基本的免疫反应已经耗竭,预后最差。使用派姆单抗治疗后,免疫耐受组的反应率为100%(1/1),免疫逃避组为60%(3/5),免疫沉默组为0%(0/5),为免疫治疗提供了可能的生物标志物[35]。
4 PD-1/PD-L1抑制剂联合治疗
针对PTCL免疫检查点抑制剂的联合用药仍处于探索阶段,已发表的研究结果较少。在一些实体瘤中,PD-1单抗联合人源化靶向溶细胞性T淋巴细胞相关抗原4(cytolytic T lymphocyteassociated antigen-4,CTLA-4)的抑制剂伊匹单抗(ipilimumab)疗效优于单药治疗[36]。在一项I期临床试验中,共纳入65例R/R血液系统恶性肿瘤患者,其中包括了11例T细胞NHL[(7例皮肤T细胞淋巴瘤(cutaneous T-cell lymphoma,CTCL),4例PTCL)],予以纳武单抗联合伊匹单抗治疗,其中3级及以上的药物相关不良事件发生率为29%,总体有效性及安全性与纳武单抗单药治疗相似[37]。在1例病案报告中,84岁的PTCL女性患者在CHOP方案治疗失败后根据二代测序结果选择了MEK抑制剂曲美替尼和内源性白细胞介素-1(interleukin-1,IL-1)受体拮抗剂联合纳武单抗治疗后达到CR[38]。PD-1单抗除了在治疗R/R NKTL中有效,也有研究表明在初治的NKTL中有效。另一例病案报告中,新诊断的老年EBV阴性的ENKTL患者,25%的肿瘤细胞表达PD-L1,使用派姆单抗和同步放疗联合治疗有显著反应且耐受性良好,表明PD-1单抗用于ENKTL一线治疗可能是可行的选择,这为不能耐受传统化疗的老年患者带来了新的希望[39]。
在体外实验和小鼠模型中,多项PD-1/PD-L1联合用药的研究为临床试验指明了方向。Zhang等[40-41]发现对西达苯胺(chidamide)联合传统化疗有治疗反应的PTCL患者血清PD-1表达下降,并进一步在体外实验中证实西达苯胺可以增强PD-1+T细胞直接杀伤肿瘤细胞的效应,西达苯胺利用了PD-1+T细胞免疫介导的抗肿瘤作用,可能与PD-1单抗具有潜在协同作用[40-41]。进一步的临床试验采用PD-1单抗联合西达苯胺、来那度胺和依托泊苷用于PTCL患者的一线治疗和R/R ENKTL的挽救治疗正在进行中(NCT04040491,NCT04038411)。Islam等[42]发现,在PTCL细胞系中,Aurora激酶抑制剂(alisertib)、泛PI3K抑制剂(PF04691502)和长春新碱三药联合有协同抗PTCL效果,主要通过减少PD-L1和NF-κB表达,抑制AKT、ERK磷酸化并增加聚腺苷二磷酸核糖聚合酶裂解的细胞凋亡作用,在小鼠模型中证实单独的PD-L1单抗在PTCL中没有活性,联合alisertib、泛PI3K抑制剂和长春新碱有协同致死作用和更高的总生存率,且小鼠对药物的耐受性良好[42]。在R/R PTCL中进一步探究PD-L1单抗与其他药物联合用药的临床试验正在进行中(NCT03999658、NCT03161223),其结果值得期待。目前针对晚期NKTL采用PD-1单抗联合含门冬酰胺酶化疗方案的临床试验也在进行中(NCT04096690、NCT04004572)。
5 展望
免疫治疗的出现给包括淋巴瘤在内的多种恶性肿瘤治疗带来了显著的变化,但R/R PTCL的预后仍不容乐观,PD-1/PD-L1抑制剂是PTCL的一种有前景的治疗策略。PD-1单抗在NKTL亚型的治疗中已经取得了可喜的成果,但在PTCL的其他亚型中仍未取得较好的疗效。传统淋巴瘤疗效评估主要根据影像学评估肿瘤的大小或用PET/CT评估代谢情况,而免疫治疗是一种新的治疗模式,需要更长的时间表现出生存获益,即“延迟反应”,未来需要更多的前瞻性研究来改进疗效评估标准。另外,应致力于探索能够预测免疫检查点抑制剂疗效的生物标志物,筛选出最有可能从PD-1/PD-L1单抗治疗中获益的人群。此外,PD-1/PD-L1单抗的最佳剂量、给药时间及影响其疗效的其他因素也有待进一步研究。对这些问题的探索能让我们更好地将PD-1/PD-L1单抗应用于PTCL,改善患者的预后。
