黄菖蒲对阿特拉津胁迫的生理响应
2020-02-03夏凡李翠陈传胜王庆海
夏凡,李翠,陈传胜,王庆海,*
1. 北京市农林科学院北京草业与环境研究发展中心,北京 100097 2. 中南林业科技大学环境科学与工程学院,长沙 410004
阿特拉津是一种内吸传导型除草剂,常用于一年生禾本科杂草和阔叶杂草的防除。阿特拉津残留期及应用历史长和使用范围广,导致的环境问题日益突出[1]。我国长江流域、黄河流域和松花江流域等重点流域地表水中阿特拉津的检出率为100%[2],曾为北京重要饮用水水源地的官厅水库,水体阿特拉津的检出量为206 ng·L-1,含量明显高于其他有机氯农药[3]。即使在阿特拉津已禁用的德国,降雨、饮用水、地表水和地下水中仍能检出[4]。阿特拉津通过阻止光系统Ⅱ(PSⅡ)的电子传递,抑制植物的光合作用[5]。因此,水体阿特拉津污染会对水生植物造成胁迫,甚至可能导致敏感植物种类消亡。地表水除草剂污染被认为是继富营养化之后,又一个致使植物种群下降的重要因素[6]。关于除草剂对植物生长和生理特性的影响已有大量研究报道。研究表明,阿特拉津对沉水植物菹草(Potamogetoncrispus)和穗花狐尾藻(Myriophyllumspicatum)的生长具有显著抑制作用[7];阿特拉津显著增加植物叶片中的活性氧(ROS)和丙二醛(MDA)含量,导致植物氧化损伤[8];水葱(Scirpustabernaemontani)在阿特拉津胁迫下,过氧化物酶(POD)活性升高以清除ROS,减轻膜脂过氧化程度;但随着胁迫强度增加,POD不断消耗最终导致其活性下降[9];即使对阿特拉津具有一定耐受性的黄菖蒲(Irispseudacorus),长时间胁迫也会使其光合效率显著下降[10]。长期暴露于阿特拉津的大叶藻(Zosteramarina),即使浓度较低(10 μg·L-1),仍会导致其能量供应减少,碳氮代谢改变[11]。
水生植物暴露于阿特拉津,会调控一系列生理生化过程应对胁迫,其中,防御酶和光合系统的响应尤为重要。植物在逆境条件下光合电子传递过程中光能转化和利用与ROS代谢之间有着密切联系[12]。虽然,目前关于除草剂对植物生理特性的影响已大量研究报道,但较少涉及阿特拉津胁迫下不同防御酶间的协调作用,以及植物光合效率与防御酶活性间的关系。黄菖蒲是多年生挺水植物,在水体污染物去除和生态景观建设中经常用到,且对阿特拉津有较强的耐受性[13]。本试验以黄菖蒲为材料,研究抑菌和无抑菌条件下阿特拉津胁迫对植物光合特性和防御酶活性的影响,分析光合特性与防御酶活性间的相关性,以期阐明植物防御酶在应对胁迫过程中的调控作用,为揭示挺水植物对阿特拉津的耐受机理提供一定的理论依据。
1 材料与方法(Materials and methods)
1.1 试验材料
供试植物黄菖蒲为北京市农林科学院温室育苗盘培养。挑选长势一致的幼苗(单株平均鲜重(4.5±0.8) g),进行水培试验前清洗植物根部泥土,添加1 L 10% Hoagland营养液缓苗1周。将植物移入培养桶(直径30 cm,高26 cm)中,每个桶中放置3株植物,并添加1 L 10% Hoagland营养液。
1.2 试验设计
设置阿特拉津浓度和抑菌2个因素。有关文献报道,阿特拉津在环境中的最大检出量为100~200 μg·L-1[14],为保证本试验各浓度阿特拉津对黄菖蒲保持较高的逆境胁迫,以便快速得到阿特拉津对植物生理毒性的相关数据,按倍数设置相关浓度梯度,依次为0.1、0.5、1、2、4和8 mg·L-1,空白对照组不添加阿特拉津。微生物,特别是细菌,可以通过降解阿特拉津、改善植物根际环境提高植物在逆境条件下的抵御能力,促进植物生长[15-16]。为分析细菌对植物应对阿特拉津胁迫的影响,添加氨苄青霉素(10 mg·L-1)作为抑菌处理,该浓度的氨苄青霉素可有效抑制细菌生长,但对植物生长无明显影响[17];不添加氨苄青霉素作为无抑菌处理。共14个处理,每个处理3次重复,每个重复3株幼苗。所有处理均置于日光温室培养,培养温度21~35 ℃,光强约为自然光强的60%,培养21 d后取样。
1.3 生理指标的测定
胁迫处理21 d后,原位测定叶绿素荧光参数。用便携式光合测定分析仪(LI-6400,Li-COR公司,美国)测定黄菖蒲由外向里第2叶的荧光参数,测定前先将叶片暗适应20 min,照射检测光后测得初始荧光(Fo),照射饱和激发光后测得最大光能转化效率(Fv/Fm)、光化学淬灭系数(qP)、非光化学淬灭系数(qN)和电子传递速率(ETR),每个处理测定9个点。再将植物从营养液中取出,洗净擦干,带回实验室测定生理指标。叶片叶绿素含量的测定采用丙酮浸泡过夜法[18]。防御酶选择植物在应对阿特拉津胁迫过程具有重要作用的超氧化物歧化酶(SOD)、POD和多酚氧化酶(PPO)[19-20],SOD采用氮蓝四唑法,POD采用愈创木酚比色法,PPO用邻苯二酚法,MDA含量采用硫代巴比妥酸法[21]。
1.4 数据统计与分析
采用软件SPSS 22.0统计分析数据,通过多因素方差分析比较各项测试指标差异显著性,显著性水平设置为P<0.05、P<0.01;采用Origin 8.5作图。
2 结果与分析(Results and analysis)
2.1 阿特拉津胁迫对黄菖蒲叶绿素含量的影响
随着阿特拉津胁迫浓度的增加,植物叶绿素含量(图1(a))和叶绿素a/b值(图1(b))均呈现下降趋势,叶绿素含量的降幅大于叶绿素a/b值下降幅度。抑菌条件下,当胁迫浓度≥2 mg·L-1时,叶绿素含量显著下降,降幅超过30%,8 mg·L-1处理组降幅达到68%。与此同时,黄菖蒲表现出长势低矮、叶片枯黄等症状。无抑菌条件下,仅8 mg·L-1处理组叶绿素含量显著下降,各浓度处理组叶绿素a/b值与对照组均无显著差异;而抑菌条件下,最高剂量处理组(8 mg·L-1)显著降低,降幅为37%。

图1 阿特拉津胁迫对黄菖蒲叶绿素含量(a)及叶绿素a/b值(b)的影响注:不同大写字母表示不抑菌条件下各浓度之间差异显著,不同小写字母表示抑菌条件下各浓度之间差异显著(P<0.05);*和**分别表示同一浓度抑菌和无抑菌之间差异显著水平在P<0.05和P<0.01;下同。Fig. 1 Effects of atrazine on chlorophyll content (a) and chlorophyll a/b (b) in Iris pseudacorusNote:Different uppercase and lowercase letters indicate significant differences among treatments with different concentrations under nature and sterile conditions (P<0.05), respectively; * and ** indicate significant differences between nature and sterile conditions at the same treatment concentration at 0.05 and 0.01 levels, respectively; the same below.
2.2 阿特拉津胁迫对黄菖蒲叶绿素荧光参数的影响
不同浓度阿特拉津胁迫下黄菖蒲Fo变化如图2(a)所示。无抑菌条件下,低浓度处理组(≤4 mg·L-1)与对照组无显著性差异,当胁迫浓度达到8 mg·L-1时显著降低,降幅为17%。抑菌条件下,Fo随胁迫浓度的升高呈现先降后升趋势,2 mg·L-1处理组Fo最低,4 mg·L-1和8 mg·L-1处理组又上升。
随着阿特拉津胁迫浓度增大,黄菖蒲的Fv/Fm呈渐降趋势(图2(b)),表现出明显的剂量-效应关系。无抑菌条件下,除最大浓度8 mg·L-1处理组显著降低,其余均与对照组相比无显著性差异。抑菌条件下,0.1 mg·L-1处理组Fv/Fm无显著影响;但当浓度≥0.5 mg·L-1时,Fv/Fm呈现显著下降。
无抑菌条件下各浓度处理组qP差异不显著(图2(c))。抑菌条件下0.1 mg·L-1和0.5 mg·L-1处理组较对照组略上升,但差异不显著;4 mg·L-1和8 mg·L-1处理组qP较对照组分别下降了34%和57%,呈显著性差异。这表明,抑菌和高浓度共同作用对qP影响显著。
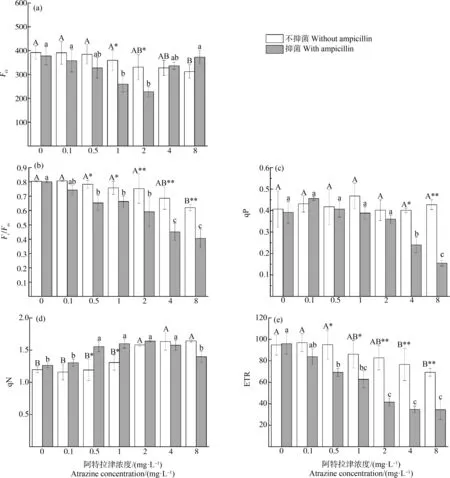
图2 阿特拉津胁迫对黄菖蒲叶绿素荧光参数的影响注:Fo、Fv/Fm、qP、qN和ETR分别表示初始荧光、最大光能转化效率、光化学淬灭系数、非光化学淬灭系数和电子传递速率。Fig. 2 Effects of atrazine on chlorophyll fluorescence parameters of Iris pseudacorusNote: Fo stands for minimal fluorescence; Fv/Fm stands for maximal quantum yield of PSⅡ; qP stands for photochemical quenching; qN stands for non-photochemical quenching; ETR stands for photosynthetic electron transport rate.
阿特拉津对黄菖蒲qN的影响如图2(d)所示。无抑菌条件下qN随阿特拉津浓度的增加而升高,0.1~1 mg·L-1处理组与对照组相比无显著性差异,2~8 mg·L-1处理组较对照组显著增加。抑菌条件下随着阿特拉津浓度的升高,qN呈现先升后降趋势,在2 mg·L-1处理组达到最大值,而4~8 mg·L-1处理组又降低,表明此时植物PSⅡ反应中心结构可能已经受到了破坏。
阿特拉津对黄菖蒲ETR的影响如图2(e)所示。无抑菌条件下,0.1~2 mg·L-1处理组黄菖蒲ETR所受影响不明显,ETR保持在74~94之间;阿特拉津浓度增加至4 mg·L-1,ETR呈现显著降低,4 mg·L-1和8 mg·L-1处理组降幅分别达17%和25%,说明高浓度阿特拉津对黄菖蒲存在一定的抑制作用。抑菌条件下随着阿特拉津浓度的升高,ETR急剧下降。除0.1 mg·L-1处理组与对照组无显著差异外,其余各浓度处理组与对照组均差异显著。
2.3 阿特拉津胁迫对黄菖蒲叶片MDA含量的影响
随着阿特拉津浓度的升高,叶片MDA含量表现出明显的先升再降趋势(图3(a))。无抑菌条件下,胁迫浓度≥0.5 mg·L-1时显著增加,在4 mg·L-1处理组达到最大值,8 mg·L-1处理组略微下降。抑菌条件下各胁迫浓度均显著增加,在2 mg·L-1处理组达到最大值,4 mg·L-1和8 mg·L-1处理组又降低。

图3 阿特拉津胁迫对黄菖蒲丙二醛(MDA)含量和抗氧化酶活性的影响注:SOD表示超氧化物歧化酶,POD表示过氧化物酶,PPO表示多酚氧化酶。Fig. 3 Effects of atrazine on malondialdehyde (MDA) content and antioxidant enzyme activities of Iris pseudacorusNote: SOD stands for superoxide dismutase; POD stands for peroxidase; PPO stands for polyphenol oxidase.
2.4 阿特拉津胁迫对黄菖蒲抗氧化酶活性的影响
无抑菌条件下,黄菖蒲叶片SOD活性随着阿特拉津浓度的增加呈现上升趋势,8 mg·L-1处理组与对照组相比差异显著,其余浓度处理组无显著差异(图3(b))。抑菌条件下SOD活性呈现先升后降趋势,4 mg·L-1处理组SOD活性达最大,是对照组的1.6倍;8 mg·L-1处理组SOD活性略降,但仍与4 mg·L-1处理组处于同一水平。
阿特拉津胁迫下,黄菖蒲叶片POD活性显著增加,随阿特拉津浓度的增加呈现先升后降趋势(图3(c))。无抑菌条件下,0.1 mg·L-1处理组与对照组无显著差异,4 mg·L-1处理组达到最大,是对照组的3.84倍;当阿特拉津浓度为8 mg·L-1时下降,但仍显著高于对照组。抑菌条件下,POD活性在阿特拉津浓度为0.5 mg·L-1时达到峰值,是对照组的2.62倍;随着胁迫浓度进一步增加急剧下降,4 mg·L-1和8 mg·L-1处理组与对照组相比无显著差异,抑菌处理条件下POD活性在胁迫浓度达到4 mg·L-1时已被抑制。
植物叶片PPO活性变化与POD类似,随阿特拉津的浓度的增加先升后降(图3(d))。无抑菌条件下,当浓度达到1 mg·L-1时,PPO活性与对照组开始呈现显著性差异,浓度为4 mg·L-1时最大,8 mg·L-1时下降,但仍显著高于对照组。抑菌条件下阿特拉津浓度为0.1 mg·L-1时,PPO活性已显著高于对照组;当浓度为2 mg·L-1时达到峰值,是对照组的2.03倍,其后PPO活性下降;当浓度为8 mg·L-1时,PPO活性虽高于对照组,但二者差异不显著。
2.5 相关性分析
为了进一步研究抑菌和无抑菌条件下各因素之间的关系,进行相关性分析。由表1可知,无抑菌条件下,MDA含量与叶绿素a/b值、Fv/Fm和ETR呈显著负相关,与qN呈显著正相关。SOD活性与Fv/Fm呈现显著负相关,POD活性与ETR呈显著负相关,PPO活性与叶绿素a/b值、Fv/Fm、qN和ETR呈显著负相关,与MDA含量呈现显著正相关。抑菌条件下,MDA含量与叶绿素含量、叶绿素a/b值、Fv/Fm、qP和ETR呈显著负相关。SOD活性与qN呈现显著正相关,PPO活性与Fo呈显著负相关,与qN呈正相关关系。
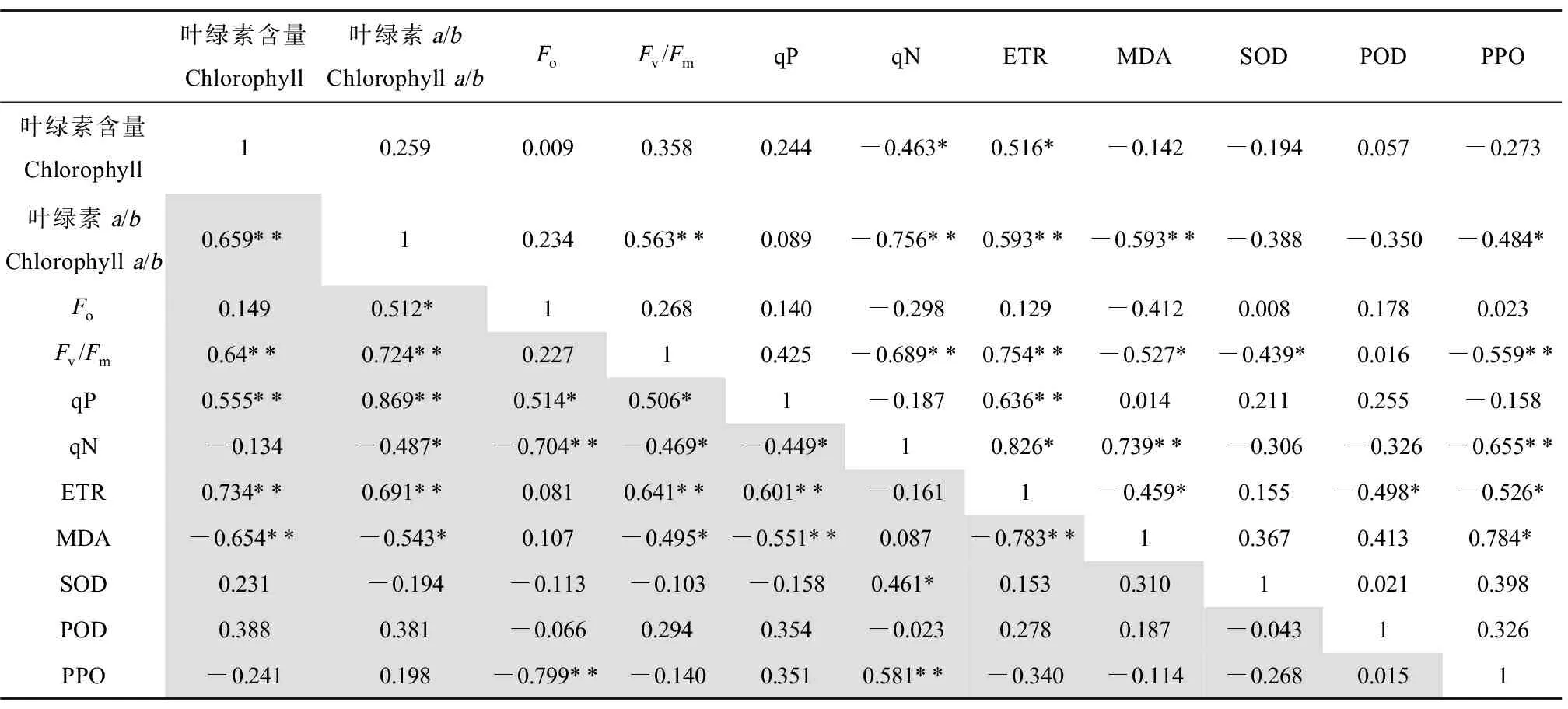
表1 抑菌和无抑菌条件下各指标之间的皮尔森相关系数Table 1 Pearson correlation coefficients for these indicators under nature and sterile conditions
3 讨论(Discussion)
3.1 阿特拉津胁迫对黄菖蒲的毒性效应
随着阿特拉津浓度的增加,叶绿素含量下降,但叶绿素a/b值维持在正常水平。MDA含量升高。王庆海等[22]研究芦苇对阿特拉津的抗逆性时发现,胁迫1周后,0.5、1、2和4 mg·L-1处理组叶绿素a/b值显著降低,而胁迫2周后,各处理组与对照组差异不显著,这表明,在阿特拉津胁迫后期,叶绿素含量降低,植物通过调整叶绿素a/b值提高叶片光合能力,是植物对阿特拉津胁迫的一种适应性保护机制。MDA是胁迫下膜脂过氧化物的最终产物,其含量可以间接反映植物遭受胁迫毒害的程度。植物叶片中MDA积累越多,细胞膜受到的损伤越大[23]。本试验中,MDA含量在无抑菌条件下低浓度(0.1 mg·L-1)处理组与对照组处于同一水平;随着阿特拉津浓度的增加逐渐升高,这表明,阿特拉津对黄菖蒲具有明显的剂量毒性效应,但不同的是,抑菌处理组植物在高浓度胁迫下MDA含量下降,可能此时植物遭受除草剂胁迫已超过其耐受限度,植物衰败死亡。这说明,微生物可以在一定程度上减轻阿特拉津的植物毒性,这可能与微生物能够促进阿特拉津降解有关。
3.2 阿特拉津胁迫对植物光合特性的影响
叶绿素荧光常用于评价光合系统的效能和环境胁迫对光合系统的影响,具有反映植物“最真实内在”的特点[24]。Fo反映PSⅡ天线色素内的最初激子密度、天线色素之间以及天线色素到PSⅡ反应中心的激发能传递机率的结构状态[25]。Fo增加量越多,类囊体膜受损程度越严重[26]。Fv/Fm代表PSⅡ的最大光能转化效率和最大量子产量,非胁迫条件下变化极小,可作为反映受胁迫程度的主要指标[27]。本试验低浓度条件下植物受到的胁迫损伤较小;高浓度胁迫时,无抑菌处理组Fo显著降低,Fv/Fm变化并不明显,植物只是发生了光抑制;而抑菌条件下,Fo亦显著升高,Fv/Fm明显降低,表明阿特拉津诱发了氧化胁迫,此时植物的PSⅡ反应中心结构可能已经受到了损害或失活,也可能是叶片类囊体膜受到损伤。这也进一步表明,微生物可以在一定程度上减轻阿特拉津的植物毒性,植物能维持较高的光化学转化效率。
qP和qN这2个参数可以综合反映叶片对激发能利用的情况[28]。ETR是PSⅡ反应中心在进行光合作用时电子传递的速率,它直接影响光合速率的大小。本试验条件下,阿特拉津胁迫浓度达到4 mg·L-1时,qP变小,qN显著增大,ETR显著下降,表明黄菖蒲PSⅡ反应中心开放部分的比例降低,电子传递能力减弱,用于光合作用的能量减少,光能中用于非光化学反应的能量增加。qN增大表明植物将不能用于光化学电子传递的能量通过热量的形式耗散掉,这也是植物的一种自我保护机制[29]。
3.3 阿特拉津胁迫对防御酶活性的影响
植物暴露于阿特拉津时,会激发SOD、POD和PPO等防御酶活性。本试验浓度范围内,POD和PPO活性随着胁迫浓度的增加先升后降,SOD活性则呈现持续增加趋势,表明POD和PPO对细胞的保护作用存在一个剂量阈值,当胁迫强度大于该阈值时,酶的保护作用减弱。此外,剂量阈值在无抑菌条件下高于抑菌条件,表明微生物可以减轻阿特拉津对黄菖蒲的胁迫,扩大了黄菖蒲对阿特拉津胁迫的耐受范围。当胁迫强度加大至8 mg·L-1时,POD和PPO活性下降,SOD活性显著升高,体现了植物防御酶间的协调作用。
3.4 阿特拉津胁迫下防御酶系统与光合参数的关系
植物暴露于低浓度阿特拉津时,植物体内抗氧化系统启动应对胁迫,POD活性显著增加,可有效清除活性氧和维持植物体内活性氧的正常水平。本研究表明,阿特拉津浓度≤1 mg·L-1时,植物在无抑菌条件下可通过自身的抗氧化系统清除活性氧,调节机体维持正常的光合作用。当胁迫浓度增至2 mg·L-1,PPO活性也显著增加,参与应对胁迫,但qN显著增加,植物的光能利用率下降。当胁迫浓度达到4 mg·L-1时,植物ETR也明显降低,POD和PPO活性达到最大,但Fo和Fv/Fm仍与对照组无显著差异,表明植物仍可维持正常水平的叶绿素浓度和PSⅡ初始光能转化效率。当胁迫浓度达到8 mg·L-1时,SOD活性显著增强,但POD和PPO活性显著下降,植物Fo升高,Fv/Fm、qP和ETR显著降低,表明胁迫已超过植物可承受范围,PSⅡ光化学中心受损或失活。0.1~1 mg·L-1范围内,植物叶绿素荧光参数与对照组无显著差异,而POD活性随胁迫浓度的增加显著升高,SOD和PPO活性变化却并不明显,表明POD活性可作为植物在低强度胁迫下的典型氧化应激指标。由于POD活性在试验浓度范围内先升后降,其与多数叶绿素荧光参数的相关性并不显著。PPO活性与Fo、叶绿素a/b值显著相关,表明其对保护植物叶绿体具有重要作用。PPO活性与Fv/Fm、MDA含量均呈显著负相关,其活性可以表征阿特拉津的胁迫强度。这些相关性体现了植物防御酶在应对阿特拉津胁迫过程中的分工与协作,也反映了植物的调控能力。
逆境胁迫下,植物根据损伤部位及程度,启动调节各抗氧化酶同时或不同时地发挥作用,以缓解氧化伤害[30]。本文仅选取了3种酶,并不能全面反映植物防御酶系统对阿特拉津胁迫的响应特征。为进一步揭示植物防御酶系统对阿特拉津胁迫的响应机制,今后应对典型防御酶活性变化规律进行系统研究。特别是基因敲除技术的应用,为比较评价单一酶参与应对胁迫的作用提供了可能。
综上所述,本研究结果表明,阿特拉津通过与叶绿体类囊体膜上的蛋白质结合阻断电子传递,多余的电子形成活性氧而使叶绿体受毒害,抑制植物光合作用。POD、SOD和PPO活性在不同阿特拉津胁迫强度下的变化,体现了植物防御酶在活性氧清除过程中的协调作用。PPO活性与多个叶绿素荧光参数、MDA含量呈现良好的线性关系,可以作为表征植物光合作用受抑制程度及受氧化损伤程度的指标。阿特拉津浓度≤4 mg·L-1时,黄菖蒲仍能维持正常水平的叶绿素含量和叶绿体光合作用的光化学效率。微生物可能通过降解阿特拉津降低胁迫浓度来缓解阿特拉津对植物的毒害作用。
