苹果树腐烂病菌染色质重塑因子Vmles4的功能研究
2020-02-03杜红霞聂嘉俊冯雅琼刘建英黄丽丽
杜红霞,聂嘉俊,冯雅琼,刘建英,黄丽丽
(西北农林科技大学植物保护学院,旱区作物逆境生物学国家重点实验室,陕西 杨凌 712100)
近年来苹果产业在我国发展迅猛,其种植面积与总产量均位居世界第一,而苹果树腐烂病却严重制约着苹果产业的发展。该病是由Valsamali=Cytosporamali引起的一种真菌性病害,主要危害苹果树枝干,轻则树枝树干枯死,苹果减产,重则造成绝产甚至毁园。因此深入揭示该病原菌的分子致病机理对病害高效防控意义重大。
真核生物的遗传信息通常存储在高度压缩的染色质中,因此,染色质的结构在基因的表达调控中具有重要意义。真核生物在进化中产生的各类染色质重塑因子,利用ATP水解的能量对染色质基本结构核小体进行改装,进而改变染色质结构参与对基因的调控[1]。染色质重塑因子根据功能域划分为SWI/SNF、ISWI、CHD和INO80/SWR1[2]。INO80染色质重塑因子最早在酿酒酵母细胞中发现[3],由15种不同的亚基组成,能调控细胞内多个基因的表达,结合在INO80不同结构域上的不同亚基形成了3个主要的功能区:(1)N端调控功能区:包括亚基les1、les3、les5和Nhp10;(2)HSA功能区:包括亚基Arp4、Arp8和les4;(3)SNF2-ATPase功能区:包括AAA+ATPase(Rvb1和Rvb2)、Arp5、les2和les6亚基[4]。
INO80染色质重塑因子及其亚基参与多种细胞过程且功能多样。如拟南芥INO80缺失突变体植株表现为弱化矮小且重量减少[5];医学方面的研究发现,沉默肺癌细胞INO80、肺癌细胞的形成速率明显下降[6],另外,癌细胞中敲除了INO80后发现部分基因的表达上调或下调[7],而酵母细胞中Nhp10亚基缺失导致INO80对DNA结合活性降低[8],缺失les3基因的酵母细胞端粒伸长并且位置发生改变[1],并且缺失INO80催化亚基或Arp5-Ies6核心亚基的酵母细胞基因组内15%的基因表达受到影响[9]。因此,揭示INO80及其亚基在腐烂病菌致病中的作用具有重要价值。本研究从V.mali全基因组数据[10]中鉴定到一个染色质重塑因子INO80亚基基因Vmles4,利用缺失突变体揭示该基因对病菌营养生长、致病力的影响,同时探索其对致病相关次级代谢合成酶基因VmNRPS12和VmNRPS14的影响,这将有助于进一步揭示染色质重塑因子在腐烂病菌致病中的功能。
1 材料和方法
1.1 材料与试剂
1.1.1 菌种来源 苹果树腐烂病菌(Valsamali=Cytosporamali)野生型分离菌株03-8,由西北农林科技大学植物保护学院果树病害病原生物学及综合防治研究团队的研究室分离并保存;pFL2质粒(含有Trp合成基因neo,G418抗性),由西北农林科技大学许金荣教授惠赠。
1.1.2 致病性测定材料 苹果树叶片和枝条均为采自杨凌美庭快乐农场的富士品种,叶片为表面平整的初夏叶片,枝条为粗细均匀的1~2 a生枝条。
1.1.3 主要试剂 P505高保真酶(Phanta Max Super-Fidelity DNA Polymerase,诺维赞)、DNA胶回收试剂盒(Gel Extraction Kit D2500,OMEGA)、崩溃酶(Driselase,Sigma)、裂解酶(Lysing enzyme,Sigma)、Taq DNA聚合酶、定量Mix(Genstar)、G418(MP)、华越洋核酸提取试剂盒、反转录试剂盒(Thermo)及其他实验室常规化学药品和试剂,试验中所需引物均委托上海生工生物工程股份有限公司进行合成。实验用到的引物序列见表1。
表1 本实验所用引物
1.2 实验方法
1.2.1Vmles4的侵染表达模式分析 将活化好的野生型菌株03-8的菌饼接种于健康的离体富士枝条上,取6、12、24、48、72 h 5个时间点的病健交界处皮层组织样品,以纯培养72 h的菌丝组织为对照,按照核酸提取试剂盒(华越洋)和反转录试剂盒(Thermo)说明书操作进行总RNA的提取并合成cDNA,反转录引物采用Oligod(T)18,以G6PDH为内参基因,用2-ΔΔCt法计算Vmles4相对表达量,每个反应3次平行重复,试验重复3次后取均值。
1.2.2 突变体的获得 基于本实验室前期的病菌全基因组测序分析结果得到目的基因序列,用Premier5.0软件设计定量引物qRT-F/qRT-R,上游引物1F/2R,下游引物3F/4R,巢氏引物CF/CR,检测引物5F/6R。其中引物2R和3F的5′端带有同G418两端同源的序列(斜体序列)。以苹果树腐烂病菌的基因组DNA(1 402 ng·μl-1)为模板,扩增目的基因的上下游片段,以pFL2质粒为模板,扩增neo基因片段,回收各个扩增片段,用Double-joint PCR三步法构建基因敲除载体,用PEG介导法将敲除载体导入原生质体中,含有200 μg·mL-1G418抗生素的PDA培养基培养皿筛选转化子,提取其DNA,4对引物PCR检测后得到3个阳性突变体,将其保存在20%的甘油中并于-20 ℃冰箱保存。
1.2.3 表型分析 活化好的野生型03-8及突变体菌株,用打孔器(d=5 mm)在菌落边缘打菌饼,接种在含有12 ml PDA培养基的培养皿中央,25℃黑暗培养48 h后,观察菌落的生长情况并用十字交叉法测量菌落的直径,每组设置3个重复,试验重复3次后取均值。
1.2.4 致病力测定 离体叶片接种参照韦洁玲等[11]的方法。叶片用自来水冲洗干净后,用0.6%的次氯酸钠(NaClO)溶液消毒5 min,用灭菌ddH2O水冲洗3次,每次5 min,一次性1 ml注射器针头刺伤叶片正面制造伤口,用直径为5 mm的打孔器在活化好的菌落边缘打孔制成菌饼,再将菌饼接种在叶片正面的伤口上,以PDA为空白对照,灭菌的脱脂棉蘸缠于叶柄防止水分的散失,叶片置于托盘内25℃保湿培养,3~4 d后用十字交叉法测量叶片病斑的大小,每个菌株设置5个重复,试验重复3次后取均值。离体枝条接种参照臧睿等[12]的方法。将枝条剪成10 cm左右的小段,自来水冲洗干净,0.6%的次氯酸钠溶液进行表面消毒15 min,用灭菌ddH2O水冲洗3次,待其晾干,融化的石蜡将枝条两端封口,打孔器(d=5 mm)在枝条上破坏其韧皮组织打孔制造伤口,用打孔器(d=5 mm)将活化好的野生型及突变体菌株打菌饼,菌饼接种在枝条制造的伤口上,野生型菌株作为阳性对照,25 ℃保湿培养,7 d后测量并记录枝条病斑纵向扩展长度,每个菌株设置6个重复,试验重复3次后取均值。
1.2.5VmNRPS12及VmNRPS14表达量 参照1.2.1小节的方法枝条接种野生型03-8与突变体菌株ΔVmles4,取接种后24 h的树皮组织(以纯培养菌丝体为对照),提取RNA并合成cDNA,qRT-PCR检测NRPS12及NRPS14基因的相对表达量,试验重复3次后取均值。
2 结果与分析
2.1 侵染期Vmles4的表达分析
运用qRT-PCR技术分析Vmles4在不同时间的相对表达水平,结果如图1,Vmles4在病菌接种6 h显著上调表达,上调达6.2倍。说明该基因在苹果树腐烂病菌侵染前期发挥重要作用并且可能参与致病过程。

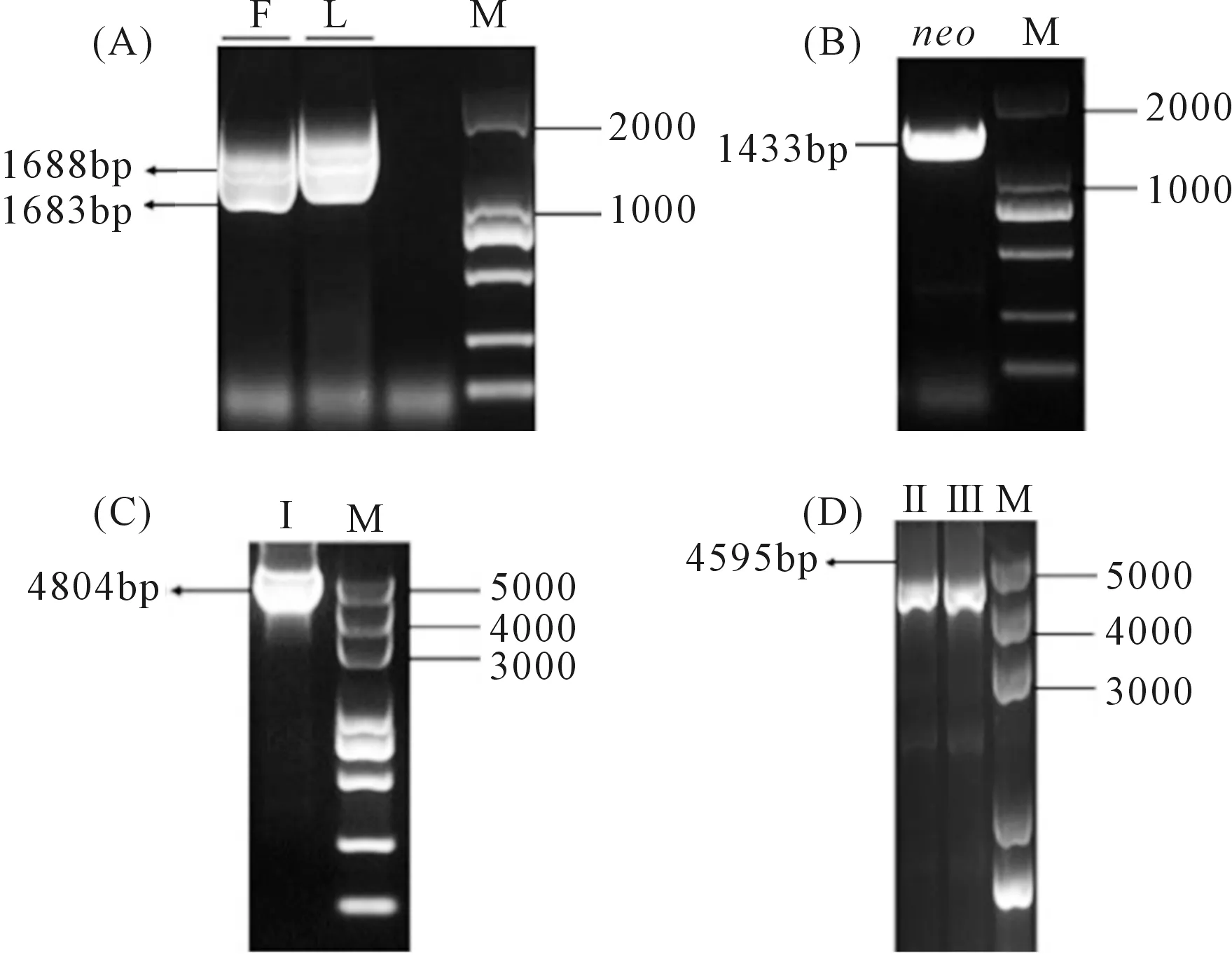
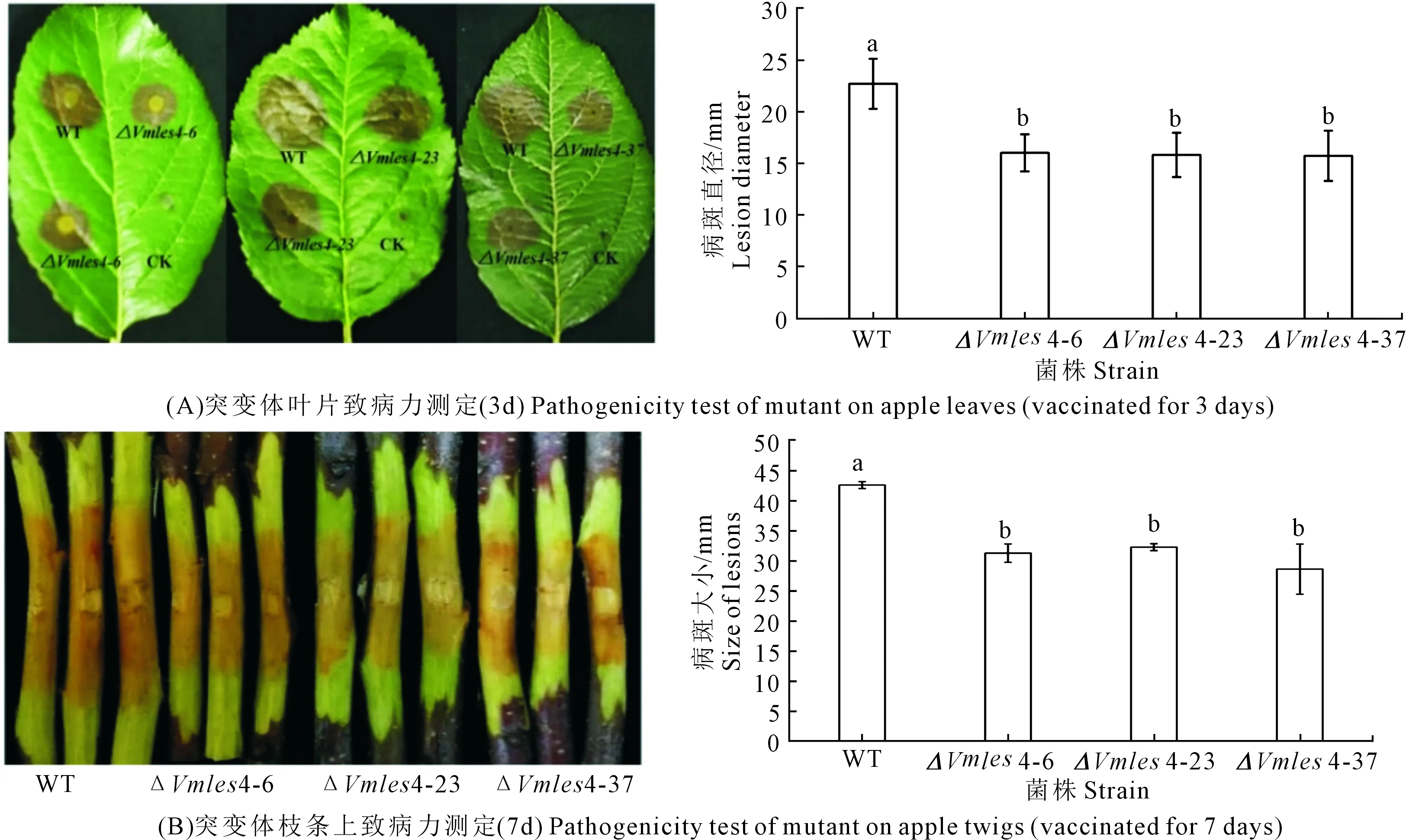
注:试验重复3次,取平均值。利用SPSS 23.0分析差异显著性。*表示显著性差异(0.01 Vmles4上下游片段的扩增,片段大小分别为1683 bp和1688 bp(见图2A);抗性基因neo片段扩增片段大小为1433 bp(图2B);Double-joint PCR融合上游、下游和neo片段,片段大小为4804 bp(图2C);CF/CR巢式PCR构建敲除载体,片段大小为4595 bp(图2D);PEG介导的原生质转化方法得到转化子,用4对引物检测后得到3个基因缺失突变体(图3)。 注:(A):Vmles4上下游片段扩增; F:目标上游片段; L:目标下游片段; M:DL2000 marker;(B):neo基因扩增 M:DL2000 marker;(C)-(D):构建敲除载体 Ⅰ:Double-joint PCR融合基因片段; Ⅱ and Ⅲ:巢式PCR片段; M:DL5000。Note: (A):Amplification of upstream and downstream of Vmles4; F:target upstream; L:target downstream; M:DL2000 marker; (B):Amplification of neo cassette; M:DL2000 marker;(C)-(D):Construction of the knockout vector; Ⅰ:fusion fragment of double-joint PCR; Ⅱ and Ⅲ:nested PCR fragment; M:DL5000. 1:目的基因 The target gene;2:neo基因 neo cassette;3:上游片段 Upstream region;4:下游片段 Downstream region;5:阴性对照 Negative control;6:阳性对照 Positive control;M:DL2000 marker 在PDA培养基上生长48 h后,与野生型菌株03-8相比,Vmles4突变体菌落较白、菌丝较稀少,生长速率平均下降达28%,且生长不规则(图4)。表明Vmles4基因影响菌落的形态和生长速率。 注:试验重复3次,取平均值。利用SPSS23.0在P=0.05水平上分析差异显著性。不同小写字母表示两者间存在显著差异。下同。Note: The expriment was repeated three times and the mean value was taken. SPSS23.0 was used to analyze the difference at 0.05 level. Different lowcase letters indicate significant differences between the two strains. The same below. 与野生型03-8相比,Vmles4缺失突变体分别在离体叶片上病斑直径平均下降22.5%,在枝条上病斑长度平均下降27%(图5)。表明Vmles4基因的缺失使病原菌在叶片和枝条上的致病力下降。 图5 野生型菌株03-8及突变体ΔVmles4的致病力测定及分析 VmNRPS12和VmNRPS14基因在野生型03-8及ΔVmles4菌株侵染树皮24 h的qRT-PCR结果显示(图6),VmNRPS12和VmNRPS14在ΔVmles4菌株中的相对表达量均显著低于野生型,分别下调86.5%和50%(图6)。表明Vmles4正调控了基因VmNRPS12和VmNRPS14的表达。 图6 VmNRPS12和VmNRPS14基因在野生型03-8和突变体ΔVmles4侵染枝条24 h的相对表达量 本研究就苹果树腐烂病菌染色质重塑因子INO80亚基Vmles4基因在V.mali中的功能进行了初步探究。Vmles4在接种离体苹果树枝条6 h后的相对表达量显著上调;有文献报道,真菌中一些起作用的致病基因在侵染初期会出现上调表达的情况[13],这与本研究对侵染期Vmles4表达模式分析结果相符,说明Vmles4是一类毒性基因,可能参与致病。与野生型03-8比较,3个敲除突变体的生长速率及其在叶片和枝条上的致病力均显著下降,说明Vmles4基因确实参与了致病。对拟南芥染色质重塑因子核心亚基的研究发现,其参与了多种发育过程[14],且缺失INO80基因后,植株生长受到限制;INO80重塑因子的N端调控域与HAS功能区Arp4 Arp8 les4亚基结合后,改变亚基Arp8的构象,构象改变后的Arp8与核小体上的组蛋白结合紧紧抓住核小体,随后亚基Arp5-les6将SNF2-ATPase功能区Rvb蛋白亚基募集过来[15],Rvb1和Rvb2亚基具有螺旋酶的活性[16],Rvb1和Rvb2与其他的亚基结合后,在超螺旋位置与核小体上的DNA结合,打开碱基,并阻止组蛋白H2A与DNA的接触[17],将核小体上的DNA暴露出来,便于转录因子和RNA聚合酶等结合;INO80亚基间通过以上方式共同合作重塑染色质,来调控基因的表达。 本研究对致病基因VmNRPS12[17]及NRPS类相关基因VmNRPS14在INO80亚基Vmles4突变体中的相对表达量进行定量PCR,结果发现其表达能力显著下降。酵母和Hela细胞INO80亚基缺失后,基因组内基因也出现上调或者下调表达的现象,与本研究中Vmles4缺失后,VmNRPS12和VmNRPS14基因的表达量出现下降相符。本研究中位于HAS功能区的亚基Vmles4基因缺失后,病菌的致病力显著下降。有文献报道,HAS功能区与核小体组蛋白及DNA的结合有关[18],Vmles4导致致病性下降的原因可能是Vmles4缺失后,致病基因的转录因子等无法与DNA结合,使得致病基因的表达下降,无法发挥毒性功能最终导致了致病力的降低。本研究只是初步探究了染色质重塑因子INO80亚基Vmles4基因的毒性功能及其对VmNRPS12及VmNRPS14表达的调控功能,然而苹果树腐烂病的致病是一个复杂的过程,INO80染色质重塑因子作为一类由多亚基组成的保守调控因子,各个亚基之间到底以怎样的相互作用来影响V.mali的致病和调控能力将会是一个新的研究方向。2.2 敲除突变体的获得

2.3 突变体的表型观察

2.4 突变体致病力的测定
2.5 ΔVmles4对VmNRPS12及VmNRPS14表达量的影响

3 结论与讨论
