基于iTRAQ技术的桉树对桉树枝瘿姬小蜂抗性蛋白质组学分析
2020-02-02王怡冯丽贞张清华陈全助吴晖
王怡 冯丽贞 张清华 陈全助 吴晖
摘要 为了利用iTRAQ技术研究受桉树枝瘿姬小蜂危害后桉树叶片的差异蛋白,选择被姬小蜂危害后第24 h的桉树叶,采用iTRAQ定量蛋白质组学技术开展研究,在uniprot_Quercus中共鉴定到蛋白质1 687个。按照表达倍数变化1.2倍以上(上调大于1.2倍或者下调小于0.83倍)且P<0.05的标准筛选差异表达蛋白质。其中,C_vs_T组的上调差异表达蛋白质有110个,下调差异表达蛋白质92个。经过KEGG富集分析,筛选出的差异表达蛋白质富集于苯丙烷生物合成(phenylpropanoid biosynthesis)、核糖体(ribosome)、单菌素生物合成(monobactam biosynthesis)、有机含硒化合物代谢(selenocompound metabolism)、丙酮酸盐代谢(pyruvate metabolism)、脂肪酸延长代谢(fatty acid elongation)、丙酸代谢(propanoate metabolism)7条通路。
关键词 桉树枝瘿姬小蜂;蛋白质组学;iTRAQ
中图分类号 S 763.43文献标识码 A文章编号 0517-6611(2020)01-0154-03
doi:10.3969/j.issn.0517-6611.2020.01.046
开放科学(资源服务)标识码(OSID):
Proteomics Analysis of Resistance of Eucalyptus to Leptocybe invasa Based on iTRAQ Technique
WANG Yi, FENG Li zhen, ZHANG Qing hua et al
(ForestryCollege, Fujian Agriculture and Forestry University,Fuzhou, Fujian 350002)
Abstract In order to explore serum differential proteins in Eucalyptus leaves after Leptocybe invasa infestation using iTRAQ technology.Eucalyptus leaves of 24 h after being harmed by Leptocybe invasa were selected,and the iTRAQ quantitative proteomics technique was used to study the subject.A total of 1 687 proteins were identified in uniprot_Quercus.The differentially expressed proteins were screened according to the standard of expression fold change of 1.2 times or more (upregulation of more than 1.2 times or down-regulation of less than 0.83 times)and P< 0.05.Among them,there were 110 differentially expressed proteins in the C_vs_T group and 92 differentially expressed proteins.After KEGG enrichment analysis,the differentially expressed proteins were enriched in seven pathways:Phenylpropanoid biosynthesis, Ribosome,Monobactam biosynthesis,Selenocompound metabolism, Pyruvate metabolism, Fatty acid elongation, and Propanoate metabolism.
Key words Leptocybe invasa Fisher et La Salle;Proteomics;iTRAQ
桉树(Eucalyptus robusta Smith)是终年常绿植物,为姚金娘桉属。桉树有900多个品种,原产地大多在大洋洲,少数品种原产于东南亚[1]。桉树易培育栽种,四季常青,具有药用、医用价值[2],生长速度超过了大多数阔叶林[3],19世纪时被引种到世界各地[4]。桉树是在1890年由意大利引入,起初我国境内种植不多,直到1984年,我国与澳大利亚进行桉树引种与栽培合作,先后从澳大利亚引进184个桉树树种,自此我国开始大规模培育桉树林[5]。到2017年,我国种植桉树总面积达450万hm2,木材年产量超过3 000万m3,接近全国木材产量的30%[2]。
桉树枝瘿姬小蜂(Leptocybe invasa)属膜翅目(Hymenoptera)姬小蜂科(Eulophidae)姬小蜂属(Leptocybe),是危害桉树的重要害虫[6-7]。桉树枝瘿姬小蜂在桉树的嫩枝、梢头、嫩芽、叶片、叶柄、叶脉等处产卵[8],受害桉树产卵处畸形肿大,有些桉树无性系在姬小蜂產卵部位会形成虫瘿[9]。桉树遭受危害后顶梢生长受阻,枝叶萎缩,树形逐渐成丛生状[10]。1年生及以下桉树林受危害最严重,受害后木材产量大量减少。
长期以来,对桉树抗性的研究备受关注,主要集中在桉树抗性、被姬小蜂感染后体内次生物质变化方面,但对于姬小蜂危害诱导防御蛋白少有研究。
笔者利用同位素标记相对和绝对定量(isobaric tags for relative and absolute quantification,iTRAQ)技术对姬小蜂危害桉树酶活最大的阶段进行差异蛋白质组学研究[11],应用生物信息学分析手段,分析桉树被危害前后的差异蛋白,揭示桉树被危害时桉树响应的相关代谢途径,探究姬小蜂诱导桉树形成虫瘿的机制,对姬小蜂进行有效的控制以及有利于后续培育优质桉树无性系。
1 材料与方法
1.1 试验材料
试验桉树抗虫无性系DH32-29:2017年10月,在漳州长泰岩溪林场,对桉树无性系DH32-29上10~15 cm并有2对绿叶的半木质化萌芽条进行采穗,同时将叶片剪去1/2。将土质疏松且不含草根等杂质的黄心土装在9 cm×11 cm的无纺布育苗袋中。扦插前将泥袋完全淋湿,然后浇上0.3%的高锰酸钾溶液进行消毒。在扦插前将穗条基部蘸上生根粉,垂直插入育苗袋中,插入深度为2~3 cm,再次淋透泥土,用网纱隔离穗条。把育苗袋置于遮阴处,每天适当淋水。30 d生根后则移至光照充足处,同时去除已死植株,并适当增加淋水量。待桉树苗根茎木质化,叶片浓绿,根系发达后移出育苗袋,移栽于直径20 cm的花盆。
试验虫源:2018年3—4月于桉树枝瘿姬小蜂羽化期,剪去被小蜂危害有较多虫瘿的枝条,枝条断口处包有湿棉花,把枝条分别放入8个养虫笼中,每日保持基部湿润,用昆虫采集管采集每日羽化的桉树枝瘿姬小蜂。
样品采集:试验分为2组,每组桉树各20盆,一组对照组未被桉树枝瘿姬小蜂危害,一组试验组已被桉树枝瘿姬小蜂危害,取样时间分别为危害后24 h。每次在姬小蜂危害的样株上戴一次性手套随机取叶片,每棵树取一片叶子,同时在未受姬小蜂危害的桉树相同高度与角度上取叶片。把采集的样品放入密封袋中,排尽袋内所有空气,把密封袋封好,立即在密封袋上贴上标签,再迅速置于液氮中,冷冻3~5 min,取出后转移至实验室-80 ℃冰箱中,以备后续试验使用。試验做3个重复。把6个样品标记为C1、C2、C3、T1、T2、T3。其中C1、C2、C3为未被姬小蜂危害的桉树DH-3229叶片样本,T1、T2、T3为已被被姬小蜂危害的桉树DH-3229叶片样本。
1.2 试验方法
1.2.1 样品制备。
采用TCA/丙酮沉淀+SDT裂解法提取蛋白质,然后进行样品蛋白定量[11]。定量后进行SDS-PAGE电泳,各样品取蛋白质20 μg分别加入5×上样缓冲液,沸水浴5 min,进行12.5%SDS-PAGE电泳[12](恒流14 mA,90 min),考马斯亮蓝染色。用FASP的方法进行酶解[13]。各样品分别取100 μg肽段,按照AB SCIEX公司iTRAQ标记试剂盒说明书进行标记。
1.2.2 LC-MS/MS数据采集。
标记后,将每组的肽段混合,并使用AKTA Purifier 100进行分级[14]。每份分级样品采用纳升流速的HPLC液相系统Easy nLC进行分离。缓冲液A液为0.1%甲酸水溶液,B液为0.1%甲酸乙腈水溶液(乙腈为84%)。色谱柱以95%的A液平衡,样品由自动进样器上样到上样柱(Thermo Scientific Acclaim PepMap100,100 μm×2 cm,nanoViper C18),经过分析柱(Thermo scientific EASY column,10 cm,ID 75 μm,3 μm,C18-A2)分离,流速为300 nL/min[15]。
将样品进行色谱分离,并使用Q-Exactive质谱仪进行质谱分析。检测方式为正离子,母离子扫描范围300~1 800 m/z,一级质谱分辨率为70,000 at 200 m/z,AGC(Automatic gain control)target为1e6,Maximum IT为50 ms,动态排除时间(Dynamic exclusion)为60.0 s[16]。按下述方法采集多肽和多肽碎片的质量电荷比:每次全扫描(full scan)后采集20个碎片图谱(MS2 scan),MS2 Activation Type为HCD,Isolation window为2 m/z,二级质谱分辨率17,500 at 200 m/z,Normalized Collision Energy为30 eV,Underfill为0.1%。
1.2.3 KEGG通路注释。
利用KAAS (KEGG Automatic Annotation Server)软件,对目标蛋白质集合进行KEGG通路注释。
2 结果与分析
2.1 蛋白质检测
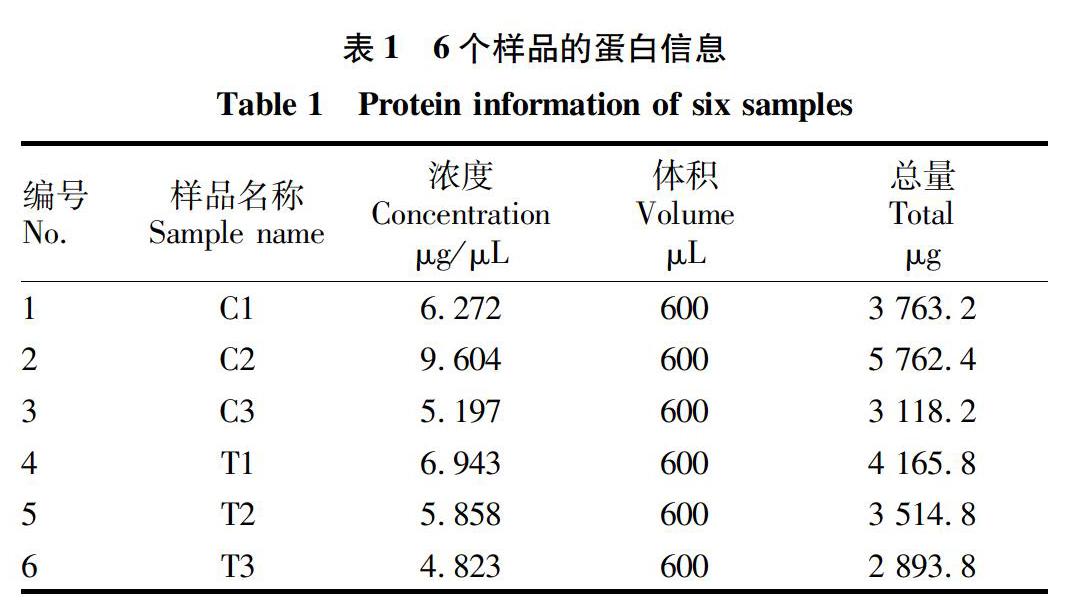
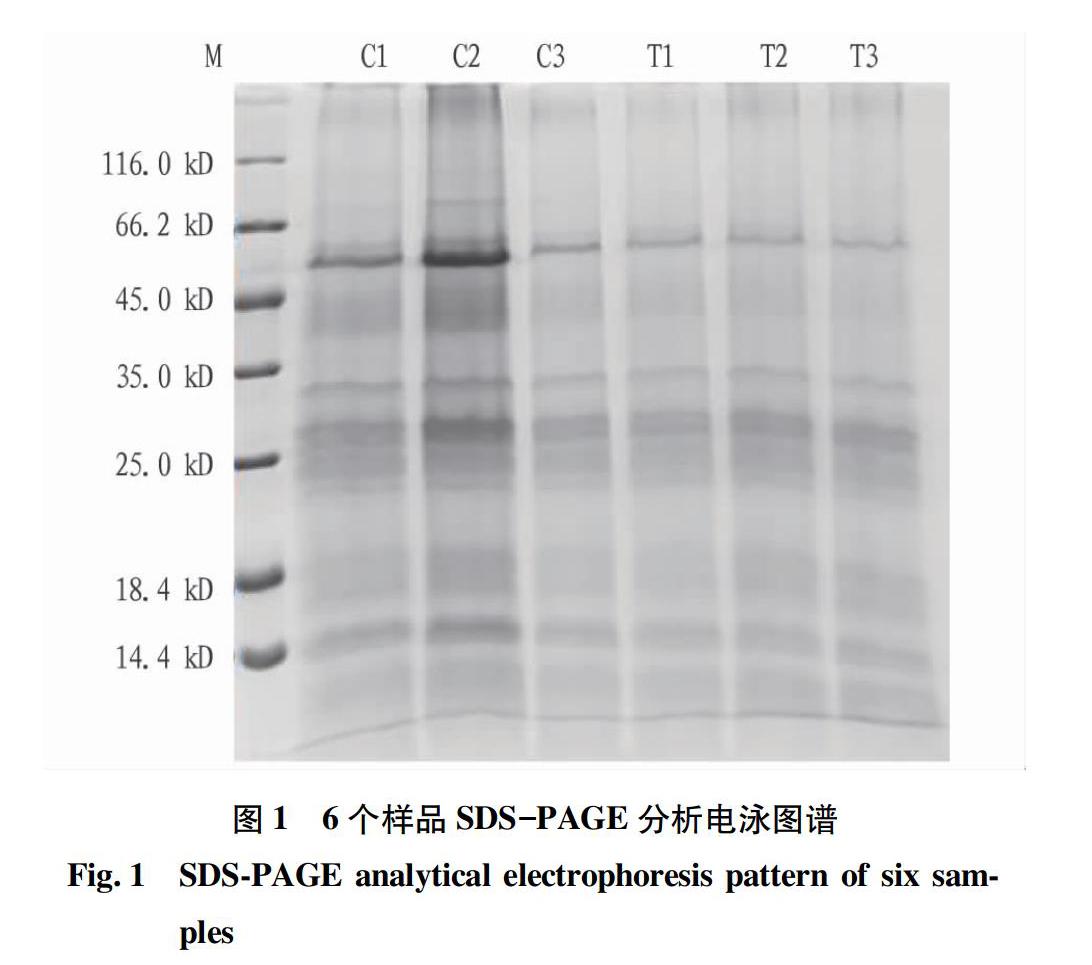
由表1可知,蛋白浓度均超过5 μg/μL,蛋白总量均超过1 500 μg。由图1可知,图谱条带清晰,大小集中在18.4~66.2 kD,说明样品蛋白提取良好,样品的浓度以及总量已达到进行后续试验的要求[17]。
2.2 差异表达蛋白质筛选
以倍数变化大于1.2倍(上调大于1.2倍或者下调小于0.83倍)且Pvalue小于0.05的标准筛选差异表达蛋白质[18]。各比较组的差异表达蛋白质数目:所有差异表达蛋白质为202个,上调差异表达蛋白质为110个,下调差异表达蛋白质为92个。
2.3 差异蛋白的KEGG代谢途径富集分析
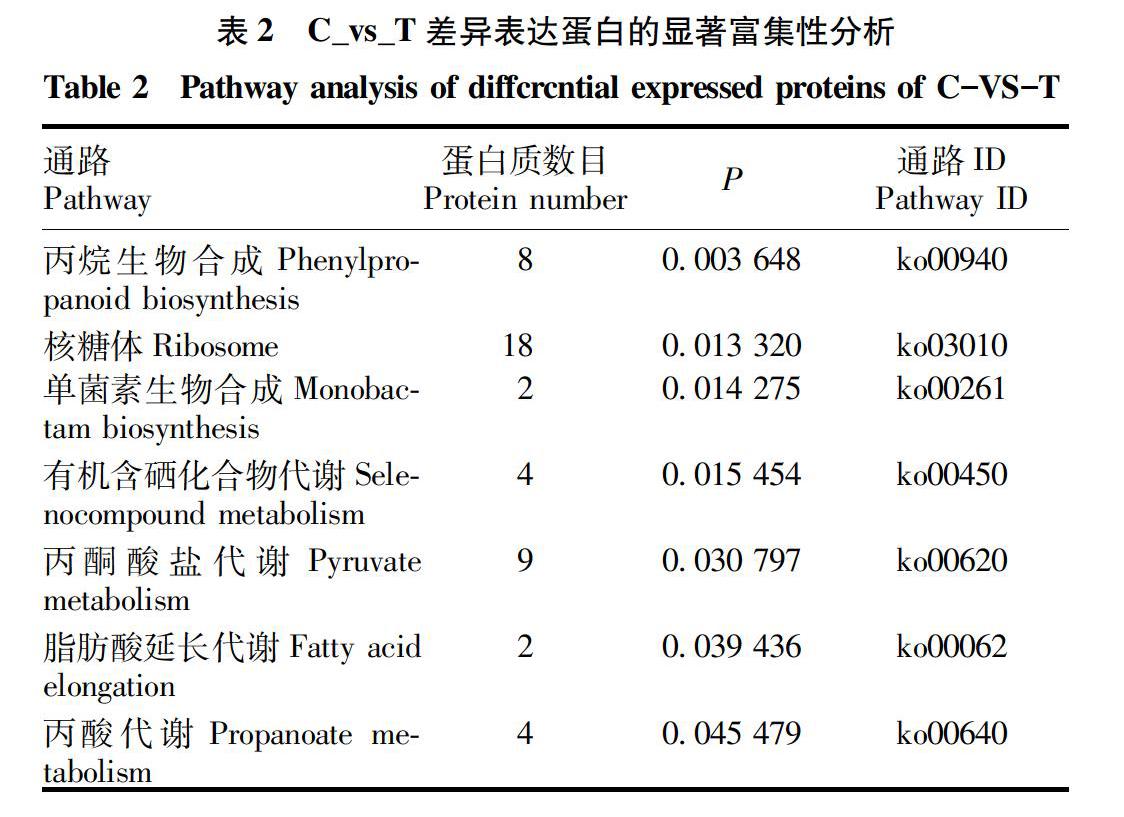
对被桉树枝瘿姬小蜂危害后的桉树叶差异蛋白pathway进行分析[14],由表2可知,危害后202个差异蛋白富集在161条通路中,其中显著富集的通路为7条(显著富集为P小于0.05),包括苯丙烷生物合成(phenylpropanoid biosynthesis)、核糖体(ribosome)、单菌素生物合成(monobactam biosynthesis)、有机含硒化合物代谢(selenocompound metabolism)、丙酮酸盐代谢(pyruvate metabolism)、脂肪酸延长代谢(fatty acid elongation)、丙酸代谢(propanoate metabolism)这7条通路。图2中纵坐标表示显著富集的KEGG通路;横坐标表示每条KEGG通路中包含的差异表达蛋白质数目;条形图颜色表示富集KEGG通路的显著性即基于Fisher精确检验(Fishers Exact Test)计算P值,颜色梯度代表P值的大小,颜色由橘色至红色渐变,越接近红色代表P值越小,对应KEGG通路富集度的显著性水平越高;条形图上方标签显示富集因子(richFator<=1),富集因子表示参与某KEGG通路的差异表达蛋白质数目占所有鉴定的蛋白质中参与该条通路的蛋白质数目的比例[19-20]。
3 结论与讨论
该试验共检测到蛋白质1 687个,与对照组相比桉树枝瘿姬小蜂危害胁迫下的桉树叶中有202个差异蛋白,其中上调蛋白为110个,下调蛋白为92个。
对差异蛋白pathway进行分析,结果显示差异蛋白显著富集于7条通路,包括苯丙烷生物合成(phenylpropanoid biosynthesis)、核糖体(ribosome)、单菌素生物合成(monobactam biosynthesis)、有机含硒化合物代谢(selenocompound metabolism)、丙酮酸盐代谢(pyruvate metabolism)、脂肪酸延长代谢(fatty acid elongation)、丙酸代谢(propanoate metabolism)这7条通路。其中最富集的通路为苯丙烷生物合成这条通路。
植物响应虫害诱导植物抗虫性的过程均极为复杂,笔者以桉树抗虫无性系DH32-29为材料,研究了桉树枝瘿姬小蜂危害胁迫下桉树叶片的差异蛋白质,但目前尚不能确定这些差异蛋白在寄主抗虫防御过程中的作用,还需进一步的基因功能分析。在今后的研究中,将结合转录组学的方法对桉
树在桉树枝瘿姬小蜂危害胁迫下的差异表达基因进行分析,对桉树枝瘿姬小蜂危害胁迫下桉树的应答过程进行系统研究。该试验仅研究了桉树被危害后桉树叶片的蛋白差异表达,还不清楚姬小蜂危害桉树产生虫瘿动态过程中蛋白表达,今后可以继续在这方面进行研究,以期更全面、深入地揭示桉树抗姬小蜂机制。
參考文献
[1] 王豁然.桉树遗传资源与引种驯化[C]//中国植物学会.第六届全国系统与进化植物学青年学术研讨会论文摘要集.北京:中国植物学会,2000:1.
[2] 郑嘉琪,陈少雄.我国桉树用途概述[J].桉树科技,2017,34(3):42-46.
[3] 黄肖春.试析桉树栽培管理及病虫害防治技术[J].南方农业,2018,12(9):53-54.
[4] 谢耀坚.中国桉树育种研究进展及宏观策略[J].世界林业研究,2011,24(4):50-54.
[5] 彭子先.我国引种桉树的历史沿革现状及发展前景[J].湖南林业科技,1987(3):24-27.
[6] 魏初奖,张华峰,张思禄,等.桉树枝瘿姬小蜂风险分析及风险管理[J].生物灾害科学,2015,38(3):182-189.
[7] MENDEL Z,PROTASOV A,FISHER N,et al.Taxonomy and biology of Leptocybe invasa gen.&sp.n.(Hymenoptera :Eurlophidae),an invasive gall inducer on Eucalyptus[J].Ausralian journal of entomology,2004,43(2):101-113.
[8]袁强.桉树枝瘿姬小蜂危害的识别[J].中国科技纵横,2015(15):223.
[9] 卢添财.桉树枝癭姬小蜂的生物学、风险分析及防控策略研究[D].福州:福建农林大学,2017.
[10] 常润磊,周旭东.我国桉树枝瘿姬小蜂研究现状[J].桉树科技,2010,27(1):75-78.
[11] 王海娇.1,6-二氧-乙酰大花旋覆花内酯对辣椒疫霉的抑菌活性研究[D].郑州:河南农业大学,2018.
[12] 王瑶函,吴蕊.不同浓度胺碘酮对肺成纤维细胞增殖及表面活性蛋白D表达的影响[J].毒理学杂志,2018,32(1):71-75.
[13] 邵若玄,徐红星,刘树生,等.应用鸟枪法LC-MS/MS鉴定烟粉虱唾液蛋白[J].环境昆虫学报,2018,40(2):433-439.
[14] 高劲,钱立庭,陶振超,等.基于iTRAQ定量蛋白质组学方法筛选鼻咽癌放射抗拒相关蛋白[J].安徽医科大学学报,2016,51(9):1333-1337.
[15] 郭长明,袁橙,武彩红,等.应用iTRAQ定量蛋白质组学技术筛选无乳链球菌鱼源株与人源株差异表达蛋白[J].水产学报,2018,42(3):442-451.
[16] 叶非.基于集群环境的三种蛋白质GO功能注释方法的实现[D].武汉:华中科技大学,2008.
[17] 李向真,刘子朋,李娟,等.KEGG数据库的进展及其在生物信息学中的应用[J].药物生物技术,2012,19(6):535-539.
[18] 翁佳妍,吴敏,王爽,等.蛋白质的检测方法简述[J].轻工科技,2012,28(9):17-18.
[19] 倪伟,倪蔚茹,赵静,等.苹果植株应答连作障碍差异蛋白质组学分析[J].山东农业科学,2017,49(5):1-9.
[20] 梁萌.捕食性真菌Duddingtonia flagrans蛋白质组学研究[D].呼和浩特:内蒙古农业大学,2018.
