产漆酶细菌筛选鉴定及固体发酵条件研究
2020-02-02谭叶林杜全能朱文娟胡丹肖思远徐茜陈佳佳兰时乐
谭叶林 杜全能 朱文娟 胡丹 肖思远 徐茜 陈佳佳 兰时乐
摘要 为了获得能降解木质素的细菌,采用愈创木酚法和BR亮蓝平板法从枯枝落叶自然堆积物中分离漆酶活力较高的菌株,通过形态学观察、生理生化试验,16S rRNA序列分析及系统发育树的构建对菌株进行鉴定。以芦苇秸秆粉为主要原料,采用单因素试验和正交试验研究并优化了菌株适宜的发酵培养基和发酵条件。结果表明,菌株H-1鉴定为蜡状芽孢杆菌H-1(Bacillus cereus H-1);适宜的发酵培养基和发酵条件为芦苇粉100%,(NH4)2SO4 2.5%,酵母抽提粉0.3%,KH2PO4 0.15%,MgSO4·7H2O 0.15%,NaCl 0.5%,CaCl2 0.1%,发酵温度35 ℃,固水比1.0∶1.1(g∶mL),初始pH 7.2~7.4,接种量3%,装量50 g,发酵时间144 h。在此条件下,漆酶活力达0.992 U/g。
关键词 芦苇秸秆;蜡状芽孢杆菌;漆酶;固体发酵
中图分类号 S-3 文献标识码 A文章编号 0517-6611(2020)01-0001-06
doi:10.3969/j.issn.0517-6611.2020.01.001
开放科学(资源服务)标识码(OSID):
Screening and Identification of Laccase producing Bacteria and Study on Solid state Fermentation Conditions
TAN Ye lin,DU Quan neng,ZHU Wen juan et al
(College of Bioscience and Biotechnology, Hunan Agricultural University,Changsha,Hunan 410128)
Abstract In order to obtain lignin degrading bacteria, the strains with high laccase activity were isolated from natural litter by guaiacol and BR brilliant blue plate method which were identified by morphological observation, physiological and biochemical experiments, 16S rRNA sequence analysis and phylogenetic tree construction. The suitable fermentation medium and fermentation conditions of the strain were optimized by single factor and orthogonal experiments with reed straw powder as the main raw material. The results showed that strain H 1 was identified as Bacillus cereus H-1. The suitable fermentation medium and conditions were as follows: reed powder 100%, (NH4)2SO4 2.5%, yeast extract powder 0.3%, KH2PO4 0.15%, MgSO4·7H2O 0.15%, NaCl 0.5%, CaCl2 0.1%, fermentation temperature 35 ℃, solid water ratio 1.0∶1.1(g∶mL), initial pH 7.2-7.4, inoculation volume 3%, loading capacity 50 g, fermentation time 144 h. Under those conditions, laccase activity reached 0.992 U/g.
Key words Reed straw;Bacillus cereus;Laccase;Solid state fermentation
木質素主要存在于木材和各种秸秆中,全世界每年产量约1 500亿t,它是一种取之不尽,用之不竭的绿色再生资源[1]。其结构复杂,主要是由5-羟基松柏醇、对香豆醇、芥子醇和松柏醇等组成的酚类聚合物[2]。由于木质素与半纤维素、纤维素之间相互混杂和交联,且将纤维素包埋其中[3-5],导致纤维素难以被降解或降解效率低。木质素的降解方法主要包括物理法[6-7]、化学法[6,8]、物理化学法[9-10]和微生物法[11-12]。其中微生物法以其反应条件温和、设备要求和成本低以及对环境友好等优点受到国内外许多科研工作者的高度重视。胡笑峰等[13]以碱木质素为唯一碳源从落叶覆盖的土壤中分离1株能够将木质素样品裂解成细小碎片的细菌Erwinia sp.QL-G3;张鹏飞等[14]从高温期堆肥中筛选到1株木质素降解率为28.47%的嗜热嗜脂肪芽孢杆菌(Geobacillus stearothermophilus);Chen等[15]在竹腐蚀滑块的流体中培养丛毛单胞菌B-9,发现该菌能在木质素衍生物中生长;李红亚等[16]分离筛选到1株玉米秸秆木质素降解率可达24%的淀粉芽孢杆菌(Bacillus amyloliquefaciens)。该研究拟从枯枝落叶自然堆积物中分离能高效降解木质素的菌株,采用形态学观察、生理生化试验和16S rRNA序列分析对菌株进行鉴定,并研究菌株适宜的漆酶产生条件,以期为高效利用芦苇纤维素生产生物乙醇提供科学依据。
1 材料與方法
1.1 材料
1.1.1 土样采集。
菌种分离样品采自长沙市森林植物园枯枝落叶堆积且腐烂严重的土样,用无菌自封袋带回实验室立即进行菌种分离。
1.1.2 主要仪器与设备。
MJ-160C细菌培养箱(上海博讯实业有限公司医疗设备厂);SS-325高温高压灭菌锅(TOMY.KOGYO.CO,LTD);SW-CJ-1B(U)单人单面超净工作台(苏州设备净化有限公司);QYC 2112恒温振荡培养箱(上海福玛实验设备有限公司);722型可见分光光度计(上海光谱仪器有限公司)。
1.1.3 主要试剂。
牛肉膏、可溶性淀粉、MgSO4·7H2O、(NH4)2SO4、FeSO4、CaCO3、FeCl3、葡萄糖、麦芽糖、蔗糖、D-甘露糖(AR,国药集团化学试剂有限公司),KH2PO4(AR,西陇化工股份有限公司),酵母抽提粉(BR,国药集团化学试剂有限公司),蛋白胨(BR,上海胜思生化科技有限公司)等。
1.1.4 培养基。
1.1.4.1 斜面培养基。牛肉膏0.300%,蛋白胨1.000%,NaCl 0.500%,琼脂粉2.000%,pH 7.2~7.5。
1.1.4.2 初筛培养基。蛋白胨0.500%,酵母抽提粉1.000%,葡萄糖2.000%,愈创木酚2.500 g/L,NaCl 0.500%,琼脂粉2.000%,pH 7.2~7.5。
1.1.4.3 RB亮蓝培养基。胰蛋白胨1.000%,酵母抽提粉0.500%,NaCl 0.500%,RB亮蓝0.003%,琼脂粉2.000%,pH 7.2~7.5。
1.1.4.4 复筛培养基。木质素1.000%,葡萄糖0.200%,(NH4)2SO4 0.500%,酵母抽提粉0.500%,KH2PO4 0.200%,MgSO4·7H2O 0.100%,MnSO4·4H2O 0.002%,CaCl2 0.010%,pH 7.2~7.5。
1.1.4.5
液体种子培养。葡萄糖2.000%,蛋白胨1.000%,酵母抽提粉0.500%,KH2PO4 0.200%,MgSO4·7H2O 0.100%,NaCl 0.500%,pH 7.2~7.5。
1.1.4.6
基础产酶培养基。芦苇粉100%,(NH4)2SO4 2.000%,酵母抽提粉0.500%,KH2PO4 0.200%,MgSO4·7H2O 0.100%,NaCl 0.500%,CaCl2 0.100%,固∶水=1∶1(g∶mL),pH 7.2。
1.1.4.7 生理生化试验培养基。参照文献[17]提供的培养基配制。
1.2 方法
1.2.1 木质素分解菌的筛选。
将样品按照10倍稀释法稀释至10-3~10-6,吸取稀释液0.1 mL于初筛固体培养基平板中央,置于37 ℃电热恒温培养箱中培养至长出菌落。选择变成粉红色变色圈的单菌落接种于牛肉膏蛋白胨培养基斜面上并编号,37 ℃恒温培养箱中培养36 h,备用。
1.2.2 漆酶产生菌的筛选。
将分离保存的菌种分别接种于RB亮蓝固体培养基平板中央,37 ℃恒温培养2 d,选择培养基褪色圈大的菌落进行复筛。
1.2.3 漆酶产生菌复筛。
1.2.3.1
液体菌种培养。
将分离且在亮蓝培养基上褪色快的菌种分别接种于液体种子培养基中,37 ℃、150 r/min恒温振荡培养24 h,备用。
1.2.3.2 菌种复筛。
按2%(V/W)的接种量接入基础产酶培养基中,37 ℃恒温培养5 d后,测定漆酶酶活。
1.2.4 菌种鉴定。
1.2.4.1 菌落和菌体形态特征观察。将菌株H-1接种于牛肉膏蛋白胨固体培养基平板上,37 ℃培养16~24 h,观察菌落和菌体形态特征。
1.2.4.2
生理生化特征鉴定。对菌株H-1进行需氧型、糖发酵、VP、吲哚、淀粉水解、硝酸盐还原等生理生化试验鉴定。
1.2.4.3 16S rRNA序列测定。
按SK8255试剂盒提取16S rRNA并测序分析,采用通用引物F27(5′-CAGAGTTTGATCCTGGCT-3′)和R1492(5′-AGTTTGATCMTGGCTCAG-3′)对菌株H-1的16S rRNA进行PCR扩增,PCR扩增体系参照文献[18]提供的方法进行。测序结果利用NCBI提供的BLAST程序与数据库中的所有序列进行比对,利用MEGA 5.0构建系统发育树。
1.2.5 培养。
1.2.5.1 斜面培养。将保存于冰箱的斜面种子接种于新鲜斜面培养基上,37 ℃恒温培养至成熟,备用。
1.2.5.2 液体种子培养。将培养的斜面菌种接种于液体种子培养基中,37 ℃、150 r/min条件下恒温振荡培养24 h,备用。
1.2.5.3 发酵产酶培养。在300 mL三角瓶中装入50 g基础产酶培养基,接入2%(V/W)的液体种子,37 ℃恒温条件下培养5 d,期间每24 h摇匀1次。
1.2.6 产酶条件研究。
分别改变培养基中碳源种类,(NH4)2SO4、酵母抽提粉、KH2PO4、MgSO4·7H2O添加量以及固水比、初始pH、培养温度、接种量、装量和发酵时间等,研究其对漆酶酶活的影响。
1.2.7 發酵条件优化。
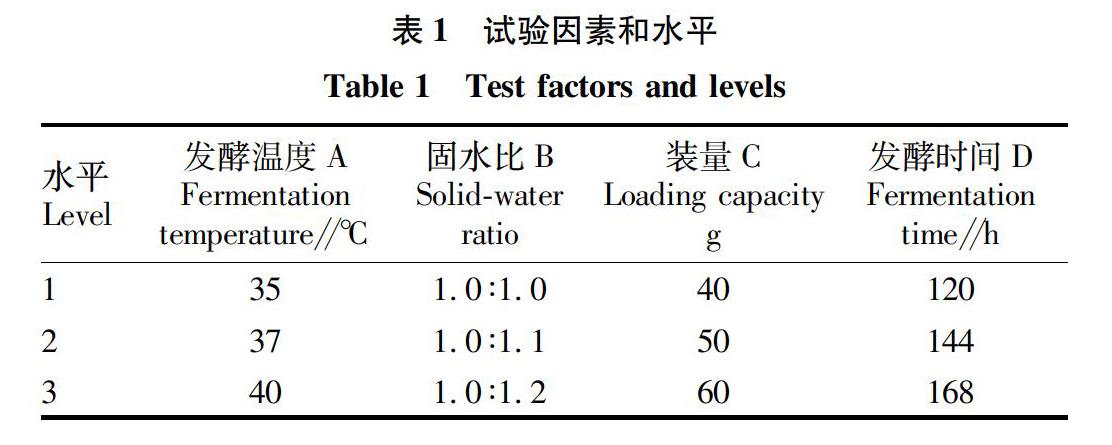
在单因素试验结果基础上,选择对漆酶活力影响较大的因素培养温度、固水比、装量和发酵时间进行4因素3水平正交试验,因素水平设计见表1。
1.2.8 酶活测定。
参照文献[19]提供的方法进行。
2 结果与分析
2.1 菌种初筛
采用选择性培养基从所取样品中分离到能在初筛培养基上变成粉红色变色圈且菌落形态特征不同的细菌15株,分别编号为A1、A1-1、A1-2、A2、B1、B3、B3-1、B3-3、B2-1、H1、H-1、H2、H2-1、W1、W2。
2.2 RB亮蓝培养基筛选
将分离到的15株细菌分别接种于RB亮蓝培养基平板上,37 ℃培养48 h,测量脱色圈直径,其中脱色圈直径大于40 mm的菌株有A1、H-1,脱色圈直径为20~40 mm的有A1-1、B1、B2-1、H2-1、W1和W2,其余7株细菌的脱色圈直径均小于20 mm(表2)。
2.3 菌种复筛
选取脱色圈直径大于20 mm的菌株进行复筛,测定固体发酵培养基中漆酶活力。从表3复筛结果可以看出,菌株H-1的漆酶活力最高,达0.42 U/g。选用菌株H-1进行后续研究。
48卷1期 谭叶林等 产漆酶细菌筛选鉴定及固体发酵条件研究
2.4 菌种鉴定
2.4.1 形态观察结果。
菌落为圆形或近似圆形、灰白色,不透明,表面较粗糙,菌落大,扁平,不规则,产芽孢。
2.4.2 生理生化试验结果。试验结果见表4。
2.4.3 菌株H-1 16S rRNA序列分析。
2.4.3.1 PCR扩增结果。
对菌株H-1的PCR产物进行琼脂糖凝胶电泳,结果见图1。从图1可以看出,在1 500 bp左右条带较亮,且无其他杂带,说明PCR扩增得到了目的片段。
2.4.3.2 菌株H-1系统发育分析结果。
在GenBank中用BLAST软件将测定的序列进行同源性比对,根据图2比对结果可得知,菌株H-1与Bacillus cereus(登录号MG228369.1)具有100%相似性。根据形态学观察结果,生理生化试验结果和16S rRNA序列分析,将菌株H-1鉴定为蜡状芽孢杆菌(Bacillus cereus)。
2.5 产酶条件研究
2.5.1 碳源种类对漆酶活力的影响。
在基础发酵培养基中分别加入2%的葡萄糖、蔗糖、麦芽糖、甘露醇和可溶性淀粉,其他条件不变,于37 ℃恒温条件下培养5 d,测定漆酶酶活。由图3可知,在发酵培养基中添加外源碳源后,漆酶活力分别较对照降低23.91%、41.30%、32.61%、73.91%、63.04%,说明在发酵培养基中不需要添加外源碳源。
2.5.2 (NH4)2SO4添加量对漆酶活力的影响。
分别在基础发酵培养基中加入0.5%、1.0%、1.5%、2.0%、2.5%和3.0%的(NH4)2SO4,其他成分不变,于37 ℃恒温条件下培养5 d,测定漆酶酶活。由图4可知,在一定范围内,随着(NH4)2SO4添加量的增加,漆酶活力随之增加。当(NH4)2SO4添加量为2.5%时,漆酶活力最高,为0.48U/g,但继续增加(NH4)2SO4,酶活力下降。因此,选择(NH4)2SO4添加量为2.5%进行后续试验。
2.5.3 酵母提取粉添加量对漆酶活力的影响。
在上述试验结果的基础上,于基础产酶发酵培养基中分别加入0.2%、0.3%、0.4%、0.5%和0.6%的酵母抽提粉,其他成分不变,于37 ℃恒温培养5 d,测定漆酶酶活。由图5可知,当酵母提取粉添加量为0.3%时,漆酶活力最大,达0.52 U/g,但随着酵母提取物添加量的增大,漆酶活力下降。原因为增加氮源含量,改变了培养基的碳氮比,从而导致菌体大量生长而影响微生物代谢。
2.5.4 KH2PO4添加量对漆酶活力的影响。
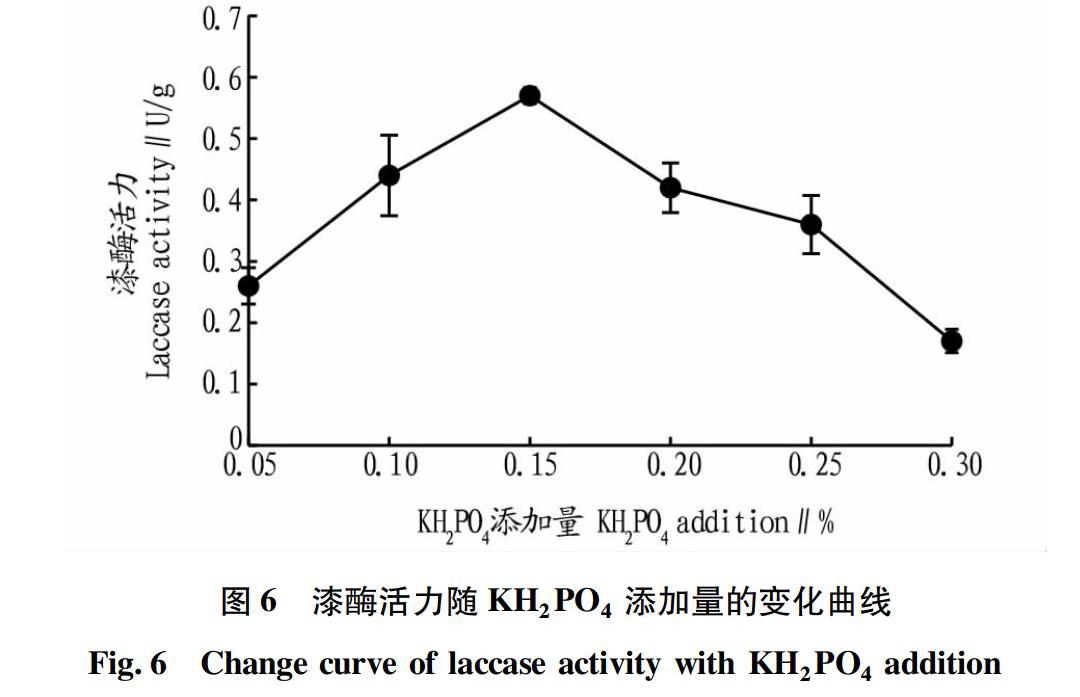
在上述试验结果的基础上,改变基础产酶发酵培养基中KH2PO4添加量(0.05%、0.10%、0.15%、0.20%、0.25%和0.30%),其他成分不变,于37 ℃恒温条件下培养5 d,测定漆酶酶活。磷是微生物生长和代谢过程中不可缺少的营养物质,是组成核酸和磷脂的成分,也存在于高能磷酸化合物及一些酶的活性基团中,同时还有利于糖代谢,但培养基中磷过量,则会抑制产物的合成。从图6可以看出,随着KH2PO4添加量的增加,漆酶活力增加,当KH2PO4添加量为0.15%时,漆酶活力最大,达0.57 U/g。但继续增加KH2PO4添加量,漆酶活力显著下降。因此,选择KH2PO4添加量为0.15%进行后续试验。
2.5.5 MgSO4·7H2O添加量对漆酶活力的影响。
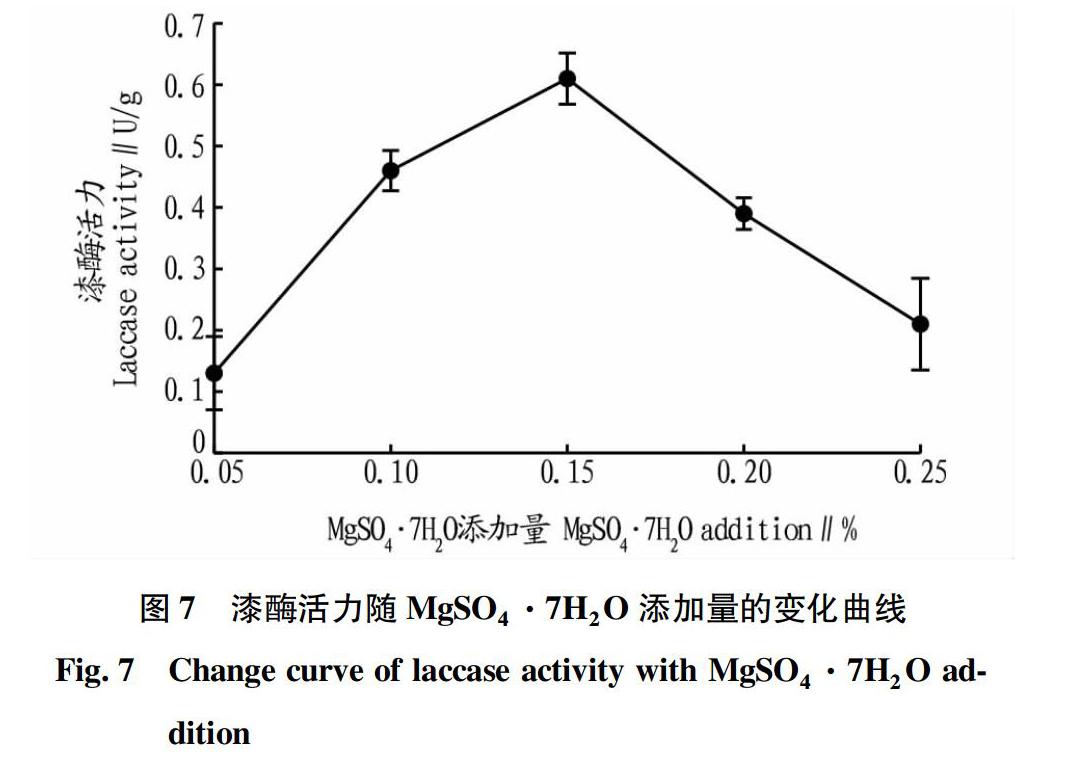
在上述试验结果的基础上,在基础产酶发酵培养基中分别加入0.05%、0.10%、0.15%、0.20%、0.25%的MgSO4·7H2O,其他成分不变,于37 ℃恒温条件培养5 d,测定漆酶酶活。镁是细胞中己糖磷酸化酶、柠檬酸脱氢酶、羧化酶等的激活剂,可以影响基质的氧化和蛋白质合成。由图7可知,MgSO4·7H2O添加量对漆酶活力的变化趋势与KH2PO4添加量的变化趋势一致,同样是随着MgSO4·7H2O添加量的增加,漆酶活力呈现先上升后下降的趋势。当MgSO4·7H2O添加量为0.15%时,漆酶活力最大,为0.61 U/g。因此,选择MgSO4·7H2O添加量为0.15%进行后续试验。
2.5.6 培养温度对漆酶活力的影响。
在上述试验结果的基础上,分别将培养基置于30、32、35、37和40 ℃的恒温培养箱中培养5 d,其他条件不变,测定漆酶酶活。从图8可以看出,随着培养温度的升高,培养物料中漆酶活力也提高。当培养温度为37 ℃时,培养料中漆酶活力最高,达0.733 U/g,但提高培养温度,漆酶活力下降。温度是影响细胞中生物大分子物理状态的原因之一,低温可导致细胞膜凝固,使得物质运送困难;高温则可使细胞中蛋白质和酶的变性和失活。因此,选择培养温度为37 ℃进行后续试验。
2.5.7 固水比对漆酶活力的影响。
用自来水分别调节培养基的固水比为1.0∶0.8、1.0∶0.9、1.0∶1.0、1.0∶1.1和1.0∶1.2,其他条件不变,于37 ℃恒温条件下培养5 d,测定漆酶酶活。从图9可以看出,培养基的含水量对漆酶活力有很大影响。随着含水量的增加,漆酶活力增加,当培养基中的固水比为1.0∶1.1时,酶活达0.783 U/g,但当培养基中的固水比超过1.0∶1.1时,漆酶活力下降。培养基中含水量过多,造成培养基为厌氧环境,阻碍了菌株生长以及漆酶的合成和分泌,从而导致漆酶活力下降。因此,选择固水比为1.0∶1.1进行后续试验。
2.5.8 初始pH对漆酶活力的影响。
在上述试验结果的基础上,用稀酸或稀碱分别调节培养基的初始pH为6.8、7.0、7.2、7.4、7.6,其他条件不变,于37 ℃恒温条件下培养5 d,测定漆酶活力。pH可以影响培养基中营养物质的离子化强度,从而影响微生物对营养物质的吸收,影响环境中有害物质对微生物的毒性以及影响代谢反应中各种酶活性等。由图10可知,培养基初始pH在7.2~7.4,漆酶活力差异不显著,分别为0.776和0.783 U/g,但初始pH高于或低于此范围,漆酶活力均下降。
2.5.9 接种量对漆酶活力的影响。
在上述试验结果的基础上,分别接入1%、2%、3%、4%和5%的液体种子,恒温培养5 d,其他條件不变,测定漆酶活力。从图11可以看出,在一定范围内,漆酶活力随接种量的增大而增大,当接种量为3%时,漆酶活力为0.835 U/g。但接种量超过3%,表现为明显的下降。原因是当接种量过小,延滞期长;而当接种量过大,前期培养基中的营养物质消耗过大,同时从种子液中带入的副产物也过多,均影响菌体生长和漆酶合成分泌。
2.5.10 装量对漆酶活力的影响。
在上述试验结果的基础上,分别在300 mL三角瓶中装入30、40、50、60、70 g固体产酶发酵培养基,恒温培养5 d,其他条件不变,测定漆酶活力。从图12可以看出,当装量为50 g时,漆酶活力最大,为0.826 U/g,装量增加,漆酶活力降低。主要原因为装量少,培养过程培养基中的水分容易蒸发,装量过多,影响培养基中氧气的流通,从而影响微生物的生长和代谢。因此,选择装量为50 g进行后续试验。
2.5.11 发酵时间对漆酶活力的影响。
在上述试验结果的基础上,发酵培养48 h后开始第1次取样,以后每隔24 h取样1次,直至168 h终止培养,分别考察不同发酵时间对菌株H-1产漆酶活力的影响。由图13可知,发酵时间对漆酶活力影响较大,随着发酵时间延长,漆酶活力增加。当发酵时间为144 h时,漆酶活力最大,为0.976 U/g,但发酵时间延长,漆酶活力下降。因此,选择适宜的发酵时间为144 h。
2.6 发酵条件优化结果
发酵条件优化结果见表5。由极差分析可知,固体发酵对漆酶活力的影响因素主次为发酵温度、固水比、发酵时间、装量,即发酵温度影响最大,固水比次之,装量影响最小。由表5可知,最优组合为A2B2C2D2,而在试验组合中漆酶活力最高的组合为A1B2C2D2。对A2B2C2D2和A1B2C2D2这2个组合进行5次验证试验。
由上述结果可知,适宜的组合为A1B2C2D2,即发酵温度35 ℃,固水比1.0∶1.1,装量50 g,发酵时间144 h。在此条件下,漆酶活力为0.992 U/g(表6)。
3 结论
3.1 菌种分离与鉴定
采用选择性培养基和稀释平板涂布法从长沙森林公园枯枝落叶堆积物中分离到15株具有漆酶活性的细菌,通过复筛,筛选到1株漆酶活性较高的菌株H-1。采用形态学观察、生理生化试验和16S rRNA序列分析以及系统发育树构建,将菌株H-1鉴定为蜡状芽孢杆菌H-1(Bacillus cereus H-1)。
3.2 蜡状芽孢杆菌H-1产漆酶的发酵条件
以芦苇粉为主要原材料,采用单因素试验法研究了培养基组成和发酵条件对漆酶活力的影响,在单因素试验结果的基础上,采用正交试验法对影响漆酶活力较大的因素进行优化。适宜的发酵培养基和发酵条件为芦苇粉100%,(NH4)2SO4 2.5%,酵母抽提粉0.3%,KH2PO4 0.15%,MgSO4·7H2O 0.15%,NaCl 0.5%,CaCl2 0.1%,发酵温度35 ℃,固水比1.0∶1.1,初始pH 7.2~7.4,接种量3%,装量50 g,发酵时间144 h。在此条件下,漆酶活力为0.992 U/g。
参考文献
[1] 王庆福,黄清铧,梁磊,等.灵芝木质素降解酶研究及其潜在应用进展[J].热带作物学报,2015,36(7):1361-1367.
[2] 路瑶,魏贤勇,宗志敏,等.木质素的结构研究与应用[J].化学进展,2013,25(5):838-858.
[3] 闫智培,李纪红,李十中,等.木质素对木质纤维素降解性能的影响[J].农业工程学报,2014,30(19):265-272.
[4] RYCKEBOER J,MERGAERT J,UAES K,et al.A survey of bacteria and fungi occurring during composting and self-heating processes[J].Ann Microbiol,2003,53(4):349-410.
[5] 武志远.木质素生物合成途径中关键酶基因的分子特征[J].农村科学实验,2017(1):89-90.
[6] ALVIRA P,TOM S PEJ E,BALLESTEROS M,et al.Pretreatment technologies for an efficient bioethanol production process based on enzymatic hydrolysis:A review[J]. Bioresource technology,2010,101(13):4851-4861.
[7] FITZPATRICK M,CHAMPAGNE P,CUNNINGHAM M F,et al.A biorefinery processing perspective:Treatment of lignocellulosic materials for the production of value added products[J].Bioresource technology,2010,101(23):8915-8922.
[8] BANERJEE S,MUDLIAR S,SEN R,et al.Commercializing lignocellulosic bioethanol:technology bottlenecks and possible remedies[J].Biofuels bioproducts & biorefining,2010,4(1):77-93.
[9] HUANG H J,RAMASWAMY S,TSCHIRNER U W,et al.A review of separation technologies in current and future biorefineries[J].Separation & purification technology,2008,62(1):1-21.
[10] CHIARAMONTI D,PRUSSI M,FERRERO S,et al.Review of pretreatment processes for lignocellulosic ethanol production,and development of an innovative method[J].Biomass and bioenergy,2012,46(6):25-35.
[11] L PEZ ABELAIRAS M,LU CHAU T A,LEMA J M.Fermentation of biologically pretreated wheat straw for ethanol production:Comparison of fermentativemicroorganisms and process configurations[J].Applied biochemistry and biotechnology,2013,170(8):1838-1852.
[12] ZHANG J,REN X,CHEN W Q,et al.Biological pretreatment of corn stover by solid state fermentation of Phanerochaete chrysosporium[J].Frontiers of chemical science and engineering,2012,6(2):146-151.
[13] 胡笑峰,張朵朵,周云横,等.一株木质素降解菌的鉴定及其降解特性[J].生物技术通报,2019,35(9):172-177.
[14] 张鹏飞,李素艳,余克非,等.木质素降解细菌的筛选及园林废弃物降解研究[J].安徽农业大学学报,2018,45(4):676-681.
[15] CHEN Y H,CHAI L Y,ZHU Y H,et al.Biodegradation of kraft lignin by a bacterial strain Comamonas sp.B-9 isolated from eroded bamboo slips[J].Journal of applied microbiology,2012,112(5):900-906.
[16] 李红亚,李术娜,王树香,等.产芽孢木质素降解菌MN-8的筛选及其对木质素的降解[J].中国农业科学,2014,47(2):324-333.
[17] 杨文博.微生物学实验[M].北京:化学工业出版社,2004.
[18] 姜立春,赵丽萍,杨萍,等.木质素降解菌BP01的筛选、鉴定及其产酶特性[J].江苏农业科学,2018,46(9):241-246.
[19] 崔艳红,张海棠,孟庆辉,等.白腐真菌产木质素降解酶的条件及酶学性质的研究[J].吉林农业科学,2008,33(2):43-47.
