高浓度维生素B6注射液细菌内毒素检查方法学验证
2020-01-19芦佳月罗晓茹王习文中国人民解放军联勤保障部队药品仪器监督检验总站北京100071
沈 娟,芦佳月,罗晓茹,王习文(中国人民解放军联勤保障部队药品仪器监督检验总站,北京 100071)
维生素B6是一种水溶性维生素,遇光或碱易被破坏,不耐高温;是制造抗体和红细胞的必要物质[1];对婴儿的大脑和神经系统发育亦至关重要[2]。可用于治疗因大量或长期服用异烟肼等引起的周围神经炎、失眠、不安;减轻抗癌药和放射治疗引起恶心、呕吐或妊娠呕吐等[3];治疗或预防婴儿惊厥;治疗白细胞减少症、痤疮、酒糟鼻、脂溢性湿疹等[4-6]。注射用维生素B6其细菌内毒素检查已有报道[7],维生素B6注射液质量标准也已被载入《中华人民共和国药典(二部)》2015年版[8],其中包括了细菌内毒素检查项,但药典中该品种项下的药物浓度最高为50 mg/ml,而125 mg/ml高浓度维生素B6注射液其细菌内毒素的检查未见相关报道。为了更好地控制该注射剂的质量,笔者参照《中国药典》2015年版四部通则1143细菌内毒素检查凝胶法[8],对维生素B6注射液用鲎试剂进行细菌内毒素检查的可行性研究。
1 试验材料
1.1 供试品
维生素B6注射液由军事科学院放射与辐射医学研究所提供(批号:1905131、1904261、1905132,规格20 ml:2.5 g)。
1.2 试剂
鲎试剂(福州新北生化工业有限公司,0.25 EU/ml,批号:19010812;0.06 EU/ml,批号:19050112;湛江安度斯生物有限公司,0.06 EU/ml,批号:1903132);Tris缓冲液(湛江安度斯生物有限公司,批号:1904230;规格:每支4 ml);镁离子缓冲液(湛江安度斯生物有限公司,批号:1901310;规格:每支4 ml);细菌内毒素工作标准品(中国食品药品检定研究院,批号:150601-201886,规格:每支80 EU);细菌内毒素检查用水(BET, bacterial endotoxin test水,中国食品药品检定研究院,批号:160006-201510;规格:每支5 ml)。
1.3 仪器
SSW-600-2S电热恒温水槽(上海博迅实业有限公司医疗设备厂);其他器皿包括试管、微量移液器及无热原吸头。
2 方法与结果
2.1 限值的确定
本品为在研的维生素类制剂,其说明书用法用量为:“临用前以250 ml乳酸钠林格氏液稀释后静脉滴注。依病情,首次给予相当于维生素B61~5 g快速滴注。”得知本品的最大给药剂量为5 g/(60 kg·h)。根据公式L=K/M,K为人每千克体重每小时最大可接受的内毒素剂量,注射剂为5 EU/(kg·h);M为人用每千克体重每小时的最大供试品剂量,则限值L=0.06 EU/mg。
2.2 鲎试剂灵敏度复核试验
按照《中国药典》2015年版四部通则1143[9]细菌内毒素检查法规定,对鲎试剂进行灵敏度(λc)复核。3批鲎试剂灵敏度测定值λc均在0.5~2.0 λ之间,均符合规定,3批鲎试剂灵敏度复核结果皆为标示灵敏度。详见表1。

表1 3批鲎试剂灵敏度复核结果
2.3 干扰试验预试验
2.3.1 维生素B6注射液最大有效稀释倍数(MVD)的计算
最大有效稀释倍数计算公式为:MVD=cL/λ,式中:L为供试品的细菌内毒素限值0.06 EU/mg;c为供试品溶液浓度;λ为鲎试剂标示灵敏度(EU/ml)。
根据市售鲎试剂灵敏度λ范围0.5~0.03 EU/ml,对维生素B6注射液进行细菌内毒素检测时,用0.5、0.25、0.125、0.06、0.03 EU/ml的鲎试剂分别对应有效稀释倍数:15、30、60、120、240倍,分别对应有效稀释浓度:8.33、4.17、2.08、1.04、0.52 mg/ml。
由于供试品pH偏酸性(pH2~3),不在细菌内毒素测定的合适范围内,因此需先调节pH至6.0~8.0,再进行测定。前期试验发现,用0.25 EU/ml的鲎试剂,以0.1 mol/L氢氧化钠溶液作为pH调节剂进行内毒素试验,结果存在一定程度的干扰。
目前市售的pH缓冲液有湛江安度斯生物有限公司生产的镁离子缓冲液(pH6.5~7.5)和Tris缓冲液(pH6.5~7.5),拟用市售的缓冲液代替0.1 mol/L氢氧化钠溶液对供试品进行稀释和pH调节,再进行干扰试验。
2.3.2 试验操作及结果
用其中一批供试品(批号:1905132)进行细菌内毒素干扰预实验。将维生素B6注射液用镁离子缓冲液(以下简称“稀释剂Ⅰ”)分别稀释至8.33、4.17、2.08、1.04、0.52 mg/ml,此系列浓度溶液为不含内毒素的供试品溶液(NPC:negtive product control),另制备含有2λ(0.5 EU/ml)浓度细菌内毒素的相同系列浓度的供试液,此系列溶液为含内毒素的供试品溶液(PPC:positive product control)。
取灵敏度为0.25 EU/ml的鲎试剂,分别与NPC和PPC系列溶液反应,每一浓度设2支复管,同时设阳性对照(PC:positive control)、阴性对照(NC)、稀释剂Ⅰ阴性对照(ⅠNC)、稀释剂Ⅰ阳性对照(ⅠPC),结果见表2。

表2 维生素B6注射液用稀释剂Ⅰ稀释和pH调节后的干扰预试验结果
用Tris缓冲液(以下简称“稀释剂Ⅱ”)进行与稀释剂Ⅰ同样的干扰预试验,结果见表3。

表3 维生素B6注射液用稀释剂Ⅱ稀释和pH调节后的干扰预试验结果
结果表明:以稀释剂Ⅰ(或稀释剂Ⅱ)对供试品进行稀释和pH调节,供试品溶液浓度在1.04 mg/ml及以下对鲎试剂和内毒素的凝集反应无干扰。而1.04 mg/ml对应的鲎试剂灵敏度为0.06 EU/ml,故宜选用0.06 EU/ml及0.06 EU/ml以上灵敏度的鲎试剂进行细菌内毒素检查。
2.4 正式干扰试验
采用两个厂家生产的鲎试剂对3批维生素B6注射液(批号:1905131、1904261、1905132)进行正式干扰试验。试验选择灵敏度为0.06 EU/ml的鲎试剂进行,对应最小有效稀释浓度为1.04 mg/ml。用稀释剂Ⅰ和稀释剂Ⅱ分别对供试品进行稀释和pH调节,再进行干扰试验研究。
制备含有0.125(2 λ)、0.06(1 λ)、0.03(0.5 λ)和0.015(0.25 λ)EU/ml内毒素浓度的1.04 mg/ml的供试品溶液,每一浓度设4支复管;用BET水和稀释剂Ⅰ分别制备0.125(2 λ)、0.06(1 λ)、0.03(0.5 λ)和0.015(0.25 λ)EU/ml内毒素系列溶液,每一浓度设2支复管;并分别设NC 2支。与灵敏度为0.06 EU/ml的鲎试剂进行反应,按《中国药典》2015版四部通则1143细菌内毒素检查凝胶法[8]干扰试验规定进行试验,结果见表4。
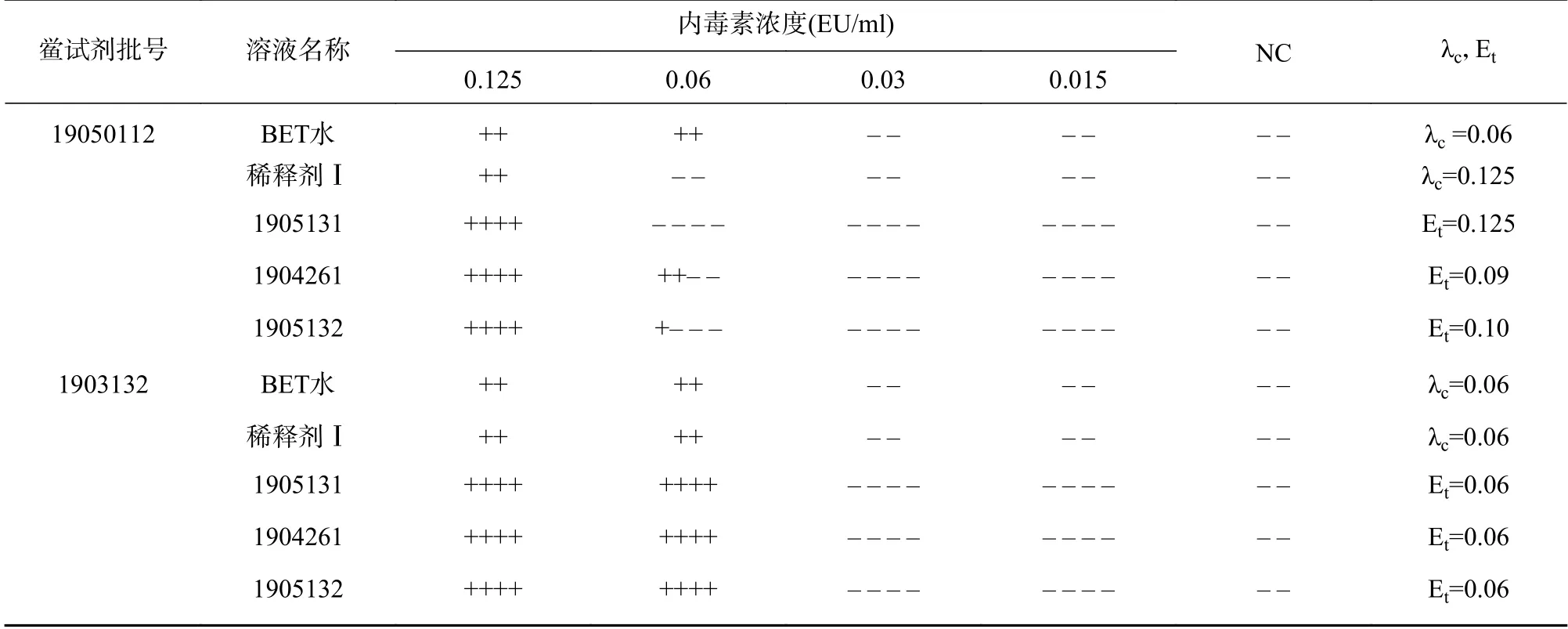
表4 稀释剂Ⅰ稀释维生素B6注射液干扰试验结果
按照上述(用稀释剂Ⅰ稀释)方法,用稀释剂Ⅱ进行干扰试验,结果见表5。
由表4和表5可知:平行3批次干扰试验中阴性对照溶液NC、稀释剂对照溶液ⅠNC(或ⅡNC)、供试品溶液NPC的所有平行管均为阴性,两个厂家鲎试剂标示灵敏度对照系列的结果λc在0.5~2 λ之间(包括0.5 λ和2 λ),符合灵敏度复核要求,试验有效。两个厂家鲎试剂干扰试验系列的结果(Et)为0.5~2 λ(包括0.5 λ和2 λ),符合规定。表明供试品稀释至1.04 mg/ml时,采用0.06 EU/ml的鲎试剂进行试验无干扰,可用于细菌内毒素检查。
2.5 供试品细菌内毒素检查
取灵敏度为0.06 EU/ml的鲎试剂,按本研究建立的检查法用两个厂家的鲎试剂对3批维生素B6注射液进行细菌内毒素常规检查。维生素B6注射液用稀释剂I和稀释剂Ⅱ进行供试品稀释和pH调节后,细菌内毒素检查结果相同,皆符合规定。结果见表6。

表5 稀释剂Ⅱ稀释维生素B6注射液干扰试验结果
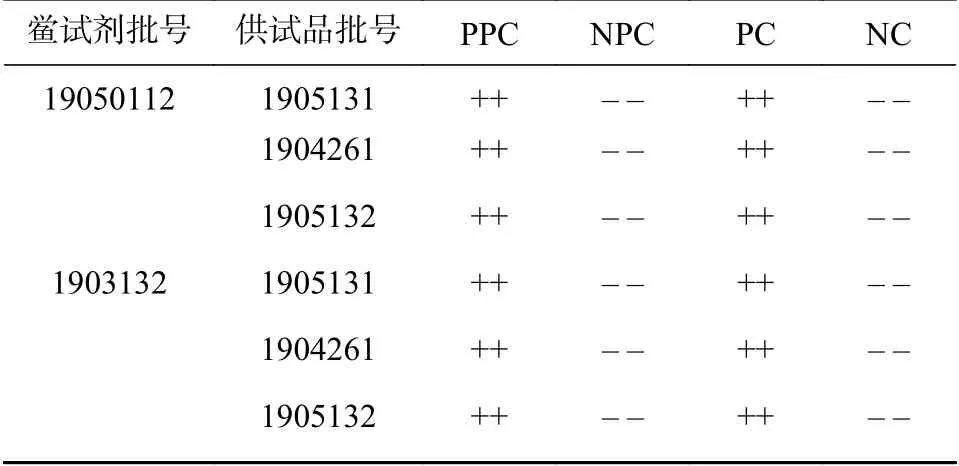
表6 维生素B6注射液细菌内毒素检查
3 讨论
《中国药典(二部)》2015年版收载的维生素B6注射液品种,内毒素的限值为每1 mg维生素B6中含内毒素的量应小于0.30 EU[8]。由于本供试品规格和浓度在《中国药典》2015年版中未涵盖,且由于本品说明书中的用量较大,根据说明书的用法用量及《注射剂安全性检查法应用指导原则》[9],计算出本品内毒素的限值为:每1 mg维生素B6中含内毒素的量应小于0.06 EU,比药典规定的限值提出了更高的要求,试验中需要切实解决干扰问题。
经过一系列试验摸索,最终以市售的湛江安度斯生物有限公司生产的镁离子缓冲液(pH6.5~7.5)和Tris缓冲液(pH6.5~7.5)对供试品进行稀释和pH调节。经预实验可知,将供试品稀释120倍以下对凝胶法内毒素检查存在抑制性干扰,稀释120倍及以上对凝胶法内毒素检查无干扰,并通过正式干扰试验得到验证。试验结果表明:以pH6.5~7.5缓冲液稀释本品至1.04 mg/ml,用灵敏度为0.06 EU/ml鲎试剂对供试品进行细菌内毒素检查,方法可行。
