对高考试题与教材中电极反应书写形式差异的探讨
2020-01-18余晓光
余晓光
摘要: 对电解时有水参与的电极反应的书写形式,在人教版及多种版本高中化学教材中表示的是水电离出的离子参与反应。而在近几年的高考试题中凡是要求书写电解时水参与的电极反应式的参考答案全部是以H2O直接放电来书写。对两种书写形式的差异产生的原因进行分析,同时也为教师的教学和高考命题提出合理化建议。
关键词: 电解; 电极反应; 高考试题; 教材
文章编号: 10056629(2020)12008404
中图分类号: G6338
文献标识码: B
1问题由来
对电解时有水参与的电极反应的书写形式,在人教版高中化学教材选修4《化学反应原理》的第四章第3节[1]中,电解饱和食盐水时阴极的电极反应书写为: 2H++2e-H2↑,表示是水电离出的H+参与了反应。在不同版本的高中化学教科书和各种教辅资料中对电解时有水参与的电极反应的书写形式,在讲解及归纳时都是以水电离出的H+或OH-参与反应来书写的。但是在近几年的高考试题中凡是要求写电解时水参与的电极反应式的参考答案全部是以H2O直接放电来书写的。
下面是近几年涉及到电解时水参与的电极反应式书写的高考试题。
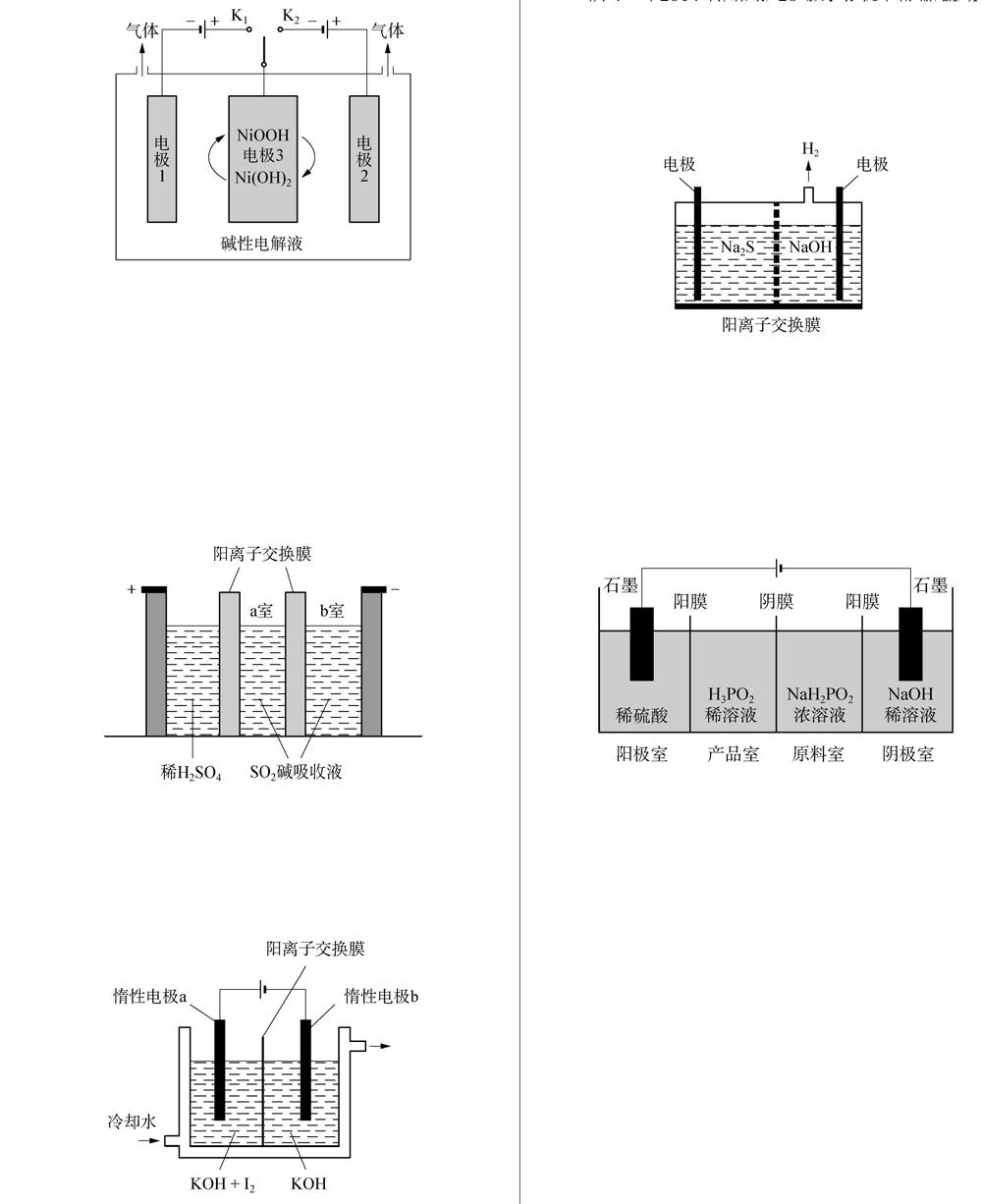
例1(2019北京卷27题,節选)可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。
制H2时,连接。产生H2的电极反应式是。
参考答案: K12H2O+2e-H2↑+2OH-
例2(2018新课标Ⅰ卷27题,节选)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为。
参考答案: 2H2O-4e-4H++O2↑
例3(2018新课标Ⅲ卷27题,节选)KIO3也可采用“电解法”制备,装置如图所示。
写出电解时阴极的电极反应式。
参考答案: 2H2O+2e-H2↑+2OH-
例4(2014江苏卷20题,节选)将烧碱吸收H2S后的溶液加入到如题20图1所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应: S2--2e-S, (n-1)S+S2-S2-n。
写出电解时阴极的电极反应式: 。
参考答案: 2H2O+2e-H2↑+2OH-
例5(2014新课标Ⅰ卷27题,节选)H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
写出阳极的电极反应式。
参考答案: 2H2O-4e-4H++O2↑
电解时有水参与的电极反应式的参考答案无一例外都以H2O放电来书写。并且在2018年湖北和湖南两省新课标Ⅰ卷27题最终的阅卷评分细则中提到只能写H2O放电,写成OH-放电0分,因为是硫酸的酸性溶液。而在2018年山东省的阅卷评分细则中写成H2O或OH-放电均给分。而更不可思议的是同样是湖北省在2014年新课标Ⅰ卷27题最终的阅卷评分细则中写成H2O或OH-放电均给分[2]。
高考试题与教材中电极反应书写形式的差异容易给高中教师和学生的教学活动带来困惑并造成干扰。教师按课本教、学生按课本学结果写出来的反应式却不能得分。
2教育部考试中心对参考答案的解释
教育部考试中心编写的《高考理科试题分析(2015年版)》[3]中对2014新课标Ⅰ卷27题第(4)小题参考答案的解释如下。
阳极室存在H2O、 SO2-4、 H+与OH-等物质。根据得电子难易程度,OH-优先在阳极得到电子发生反应:
4OH--4e-2H2O+O2↑
由于阳极室的电解质为稀硫酸,OH-浓度非常小,故阳极的电极反应式写成:
2H2O-4e-4H++O2↑
阴极室存在H2O、 Na+、H+与OH-等物质。根据失电子难易程度,H+优先在阴极失去电子发生反应:
2H++2e-H2↑
由于阴极室的电解质为NaOH溶液,H+浓度非常小,故阴极的电极反应式写成:
2H2O+2e-H2↑+2OH-
通过以上分析,不难得出阳极的电极反应书写的正确答案:
2H2O-4e-4H++O2↑
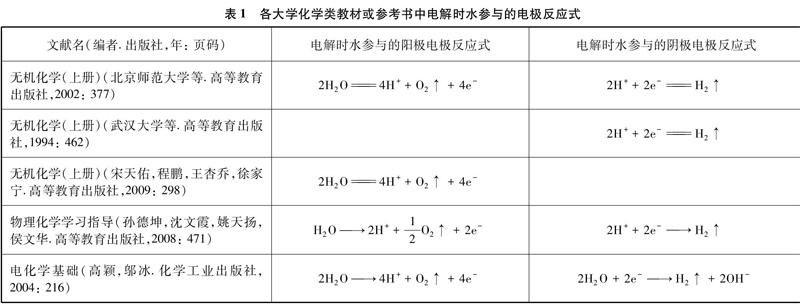
3大学化学类教材或参考书中对电解时水参与的电极反应的书写形式
对电解时有水参与的电极反应的书写形式的差异应该是来源于大学化学类教材对电极反应的书写形式的不同。笔者翻阅相关书籍,将各大学化学类教材或参考书中对电解时水参与的电极反应式表述如表1所示。
表1各大学化学类教材或参考书中电解时水参与的电极反应式
文献名(编者.出版社,年: 页码)电解时水参与的阳极电极反应式电解时水参与的阴极电极反应式
无机化学(上册)(北京师范大学等.高等教育出版社,2002: 377)2H2O4H++O2↑+4e-2H++2e-H2↑
无机化学(上册)(武汉大学等.高等教育出版社,1994: 462)2H++2e-H2↑
无机化学(上册)(宋天佑,程鹏,王杏乔,徐家宁.高等教育出版社,2009: 298)2H2O4H++O2↑+4e-
物理化学学习指导(孙德坤,沈文霞,姚天扬,侯文华.高等教育出版社,2008: 471)H2O2H++12O2↑+2e-2H++2e-H2↑
电化学基础(高颖,邬冰.化学工业出版社,2004: 216)2H2O4H++O2↑+4e-2H2O+2e-H2↑+2OH-
从上表可看出,这几本大学化学类教材或参考书中对电解时水参与的阳极电极反应式都是H2O放电,但对于电解时水参与的阴极电极反应式则写成H+或H2O放电。这就是在中学教材中电解饱和食盐水时阴极的电极反应书写为: 2H++2e-H2↑的根源。
但是在杨文治编著北京大学出版社出版的《电化学基础》中明确说两种写法都可以。书中提到电解饱和食盐水在阴极的铁/溶液界面上,Na+并不能放电,倒是浓度极小的H+首先在电场作用下放电了,形成氢分子逸出: 2H++2e-H2↑。在碱性溶液中H+很少,故H2O直接放电: 2H2O+2e-2OH-+H2↑,从热力学的角度,其效果与H+放电是一样的,在不涉及电极反应机理时,以下討论都采用H+放电的表达式。
而杨绮琴、方北龙、童叶翔编著中山大学出版社出版的《应用电化学》却根据氢在阴极析出的反应历程和氧在阳极析出的反应历程明确提出水放电时电极反应式中反应物要写成H2O。书中提到电解水工业中氢析出反应若在碱性溶液中,不是H3O+还原,而是H2O还原。在酸性溶液中氧析出反应为: 2H2O4H++O2↑+4e-,在碱性溶液中氧析出反应为: 4OH-2H2O+O2↑+4e-。
4教学思考
从各大学化学类教材或参考书中对电解时水参与的电极反应的书写形式可以看出,无论是写成离子放电或是水放电都是可以的。但高考试题与中学教材中电极反应书写形式差异确实给高中教师和学生的教学活动造成了干扰。那么在教学中如何尽可能排除这种干扰,既能让学生容易理解和接受,又能在高考中不失分。
若按中学教材中的书写方式,电解饱和食盐水时的阳极反应: 2Cl--2e-Cl2↑,阴极反应: 2H++2e-H2↑,则两极反应直接相加的离子方程式为2H++2Cl-电解H2↑+Cl2↑。这就让我们在教学过程中要向学生反复强调当水参与电极反应时,书写总反应的离子方程式时H2O要保留化学式,不能将两极反应式直接相加。学生很难理解为什么将两个半反应叠加不能得到正确的总反应式。另外,这种写法从电极反应无法直观地看出电解饱和食盐水时阴极区同时生成H2和NaOH。若是将阴极电极反应式写成2H2O+2e-H2↑+2OH-,则两极反应直接相加的离子方程式为2Cl-+2H2O电解H2↑+Cl2↑+2OH-。也能直接从阴极电极反应式看出H2和NaOH是同时在阴极产生的。
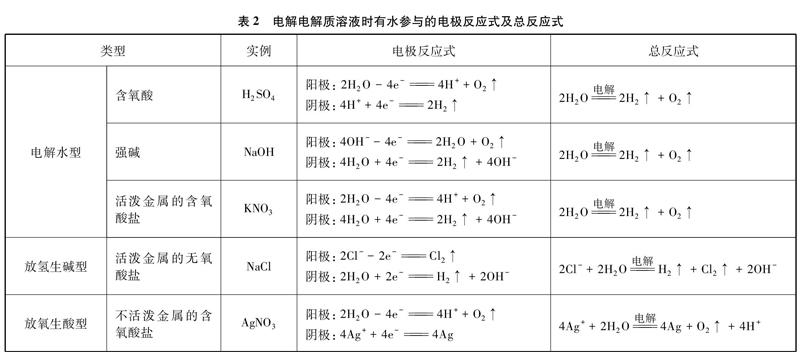
以此类推,凡是有水参与的电极反应均写成H2O放电的形式,归纳用惰性电极电解电解质溶液时有水参与的电极反应式及总反应式如表2所示。
当然,如果高考试题的参考答案能够根据高中教材及教学的实际情况,将电解时有水参与的电极反应式的参考答案写成两种(H2O放电或离子放电)就更好了。
参考文献:
[1]宋心琦主编. 普通高中课程标准实验教科书·化学反应原理[M]. 北京: 人民教育出版社, 2007: 81.
[2]连国华, 张神排. 2014年湖北高考理科综合(化学部分)评分细则[J]. 理科考试研究, 2015, (5): 38.
[3]教育部考试中心. 高考理科试题分析(2015年版)[M]. 北京: 高等教育出版社, 2015: 400.