GINS表达水平与肿瘤患者预后关系的meta分析
2020-01-18王世博柳晓金郑立恒高艳军
王世博, 柳晓金, 郑立恒, 高艳军
(1.河北医科大学第二医院感染控制处, 河北 石家庄 050000 2.河北省石家庄市第五医院感染科, 河北 石家庄 050041 3.河北省胸科医院检验科, 河北 石家庄 050041)
GINS复合物是真核生物复制叉的重要组成部分,在复制解旋中发挥重要的作用[1],其包括四个亚基,即 Psf1 , Psf2 , Psf3,Sld5,又分别被称为GINS1,GINS2,GINS3,GINS4。GINS在多种恶性肿瘤中高表达,并且与预后有一定的联系,利用GINS基因表达水平作为靶点预测肿瘤患者的发生,发展和预后有重要的意义[2]。然而研究结果由于研究对象、研究方法、研究条件以及统计方法等多因素差异的影响而存在一定的差异,本文拟通过meta分析对 GINS在恶性肿瘤预后中的整体风险进行评估,为后续临床研究提供依据。
1 材料与方法
1.1文献检索:计算机检索万方医学网、PubMed、维普数据库中从建库至2019年4月30日公开发表的关于GINS与肿瘤预后相关性的中英文文献。检索词包括:GINS,cancer,prognosis,检索策略:“GINS,cancer and prognosis”“GINS,cancer”“GINS, prognosis”。为避免文献遗漏,对相关参考文献进行扩展检索。
1.2纳入与排除标准:纳入标准:①国内外公开发表的有关GINS表达水平与恶性肿瘤患者临床预后关系的研究文献;②经病理科医师确诊为恶性肿瘤患者手术组织标本;③生存结局指标采用总生存期(OS)或无病生存期(DFS)来衡量;④文中报道了风险比(HR)和95%可信区间(CI),文中未报道的通过生存曲线间接计算出HR及95%CI。⑤检测方法采用qRT‐PCR或者免疫组化。排除标准:①文献综述、动物或细胞系研究;②文中未报道风险比(HR)及95%置信区间(CI)和未报道生存曲线;③GINS基因meta分析。若文献中报道了两个结局指标,作为独立研究分别进行数据提取。
1.3数据提取、文献质量评估:数据提取工作由2名研究者独立完成,主要包括:第一作者姓名、发表年份、国家、随访时间、检测方法、肿瘤类型、样本量、观察指标、HR及95%CI、NOS评分得分。运用Newcastle-Ottawa Scale量表对纳入文献进行质量评价。
1.4统计学方法:采用revman5.3软件进行meta分析,效应指标选取HR及95%CI,未提及HR及95%CI而提供生存曲线的文献,可通过图形数据提取软件Engauge Digitizer 4.1获取数据。并对资料进行异致性检验,各研究结果间异质性小采用固定效应模型(I2<50%,P≥0.05),异质性大采用随机效应模型(I2>50%,P≤0.05)。通过漏斗图评估发表偏倚。
2 结 果
2.1根据检索策略,初步检索获得相关文献126篇。阅读文章题目和摘要后,获得文献12篇。进一步阅读全文,最终纳入8篇文献,共1639例患者。文献检索流程如图1,纳入文献的基本特点,见表1。
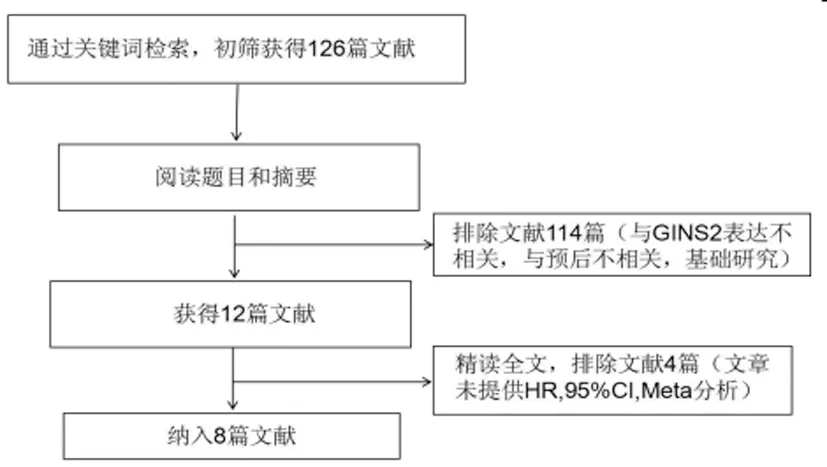
图1 文献检索流程图

表1 纳入文献基本特征
2.2Meta分析结果
2.2.1纳入8篇文献,其中7篇报道了GINS基因表达水平与OS的关系,纳入病例数为854例,Meta分析结果显示各研究结果之间无统计学异质性(P=0.07,I2=49%),故采用固定模型进行分析,结果显示高表达GINS基因的肿瘤患者OS显著缩短(HR=2.11,95%CI为1.43~3.10,P=0.0002),见图2,由此可见高表达GINS基因与OS缩短相关。
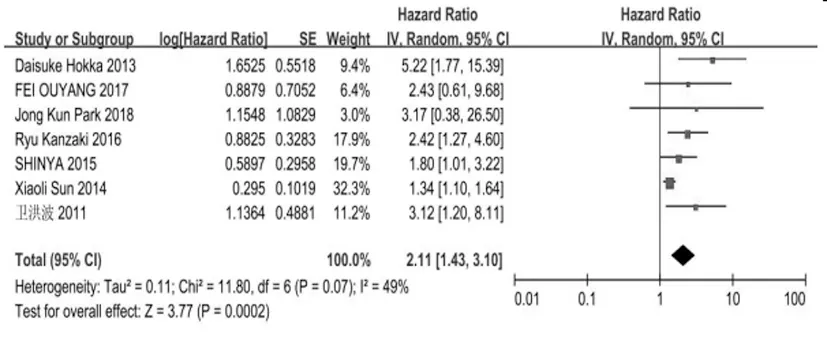
图2 GINS基因高表达与OS的关系的meta分析森林图
2.2.2纳入8篇文献,其中3篇报道了GINS基因表达水平与DFS的关系,纳入的病例数为991例,Meta分析结果显示各研究结果之间无统计学异质性(P=0.26,I2=26%),故采用固定模型进行分析,结果显示高表达GINS基因的肿瘤患者DFS显著缩短(HR=1.60,95%CI为1.38~1.86,P<0.00001),见图3,由此可见高表达GINS基因与DFS缩短相关。

图3 GINS基因高表达与DFS的关系的meta分析森林图
2.3发表偏倚7篇文献报道了GINS基因表达水平与OS的关系,漏斗图显示存在发表偏倚,见图4;3篇文献报道了GINS基因表达水平与DFS的关系,漏斗图显示存在发表偏倚,见图5。
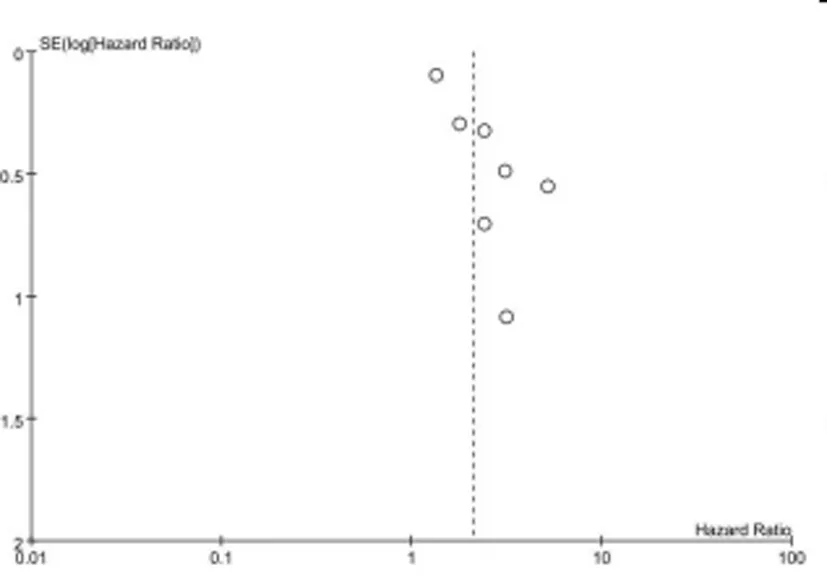
图4 检验发表偏倚的漏斗图

图5 检验发表偏倚的漏斗图
3 讨 论
GINS复合物是DNA复制过程起始和延长阶段的一个重要因素。文献报道GINS在多种恶性肿瘤中高表达并且促进肿瘤细胞的增殖[5]。本文研究发现GINS表达水平与肿瘤患者预后指标OS,DFS相关各文献报告结果间无明显异质性(P=0.07,I2=49%;P=0.26,I2=26%);故本文两个结局指标均采用固定模型进行分析。研究结果显示高表达GINS基因的肿瘤患者OS,DFS显著缩短,可见GINS基因高表达与肿瘤患者预后不良相关。针对发表偏倚可能的原因分析如下①纳入文献篇数较少,样本量小。②阳性结果的研究较容易发表,阴性结果由于投稿人缺乏投稿热情或者审稿人缺乏兴趣而不容易发表,由此会产生的对干预效果评价存在偏差。基于以上两点原因无法获取更详细的资料,无法控制一些混杂因素,对本次分析的HR值可能会产生一定的影响。
本文纳入各研究国家包括中国和日本,主要是亚洲人群相关研究,不包括欧美,非洲国家等人群,故本文研究结果不能反映全部人群GINS基因相关疾病的预后变化情况,势必对研究结果产生偏倚;纳入本次研究的肿瘤包括肺癌(70.7%),结直肠癌(12.6%),宫颈癌及子宫内膜癌(16.7%)几种类型,故不能反映全部肿瘤类型GINS基因变化对预后的影响。此外,本次研究结果受文献[6]影响较大,因其样本量较其他文献较多,因此有必要纳入更多的文献才能解决这个问题产生的影响。我们将密切关注相关文献,及时更新,对GINS表达水平与肿瘤患者预后关系得出更加科学,可靠的结论。
综上所述,GINS表达水平与肿瘤患者预后相关,即GINS高表达与肿瘤患者不良预后有一定的联系,随着GINS相关研究不断深入,GINS有望成为肿瘤患者预后靶标,为临床治疗提供新的思路。
