高通量dPCR基因芯片荧光激发测控系统的研制
2020-01-18李龙成孙刘杰陆春生
李龙成,孙刘杰,陆春生
(上海理工大学 出版印刷与艺术设计学院,上海 200093)
引 言
数字聚合酶链式反应(digital polymerase chain reaction, dPCR)[1]是20世纪90年代末提出的一种新型核酸绝对定量检测技术,dPCR技术是指将含有目标基因、引物、聚合酶等的溶液稀释后,分成几十到几十万份微小、独立的反应微液滴,每个微液滴中核酸模板数少于或者等于1个。每个反应微液滴完成聚合酶链式反应(PCR)扩增后对结果进行荧光检测,将含有目标基因的反应器标记为“1”(阳性),不含目标基因的反应器标记为“0”(阴性),根据相对比例,并利用泊松分布就能推算出原始溶液的核酸浓度[2]。dPCR技术检测步骤简单、可实现绝对定量,且检测过程中所需样本少、准确率高,具有高灵敏的单分子检测能力,是现有PCR技术中最适于疾病早期诊断的方法[3]。dPCR芯片广泛应用于肿瘤的早期诊断及个体化用药、胎儿遗传疾病的早期筛查、转基因食品监测和基因文库质量鉴定[4-8]等方面。dPCR基因芯片测控技术正在往大功率、大视场、低成本方向发展。
荧光激发是基因检测中示踪物标记常用手段,通过检测分析示踪物信号的分布及强弱得到靶分子的生物分子信息。目前市场上常见荧光激发设备中激发光源主要分为激光和LED两大类型,虽然以激光作为激发光源的激光共聚焦扫描荧光显微镜具有分辨率高和信噪比高等性能,但是在实际应用中激光会造成待检测样品损伤,对实验结果产生无法避免的干扰。同时以激光作为激发光源的系统扫描方式多为二维点扫描,大大限制了检测时间的缩短。以窄带LED为激发光源的荧光激发系统短时间内能够在视场中一次成像。同时以窄带LED为激发光源的设备与激光设备相比具有结构简单、成本低等显著优点,LED自身的冷光源属性不会对聚合酶链式反应热环境及检测结果产生影响。因此,在阅读大量国内外文献基础上,经过对比分析后,最终选择以大功率、窄带LED作为荧光激发光源展开系统的研发设计工作。
目前,国内外研究人员对以LED作为荧光激发光源的设备开展了许多研究。早在2011年10月,Biorad公司研发出公司第一代性能优异的QX100 PCR系统;2012年美国RainDance Technologies公司推出了RainDropTM数字PCR系统;2013年8月,Bio-rad公司研发出性能优异的QX100和QX200数字PCR系统;2016年日本的Yong等用无滤光荧光传感器检测亚微米浓度荧光染料溶液中的荧光。该无滤光荧光传感器具有光栅结构,可根据不同栅电压下的光电流计算激发强度和荧光灯强度。研制的无滤光荧光传感器对LED光源的激发光(470 nm)和荧光(530 nm)的分离能力为 1 200∶1[9]。
针对dPCR仪光电系统中以LED作为荧光激发光源的应用,国内高校范围内的研究人员也做出了多方面的探索。2012年北京工业大学李倩对生物芯片荧光检测中微体积高强度多LED集成技术与工艺进行了研究[10]。浙江大学对于LED在荧光激发领域的应用开展了深入研究:2011年王伟平等已经开始对96孔实时荧光定量PCR检测系统的开发进行研究,对LineGene9600实时荧光PCR检测系统的性能进行优化、提升[11];2011年徐灵艳开发了一套小型微流控芯片-环介导等温扩增反应实时浊度检测系统,通过该系统中对钨灯和白炽灯为代表的复色光源与激光、激光二极管(LD)、发光二极管(LED)进行对比研究分析[12];2015年,毛贺在《定量聚合酶链式反应荧光检测技术研究》中对光源激发主波长为470 nm的蓝光LED的荧光激发效果进行探索[13];2016年,袁茂凯等以LED作为荧光激发光源设计了一套稳定性高的专用LED驱动电路及其配套检测系统[3]。
为了解决dPCR基因芯片荧光激发及检测过程中激光激发光源成本高、荧光显微镜检测视场小、现有LED作为激发光源功率低等问题,本研究以上海市科学技术委员会地方院校能力建设项目为依托,设计了一套基于STM32微处理器进行控制的系统。系统以大功率、窄带LED作为激发光源,通过FAM、HEX和ROX三个荧光激发通道,可以一次性单通道完成较大视场内的基因芯片激发。该荧光激发系统具有多个独立激发通道、单通道LED激发功率大、激发功率可调节、系统热稳定性好、检测结果精准等显著优点。实验检测结果说明该系统能够多通道、快速实现dPCR基因芯片的荧光激发。
1 系统设计
1.1 测控系统架构设计
整个荧光激发系统的设计主要包含荧光激发光源系统、控制电路系统和通信系统三大模块,整个测控系统各个功能模块之间架构如图1所示。

图1 整个系统的架构设计Fig. 1 The architecture design of the whole system
1.2 荧光激发原理及光源系统设计
荧光激发过程中,当待检测分子的电子在吸收了特定波长的能量后,待检测分子的电子将从基态跃迁到激发态。处于激发态的分子为了从激发态回到基态,该分子会马上释放出能量,处于激发态的分子回到基态可以通过如图2所示几种途径。

图2 分子内激发与衰变过程Fig. 2 Intramolecular excitation and decay process
由于检测分子在S2的状态是极不稳定的,检测分子的电子会在10-9~10-7s的时间内重新回到基态,电子由第一激发跃迁到任意一个振动能级而发射的光量子称为荧光[14],通过配套的光电系统能够精准地检测到待检测分子中荧光标记物的分布和荧光强度。
如果固定测量荧光的某个发射波长,而不断改变激发光的波长,得到的荧光强度对激发波长的谱图即为荧光激发谱,荧光激发谱表明了荧光强度对激发波长的依赖关系[15]。荧光激发过程中结合诱导荧光技术,在激发光(通常为紫外线或低波长可见光)的照射下,吸收能量后的荧光分子变为激发态,处于激发态荧光分子为了回到基态将以辐射光量子的形式释放出能量并产生荧光信号[16]。
激发光源作为荧光激发系统的关键部分,目前市场上常见的dPCR系统设备中,主流的荧光激发光源分为激光和LED两大类型。作为可选光源的高压汞灯、高压氙灯、金属卤化物灯等传统的紫外激发源,以及高相干激光激发源,都具有体积大、成本高、寿命短的缺点[17]。因此,以激光作为激发光源的荧光激发系统一直未得到广泛应用,在国内完全依赖于国外进口。本系统以大功率、窄带LED作为激发光源,冷光源LED不会对PCR反应热环境产生干扰,而且窄带LED无需过滤便可直接发出单色光[13]。
整个系统设计时选取FAM、HEX和ROX三种常见荧光素作为dPCR反应过程中的荧光染料,根据FAM、HEX和ROX的激发光谱波长分布,分别选择主峰波长为465~480 nm的蓝光LED、主峰波长为520~535 nm的绿光LED、主峰波长为580~600 nm的黄光LED分别作为FAM、HEX和ROX通道的荧光激发光源。
根据图3中FAM、HEX和ROX激发通道对应荧光素的激发波谱及其所属LED光源的波谱分布,光源工作系统设计如图4所示。系统通过对FAM、HEX和ROX通道激发光源工作时间、激发光源功率等的调节可实现基因芯片反应产物的荧光激发。激发光源系统中FAM、HEX和ROX相邻两个通道的激发光源之间夹角为120°,通过相位开关控制激发光源各个通道交替工作,激发光源完成平台基因芯片各通道的荧光激发。

图3 各通道激发光源对应波谱分布Fig. 3 Spectral distribution of excitation light sources corresponding to each channel
1.3 系统的设计目标
为了解决dPCR以LED作为荧光激发光源的系统中功率小、系统自动化程度低、荧光检测光学设备复杂等问题,在研究过程中以半波宽(FWHM)小于10 nm的窄带LED作为系统激发光源。系统通过DC-DC转换电路设计实现整个工作电源的供给,电路的设计最大电流达8 A,各自独立通道的荧光激发光源功率可进行独立调节。其中FAM激发光源电路工作电流为350 mA,整个电路可调节最大功率为3 W;HEX激发光源电路工作电流为350 mA,整个电路可调节最大功率为 3W;ROX激发光源电路工作电流为350 mA,整个电路可调节最大功率为2 W,整个系统激发光源的调节精确度<1.0%。

图4 光源系统结构Fig. 4 Structure of light source system
2 系统实现
2.1 控制电路模块
整个测控系统以STM32F103RET6作为处理器,处理器通过PWM脉冲实现对应通道激发光源LED的调节。整个STM32外围电路主要由电压转换模块、激发光源控制模块、LED恒流驱动控制电路模块等组成。
为了使系统能够获得较大功率的恒流稳定电源,系统通过XL4016开关降压型DC-DC转换芯片实现整个工作电源的供给。系统转换电路的设计最大电流达8 A,为提升系统可靠性并对CCD光电系统设备起到保护作用,电路系统以TL431可控精密稳压源为基础设计了一套保护电路:当场效应晶体管(MOSFET-P)负载电压大于12.5 V时晶体管自动断开,避免因电压过大造成检测设备损坏。系统通过微处理器产生的PWM脉冲作用于大功率恒流驱动控制芯片(QX9920)实现整个激发光源系统的调节控制,部分控制系统的电路结构设计如图5所示。
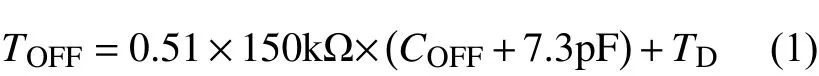
式中:TD为芯片固定关断延迟时间,值为61 ns。
LED的输出电流ILED由电流采样电阻RCS以及TOFF等参数设定,为


图5 系统 PWM 调光电路结构设计Fig. 5 PWM dimming circuit design of the system
式中:VLED为LED的正向导通压降;L1为电感值。在电路设计中为保证系统输出恒流,在功率电感的选择时必须保证流过LED的纹波电流值远小于流过LED通道的电流峰值,即:
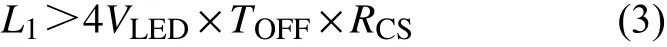
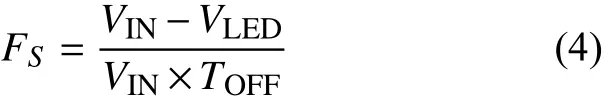
式中:VIN为芯片输入电压。
2.2 通信模块
如图6,整个测控系统的通信设计以PC为上位机,PC对接收到的传输数据进行快速分析、处理。系统通过微处理器连接的USB接口实现整个系统与上位机之间的通信。STM32F103-RET6自带512 kB FLASH,在上位机与下位机通信时间间隔内上位机PC端完成接收数据的处理。串口通信过程中通过上位机与下位机之间数据交互时间间隔、校验位和波特率等的设置来提升数据传输的稳定性和可靠性。
3 系统实现及实验结果
通过STM32F103RET6微处理器实现整个测控系统的控制,系统中QX9920PWM信号来源于微处理器定时器的三个通道,通过式(1)中电容值的选取,设定光源的关断时间。整个测控系统以STM32微处理器PA1、PA2、PA3 I/O端口分别作为FAM、HEX、ROX三个通道激发光源的控制信号来源。
经过试验测试,当系统PWM调光频率设定为250 Hz时,通过对TIM3_CH1~TIM3_CH3通道PWM占空比设置实现0~255共256个等级的调节控制。图7为STM32调制出占空比分别80%、70%和60%时的光源驱动电路逻辑分析图,实验结果表明系统调节精确度达0.4%。
图8为使用S1500-M-R(G)-CL CMOS相机进行的基因芯片荧光检测结果,系统在FAM、HEX、ROX三个通道下调整相机的曝光时间,完成对样品中三种荧光素对应荧光通道的拍摄。
根据FAM、HEX和ROX荧光通道的检测结果,S1500-M-R(G)-CL CMOS相机一次曝光可完成HEX通道视野中面积约为11.82 mm×7.88 mm的近3 800个微液滴荧光激发结果的检测。FAM通道激发源一次可完成9 600个微液滴的荧光激发。图9(a)中白色亮点处均为dPCR基因芯片HEX通道荧光激发结果成阳性的微液滴。图(a)中黄色线所在区域样品点对应灰度值分布直方图如图(b)所示,通过灰度分布直方图中峰值对比分析能准确辨别各荧光激发结果为阳性的微液滴位置分布。灰度值分布图的生成和应用能够为后期的光电系统检测、目的基因识别提供精准的样本信息。
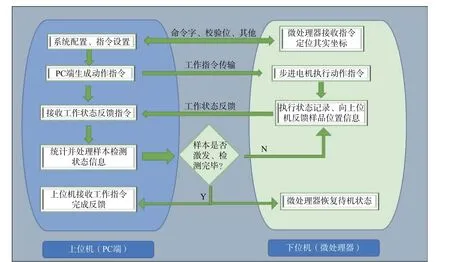
图6 系统通信组织架构Fig. 6 System communication structure
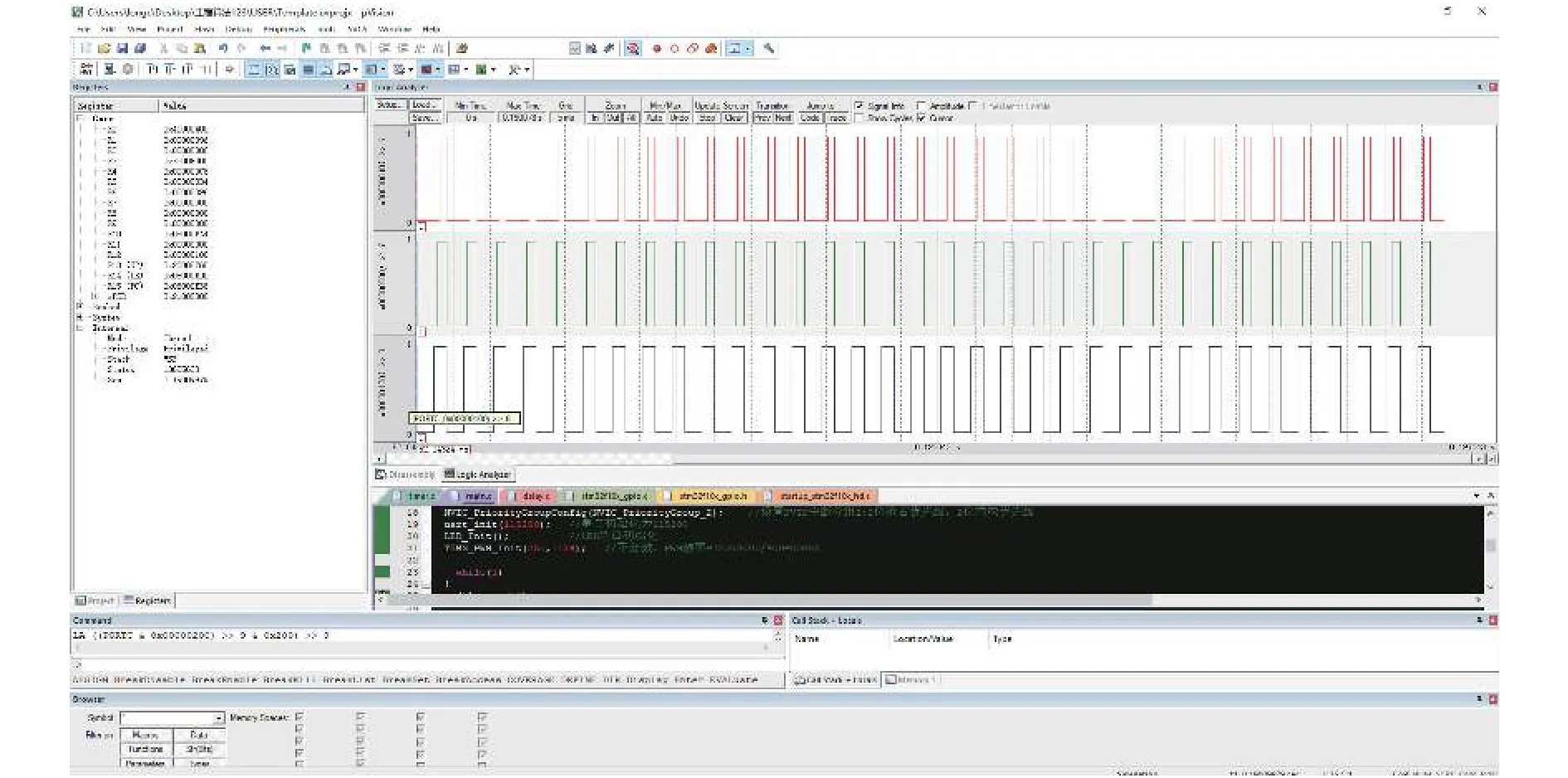
图7 光源驱动电路逻辑分析图Fig. 7 Logic analysis diagram of light source driving circuit

图8 各通道荧光检测结果成像Fig. 8 Imaging of fluorescence detection results of each channel

图9 荧光激发效果检测Fig. 9 Detection of fluorescence excitation
4 结 论
本文基于STM32微处理器设计了一套高通量dPCR基因芯片荧光激发测控系统,该系统选取窄带LED作为激发光源,FAM、HEX和ROX互相独立的荧光激发通道设计简化了PCR反应产物荧光激发结果的繁琐分析过程。系统激发光源部分最大输出电流可达8 A,调节精确度达0.4%,最大输出功率3 W。测试实验结果表明系统一次可实现dPCR基因芯片9 600个微液滴的荧光激发,满足dPCR基因芯片的高通量和荧光激发的设计需求。该系统具有多个独立激发通道、单通道LED激发功率大、激发功率可调节、系统热稳定性好、检测结果精准等显著优点,该系统的成功实现可为dPCR基因芯片领域工作人员节省大量时间成本和人力成本。
此外,本设计系统中,基于STM32微处理器的系统功能仍有许多可以拓展的地方。如利用STM32的强大功能提升整个荧光激发系统智能化程度,同时系统可以采用无线通信的方式,以此为基础开发出便携式的基因芯片使用设备,进而扩宽dPCR基因芯片技术的实际应用领域。
