细胞外基质硬化通过PLCB2促进血管平滑肌细胞迁移
2020-01-17阎岩史承勇朱志军丁雪燕
阎岩 史承勇 朱志军 丁雪燕
血管性疾病作为累及全身重要脏器的系统性病症,最终可导致急性心肌梗死、脑卒中、晚期肾病等,具有较高的致死率。血管壁的细胞外基质(ECM)主要是由胶原蛋白和弹力纤维蛋白等多种成分构成的复杂动态结构[1]。动脉硬化度取决于血管ECM 中胶原蛋白与弹力纤维蛋白的比例。受年龄增加和高血压等因素的影响,血管胶原/弹力纤维蛋白比例升高,ECM 硬度增加,血管壁弹力板退化,内中膜增厚,导致动脉壁硬化和管腔狭窄[2]。在此过程中,血管平滑肌细胞(VSMC)感知其周围ECM 硬度的增加,合成、增殖和迁移能力增强,引起内膜和中膜重塑[3-4]。2018 年1 月至2019 年4 月作者通过实验研究,探讨细胞外基质硬化对VSMC 迁移的影响。
1 材料与方法
1.1 芯片数据获取及GSEA 富集分析 自NCBI 中的GEO 数据库下载GSE100081 表达矩阵数据。其中,样本GSM2670937~GSM2670940(n=4)和GSM2670941~ GSM2670944(n=4)分别为病理硬度基质和生理硬度基质中培养的人冠状动脉平滑肌细胞(HCASMC)的RNA-seq 数据。采用GSEA3.0 版软件,利用网站MsigDB 数据库中c2.cp.reactome.v6.2.symbols.gmt 数据集,按照默认加权富集统计方法,设置随机组合次数为1000 次,进行富集分析。结果中P<0.01,NES 绝对值>1.0,且错误发现率(FDR)<20%的基因集判定为显著富集。
1.2 人冠状动脉平滑肌细胞(HCASMC)的培养 HCASMC 及培养基均购自PromoCell 公司。细胞复苏后,在37℃、5% CO2培养箱中用平滑肌细胞生长培养基(SMCGM2)培养。更换培养液1 次/2d,每3~4 天用0.25%胰酶消化传代。取5~8 代、经血清饥饿处理24h 的细胞用于实验。实验细胞分别接种于弹性指数4KPa(Soft 组)和25KPa(Stiff 组)的6 孔弹性培养板(Softwell,Matrigen 公司),模拟生理和病理性细胞外基质硬度对HCASMC 的影响。
1.3 实时定量聚合酶链反应(qRT-PCR) 采用Trizol 法提取RNA。凝胶电泳检测RNA 纯度后, 按Primescript RT 逆 转 录 试 剂 盒(TaKaRa 公司)步骤行逆转录合成cDNA。根据SYBR Premix Ex Taq 试剂盒(TaKaRa 公司)说明书配制20μl反应体系进行qRT-PCR 反应,每个样本设3 复孔。 实验所用的引物序列:PLCB2 上游引物:5'-ACCTTCCACAACTTCGTCTCC-3', 下 游 引 物:5'-GGATGTTTGACTAGGGCCAGT-3';GAPDH 上游引物:5'-TGTGGGCATCAATGGATTTGG-3',下游引物:5'-ACACCATGTATTCCGGGTCAAT-3'。
1.4 Western blot 检测蛋白表达 在6 孔板中加入1ml SDS 裂解液,充分裂解细胞,提取总蛋白。采用BCA法测定收集到的上清液浓度,并据此配平各样品,以保证每孔上样30μg 蛋白。经8%SDS-聚丙烯酰胺凝胶电泳后,电转移至PVDF 膜上。在5%脱脂奶粉中室温封闭1h 后,4℃下孵育一抗过夜。TBST 缓冲液洗膜3 次后,室温下孵育二抗1h。采用增强型化学发光试剂(ECL)化学发光法进行检测。使用Image J 软件定量蛋白质条带。
1.5 干扰RNA 的合成和转染 干扰RNA 的设计,合成及化学改性由吉玛公司完成。采用lipofectamine 2000 试剂盒,分别将PLCB2 特异性干扰RNA(siPLCB2)和阴性对照干扰RNA(siScramble)转入病理性外基质硬度培养的HCASMC。转染12h 后更换培养液,48h后进行实验。
1.6 平板划线实验 取各转染组细胞,用200μl 移液器枪头在板底中央做出划痕,无菌PBS 缓冲液洗板底3 次,去除划掉的细胞残渣。分别在划痕后0h 和24h取样拍照。以0h 的细胞划痕宽度为基准画两条直线,计数24h 时迁移至2 条直线间的细胞个数,作为迁移能力的定量指标。
1.7 颈动脉内膜损伤模型 选取体重20~25g 的C57BL/6 雄性野生型小鼠,分为颈动脉损伤+siPLCB2转染组(n=10)和颈动脉损伤+ siScramble 转染组(n=10),对侧血管作为正常对照。小鼠麻醉后,取颈部正中切口,暴露左颈总动脉,用血管夹暂时阻断血流,再将结扎线置于血管近心端备用。显微剪剪开颈动脉,插入0.38mm 金属导丝,旋转进退摩擦血管壁,造成颈总动脉损伤。退出导丝,结扎近心端。结扎后在损伤段血管周围局部注射100μl 含有10μg siRNA的Pluronic 凝胶。将对侧血管作为假手术组,除不进行导丝损伤外,其余操作相同。术后14d 取出颈总动脉,4%多聚甲醛固定、切片后行HE 染色。利用计算机图形分析系统检测血管内膜和中膜面积,计算内膜/中膜(I/M)面积比。
1.8 统计学方法 采用SPSS 19.0 统计软件。计量资料以()表示,两组间比较采用t 检验,P<0.05为差异有统计学意义。
2 结果
2.1 GSEA 富集分析 GSEA 富集分析发现,差异表达的基因在Gβγ信号通路(P<0.001,FDR=0.17)和PLC-β 介 导Gβγ信 号 通 路(P<0.001,FDR=0.12)两个基因集中显著富集(见图1A),其中PLCB2 的表达在病理硬度基质培养的HCASMC 中显著上调(logFC=2.78,P<0.001)(见图1B)。

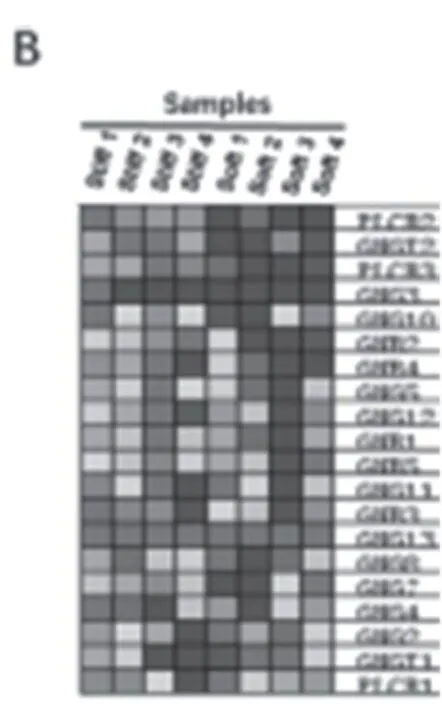
图1 GSEA富集分析
2.2 ECM 硬 化 上 调HCSMC 中PLCB2 表达 为进一步明确ECM硬化对HCASMC 中PLCB2 表达变化的作用,分别在生理性ECM 硬度(Soft)和病理性ECM 硬度(Stiff)中培养HCSMC。qRT-PCR 结果提示Stiff 组中PLCB2 mRNA 的表达量显著上调(P<0.001,见图2A),Western Blot 结 果 也 发 现Stiff 组中PLCB2 蛋白水平显著高于Soft 组(P<0.001,见图2B)。
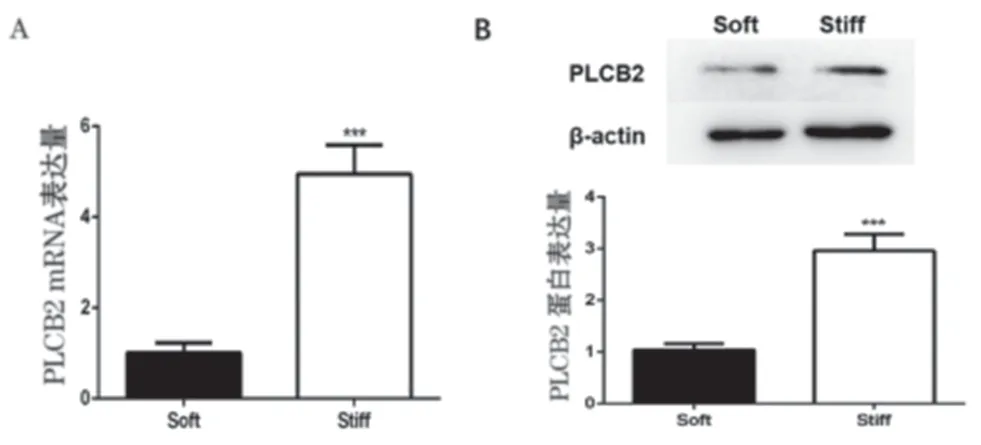
图2 两组HCSMC中PLCB2表达比较
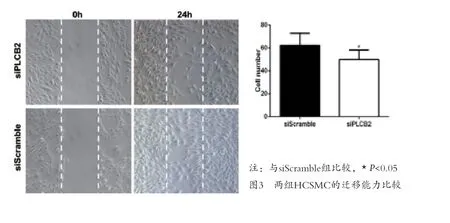
图3 两组HCSMC的迁移能力比较
2.3 PLCB2 对硬化基质中HCSMC 迁移的影响 应用干扰RNA 敲低硬化基质培养HCASMC 中PLCB2的表达(siPLCB2),与对照组(siScramble)比较,HCSMC 的迁移能力显著减弱,差异有统计学意义[(62.33±4.32)VS(49.83±3.4),P=0.046]。见图3。2.4 PLCB2 对颈动脉内膜损伤后新生内膜的影响 构建小鼠颈动脉内膜损伤模型的同时抑制PLCB2 在损伤动脉段的表达,14d 后观察实验组和对照组小鼠颈动脉内膜。siPLCB2 转染组与同一时间的siScramble 组比较,颈动脉内膜增生受到明显抑制,新生内膜面积显著减少[(siPLCB2 组新生内膜面积:(4.43±0.64)×103μm2,I/M:(0.21±0.03);siScramble 组 新 生 内膜面积:(23.82±1.43)×103μm2,I/M:(1.18±0.06)]。见图4。
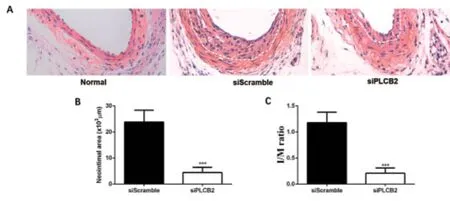
图4 两组新生内膜比较
3 讨论
各种原因导致的血管阻塞性疾病均伴随着VSMC迁移、增殖异常活跃和ECM 成分的过度沉积[5]。动脉血管壁内VSMC-ECM 的相互作用在维持血管壁稳态过程中发挥重要作用。研究发现,ECM 硬度能够影响干细胞的分化方向,不同ECM 硬度条件培养下的间充质干细胞将会向神经源性细胞、肌源性细胞和成骨细胞等不同的方向分化[6]。近年来研究发现,VSMC可感知动脉硬化病程中ECM 硬度的增加并响应性出现表型转化,表现为增殖、迁移能力增强,同时合成分泌功能活跃,进一步促进血管ECM 重塑[7]。
本研究通过分析病理和生理性ECM 硬度条件下培养的HCASMC 表达谱芯片数据,发现差异表达的基因在Gβγ信号通路和PLC-β 介导的Gβγ信号通路两个基因集中显著富集,且两个信号通路中的关键分子PLCB2 表达显著上调。进一步细胞学实验也证实,病理性ECM 硬度能够明显上调HCASMC 中PLCB2 的蛋白水平。PLC-β 是磷脂酶C 的β 型同工酶,存在PLCB1~4 共4 种分子亚型。有研究报道PLCB1 和PLCB3 亚型广泛存在于多种细胞类型中,而PLCB2 仅在机械力敏感的细胞内表达[8],提示其在细胞响应周围环境机械力学信号方面发挥重要作用。作者采用弹性指数25Kpa 的特制培养板刺激HCASMC,模拟血管硬化状态下病理性ECM 硬度,结果发现PLCB2 mRNA和蛋白水平均显著上调,表明HCASMC 在感知周围异常增高的ECM 硬度后反应性的上调PLCB2 表达,提示其在VSMC 响应ECM 硬化过程中起关键作用。
本研究通过细胞划痕实验发现敲低PLCB2 表达能够明显抑制病理性ECM 硬度对HCASMC 的促迁移作用。既往研究显示,颈动脉内膜损伤能够引起血管ECM 硬化、新生内膜形成和管腔狭窄[9]。因此,为进一步明确PLCB2 对VSMC 迁移的影响,构建小鼠颈动脉内膜损伤模型并通过外膜转染PLCB2 特异性干扰RNA,结果发现siPLCB2 可明显抑制损伤后新生内膜的形成。作为PLC-β 的重要亚型,PLCB2 通过水解磷脂酰肌醇4,5 二磷酸(PIP2),产生第二信使分子二乙酰甘油(DAG)和三磷酸肌醇(IP3)。IP3 可进一步作用于胞内敏感的Ca2+储存库,使胞内Ca2+浓度增加,而DAG 又可激活蛋白激酶C。因此,PLCB2 的表达上调可通过多种途径发挥生理效应,而其参与ECM硬化条件下VSMC 过度迁移的具体机制有待今后深入研究。
综上所述,病理性ECM 硬度可上调VSMC 中PLCB2 的表达,干扰抑制PLCB2 能够有效抑制VSMC的过度迁移,减轻新生内膜的形成。该研究结果加深了对血管基质硬化调控VSMC 功能的了解,为动脉硬化的诊断和治疗提供新的潜在靶点。
