长链非编码RNA OR3A4在非小细胞肺癌中的作用及其机制探讨
2020-01-17李珊珊顾文超
李珊珊 顾文超
肺癌是全球最常见的恶性肿瘤,也是导致癌症死亡的主要原因。据估计,2018 年全球新增病例为2093876 例,死亡人数为1761007 人[1]。肺癌的主要组织学亚型是非小细胞肺癌(NSCLC),主要包括腺癌和鳞状细胞癌,约占肺癌的80%[2]。虽然近年来NSCLC 的临床治疗取得了越来越多的进展,但NSCLC患者的总体生存时间并未显著提高。因此,揭示非小细胞肺癌发生、发展的潜在分子机制,以开发新的非小细胞肺癌治疗策略具有重要意义。近年来,非编码RNA(non-coding RNA,ncRNA)因其丰富的调控手段在基因转录后调节中的作用越来越受到重视,其中长链非编码RNA(lncRNA),一类长度>200 个核苷酸、编码能力有限的非编码转录产物,逐渐引起了人们的关注。研究发现lncRNA 在多种人类肿瘤中异常表达,在生物过程发挥重要作用,包括生长、细胞分化、增殖、凋亡和侵袭,发挥促癌或者抑癌基因的重要作用[3]。一些lncRNA 被报道在NSCLC 中具有致癌或抑制肿瘤的作用[4-5]。lncRNA OR3A4 是新近发现的一种lncRNA,在乳腺癌和胃癌中表达上调,促进癌症的发生发展[6]。然而,lncRNA OR3A4 在NSCLC 中的表达、作用及作用机制尚不清楚。本研究旨在探讨RNA OR3A4 在NSCLC 中的作用和机制,报道如下。
1 材料和方法
1.1 临床标本和伦理声明 在患者知情同意的情况下,经浦东新区人民医院伦理委员会按照国际标准批准,从浦东新区人民医院获得30 对NSCLC 组织及相邻非癌性肺组织样本。另外,10 例NSCLC 骨转移组织也取自浦东新区人民医院手术的NSCLC 患者。所有患者术前均未接受放疗或化疗。组织标本冷冻保存于- 80℃冷冻箱。
1.2 细胞培养和转染 人NSCLC 细胞株(A549、SPC-A1、H1299 和SK-MES-1)和HEK293T 细 胞 购自中国科学院细胞库(上海),PC-9 细胞和人支气管上皮(HBE)细胞购自ATCC(马纳萨斯,弗吉尼亚州,美国)。用DMEM 或RPMI1640 培养基培养NSCLC 细胞株。使用Lipofectamine 2000 按照制造商的协议进行细胞转染。
1.3 qRT-PCR 分析 使用TRIzol®试剂从组织或细胞中提取总RNA。采用PrimeScript™RT 试剂试剂盒(TaKaRa,大连,中国)合成互补DNA,采用SYBR预混料Ex Taq II(TaKaRa)进行qRT-PCR 分析。β-actin作为标准化的对照。采用2-ΔΔCT方法计算相对基因表达水平。
1.4 Western blot 实验 用RIPA 缓冲液制备细胞裂解液。在10%凝胶上用SDS-PAGE 分离等量的蛋白质,并转移至聚偏氟乙烯膜上,然后用5%脱脂牛奶封闭1h。在4℃下用一级抗体将细胞膜培养过夜。使用的主要抗体如下:KLF6(Proteintech,武汉,中国)和β-actin(Proteintech)。将二抗37℃孵育1h 后,用增强的化学发光系统检测观察条带。
1.5 质粒构建和细胞转染 针对(shOR3A4)和阴性对照(shCtrl)的特异性shRNA 寡核苷酸购自上海吉玛制药技术有限公司。将编码OR3A4 的互补DNA 经PCR 扩增后插入pcDNA3.1(Invitrogen)中。细胞转染采用Lipofectamine 2000 进行。
1.6 细胞增殖检测 使用CCK-8 试剂盒评估细胞增殖能力。在96 孔板中每孔接种2000 个转染细胞,在不同时间点(接种后1d、2d、3d 和4d)检测细胞活力。在490nm 处用分光光度微平板阅读器测定吸光度。平板克隆形成实验:将转染后的细胞接种于6 孔板(1×103/孔)中,连续培养10d。更换培养基1 次/3d。实验结束时,用4%多聚甲醛固定细胞,结晶紫染色。在显微镜下计算细胞克隆数量。
1.7 细胞凋亡测定 采用Annexin V-Alexa Fluor 647/ PI 凋亡检测试剂盒检测细胞凋亡。转染细胞用胶原酶消化,收集细胞,用annexin V-Alexa Fluor 647 和PI在室温下染色15min。流式细胞仪检测细胞凋亡率。
1.8 细胞迁移实验 收集转染细胞,以每孔1×105个细胞的密度接种至上腔室。下室加入含有10% FBS 的500μl 细胞培养基。12h 后,用棉签取出细胞膜上表面的细胞。然后用甲醛固定下层细胞,用结晶紫染色30min。迁移细胞的数量在显微镜下计数。
1.9 细胞侵袭实验 将各室加入稀释后的基底基质凝胶37℃下聚合30min。转染细胞以2×105个细胞/孔的密度接种于上腔室。下室加入含有10% FBS 的500μl 细胞培养基。这些细胞被允许进入下膜24h。随后,用棉签取出细胞膜上表面的细胞。然后用甲醛固定下层细胞,用结晶紫染色30min。在显微镜下计数细胞迁移数。
1.10 体内实验 动物实验是在动物研究机构委员会的批准下进行的,严格按照美国国立卫生研究院实验室动物护理和使用指南中的建议。雌性athymic BALB/c 小鼠(5 周龄)购自河南实验动物中心(郑州,中国),在特定的无致病性条件下培养。将稳定表达shCtrl 或shOR3A4 的A549 细胞(1×106)或稳定表达Ctrl 或OR3A4 的H1299 细胞(1×106)皮下注射于裸鼠侧翼两侧(n=6 只/组)。测量肿瘤体积1 次/5d,计算公式为体积=(长×宽×0.5)。25d 后小鼠被处死,并对肿瘤进行称重。
1.11 统计学分析 采用GraphPad Prism(Version 5.0,GraphPad Software,Inc)软件。计量资料以()表示,组间比较采用t 检验或方差分析(one-way ANOVA)。P<0.05 为差异有统计学意义。
2 结果
2.1 OR3A4 在NSCLC 细胞系和组织中表达上调 为了探讨OR3A4 在NSCLC 中的作用,采用qRT-PCR检测了30 对NSCLC 组织样本及相邻非癌性肺组织中OR3A4 的表达情况。OR3A4 在NSCLC 组织标本中的表达明显高于邻近非癌性肺组织标本(P<0.05)(见图1A)。此外,作者收集了10 例NSCLC 骨转移组织,并测定了OR3A4 的表达。结果显示OR3A4 在骨转移组织中的表达高于原发性NSCLC 组织(P<0.05)(见图1B)。此外,与HBE 细胞比较,OR3A4 在NSCLC 细胞 株(A549、SPC-A1、PC-9、SK-MES-1 和H1299)中的表达较高(P<0.05)(见图1C)。

图1 OR3A4在NSCLC组织样本和细胞系中上调。A:OR3A4在30对NSCLC和非癌性肺组织样本中的表达的定量分析,与正常相比较,*P<0.05。B:OR3A4在30个原发性NSCLC组织和10个骨转移组织样本中的表达的定量分析,与原发性NSCLC比较,*P<0.05。C:定量OR3A4在NSCLC细胞系和正常HBE细胞中的表达,与HBE组比较,*P<0.05。
2.2 下调OR3A4 表达抑制NSCLC 细胞增殖、侵袭和迁移 为了研究OR3A4 在NSCLC 中的作用,使用shRNA 下调了OR3A4 在NSCLC 细胞中的表达。qRTPCR 验证了基因沉默的有效性(见图2A)。用CKK-8法和平板克隆形成实验测定了A549 细胞的增殖能力。结果表明,下调OR3A4 表达可显著抑制A549 细胞的增殖速率(见图2B)。菌落形成实验结果表明,与对照组比较,下调OR3A4 的A549 细胞形成的菌落明显减少(见图2C)。作者用流式细胞术测定了OR3A4的下调对A549 细胞凋亡的影响。如图2D 所示,在A549 细胞中,OR3A4 敲低显著增加了凋亡细胞的百分比。然后在体外评估了OR3A4 敲低对NSCLC 细胞转移潜能的影响。Transwell 迁移实验结果显示,与对照组比较,OR3A4 敲低组的细胞迁移更少(见图2E)。此外,基质凝胶侵入的结果实验表明,OR3A4 敲低也抑制了A549 细胞的侵袭能力(见图2F)。

图2 OR3A4敲低抑制NSCLC细胞的增殖、侵袭和迁移。A:qRT-PCR分析转染shCtrl 和shOR3A4的A549细胞中OR3A4的表达。B:采用CCK-8法测定shCtrl 和shOR3A4两组的细胞增殖能力。C:检测shCtrl 和shOR3A4两组的细胞克隆形成能力。D:流式细胞术分析shCtrl和shOR3A4转染的A549细胞的凋亡情况。E:采用Transwell迁移实验检测下调OR3A4表达后A549细胞的迁移能力。F:采用基质凝胶侵袭法对转染shOR3A4的 A549细胞进行侵袭性检测。与ShCtrl组比较,*P<0.05。
2.3 上调OR3A4 表达促进NSCLC 细胞增殖、侵袭和迁移 使用pcDNA3.0 上调了OR3A4 在NSCLC 细胞中的表达。qRT-PCR 验证了基因沉默的有效性(见图3A)。用CKK-8 法和平板克隆形成实验测定了H1299细胞的增殖能力。结果表明,上调OR3A4 表达可明显促进H1299 细胞的增殖速率(图3B)。菌落形成实验结果表明,与对照组比较,上调OR3A4 的H1299 细胞形成的菌落明显增加(见图3C)。作者用流式细胞术测定了OR3A4 的上调对H1299 细胞凋亡的影响。(如图3D)所示,在H1299 细胞中,OR3A4 过表达显著降低了凋亡细胞的百分比。然后在体外评估了OR3A4过表达对NSCLC 细胞转移潜能的影响。Transwell 迁移实验结果显示,与对照组比较,OR3A4 过表达组的细胞迁移增加(见图3E)。此外,基质凝胶侵入的结果实验表明,OR3A4 过表达也促进了H1299 细胞的侵袭能力(见图3F)。
2.4 下调OR3A4 表达抑制NSCLC 肿瘤生长,但上调其表达促进NSCLC 肿瘤生长 为进一步证实OR3A4在NSCLC 中的生物学作用,将稳定转染shCtrl 或shOR3A4 的A549 细胞,或稳定转染Ctrl 或OR3A4的H1299 细胞皮下注射到裸鼠体内。测量肿瘤体积1次/5d,并进行肿瘤注射25d 后称重。结果表明,与shCtrl 组比较,OR3A4 的下调显著抑制了体内肿瘤的生长,包括平均肿瘤体积(见图4A)和体重(见图4B);OR3A4 的上调明显促进了体内肿瘤的生长,包括平均肿瘤体积(见图4C)和体重(见图4D)。
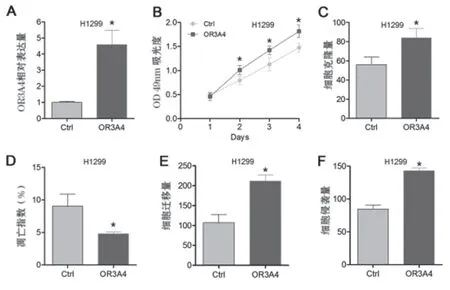
图3 OR3A4过表达促进NSCLC细胞的增殖、侵袭和迁移。A:qRT-PCR分析转染OR3A4过表达质粒以及空白质粒的H1299细胞中OR3A4的表达。B:采用CCK-8法测定Ctrl和OR3A4转染的H1299细胞的细胞增殖能力。C:检测Ctrl 和OR3A4两组的细胞克隆形成能力。D:流式细胞术分析Ctrl和OR3A4转染的H1299细胞的凋亡情况。E:采用Transwell迁移实验检测过表达OR3A4表达后H1299细胞的迁移能力。F:采用基质凝胶侵袭法对转染OR3A4过表达质粒的 H1299细胞进行侵袭性检测。与Ctrl组比较,*P<0.05。

图4 下调OR3A4抑制NSCLC肿瘤生长,上调OR3A4则促进NSCLC肿瘤生长。A:将稳定表达shCtrl或shOR3A4的A549细胞皮下注射于裸鼠,测量肿瘤体积1次/5d。B:肿瘤重量。C:将稳定表达Ctrl或OR3A4的H1299细胞皮下注射于裸鼠,测量肿瘤体积1次/5d。D:肿瘤重量。与Ctrl组比较,*P<0.05。
2.5 OR3A4 通过抑制KLF6 表达影响NSCLC 细胞生物学功能 已有报道OR3A4 通过抑制KLF6 促进卵巢癌的转移[7]。KLF6 在NSCLC 中具有抑癌作用[8]。因此,作者首次研究OR3A4 是否也调控NSCLC 中KLF6的表达,以及OR3A4 在NSCLC 中的致癌作用是否依赖于KLF6 的调控。采用qRT-PCR 和western blot 检测KLF6 在OR3A4 稳定过表达的H1299 细胞和OR3A4敲低的A549 细胞中的表达。结果显示KLF6 过表达下调了PXN mRNA 和蛋白水平,而敲低OR3A4 表达后上调PXN mRNA 和蛋白水平。另外,在OR3A4 过表达的H1299 细胞中转染KLF6 过表达载体明显抑制了OR3A4 对细胞增殖、侵袭和迁移的促进作用,而在shOR3A4 敲低的H1299 细胞中转染KLF6 敲低载体显著抑制了OR3A4 对细胞增殖的抑制作用。提示OR3A4 在NSCLC 中的促癌作用至少部分依赖于KLF6的负向调控。
3 讨论
在过去的十年中,各种lncRNA 被发现在癌症的发病机制中发挥着重要的作用[9-10]。在本研究中,作者发现OR3A4 在NSCLC 组织和细胞株中表达上调。OR3A4 过表达促进NSCLC 细胞增殖、迁移和侵袭,而下调OR3A4 表达则抑制NSCLC 细胞增殖、迁移侵袭和肿瘤生长。另外,进一步证明了OR3A4 在NSCLC 中的作用可能通过抑制KLF6 表达。结果表明OR3A4 在NSCLC 中发挥致癌作用。
本资料数据表明,OR3A4 的表达上调可能有助于NSCLC 的进展,这在其他癌症中也有类似的发现。Li等[11]证明OR3A4 通过调控AGGF1/akt/mTOR 通路参与肝细胞癌血管生成,证实OR3A4 是肝癌进展和血管生成的促进剂。在胃癌中,过表达OR3A4 促进胃癌细胞生长,血管生成和转移,并且证明了OR3A4 通过调节PDLIM2、MACC1、NTN4、GNB2L1 的活化,影响胃癌细胞的生物学功能[6]。OR3A4 在卵巢癌组织中的表达水平明显高于癌旁组织。此外,OR3A4 基因在体外敲除后,细胞迁移和侵袭受到明显抑制[7]。此外,在乳腺癌中,OR3A4 在乳腺癌组织和细胞中表达上调,并与临床病理特征相关。下调OR3A4 表达通过影响细胞周期和凋亡抑制乳腺癌细胞的增殖,并通过EMT 抑制细胞转移,过表达OR3A4 取得相反实验结果。结果表明,OR3A4 是一种潜在的诊断生物标志物和治疗目标的各种癌症。
大量研究表明,KLF6 可以作为肿瘤抑制因子,调控增殖、迁移、分化、凋亡、细胞周期和血管生成等多种基本细胞功能,从而抑制肿瘤的发生[12]。KLF6通过下调间质标志物和抑制MMP-9 活性,抑制口腔癌的迁移和侵袭。KLF6 通过转录抑制E2F1 抑制透明细胞肾细胞癌的转移。Guo 等[7]指出OR3A4 通过抑制KLF6 促进卵巢癌的转移。另外有研究表明,KLF6在NSCLC 中表达下调,并通过诱导NSCLC 细胞凋亡抑制肿瘤生长,这可能提示KLF6 是NSCLC 的抑癌因子[8]。本研究中,在NSCLC 细胞中过表达OR3A4 显著降低KLF6 表达,而降低OR3A4 表达则明显促进KLF6 表达。另外结果证明NSCLC 细胞中转染KLF6可以显著减轻OR3A4 对NSCLC 细胞增殖、侵袭和迁移能力的影响。说明OR3A4 可能通过抑制KLF6 表达促进NSCLC 细胞增殖、侵袭和迁移。
综上所述,OR3A4 至少部分地通过KLF6 沉默促进NSCLC 细胞的增殖、迁移和侵袭。本研究为OR3A4 在NSCLC 进展中的作用提供了新的证据,并为NSCLC 的诊断和治疗提供了一个潜在的标志物。
