腹腔镜低位直肠癌Miles手术中关闭盆底腹膜结合骶前引流的效果观察
2020-01-17骆永富
骆永富
直肠癌是最常见的消化道恶性肿瘤之一,以中低位直肠癌为主,占80%~85%,且发病率呈明显上升趋势[1]。目前对于低位直肠癌的治疗仍以腹腔镜Miles手术为主[2]。然而,对于腹腔镜直肠癌 Miles术中是否必须要关闭盆底腹膜以及如何关闭盆底腹膜,目前仍存争议[3]。该文回顾性分析2015年6月—2017年6月在湖南省永州市中心医院胃肠外科接受腹腔镜低位直肠癌Miles手术切除的96例患者,分析关闭盆底腹膜结合骶前引流在腹腔镜低位直肠癌Miles手术的临床效果,现报告如下。
1 资料与方法
1.1一般资料该组96例患者,男51例,女45例;年龄37~76岁,平均56岁。经肠镜及病理检查确诊,肿瘤离肛门的距离长约1~4 cm,术前完成胸部、腹部增强CT和盆腔MRI,显示未见远处转移,局部临床分期表明能够手术切除。临床病理分期:I期7例,Ⅱ期35例,Ⅲ期52例,Ⅳ期2例。将96例病历资料按术中是否关闭了盆底腹膜,分为关闭盆底腹膜+骶前引流组(48例);未关闭盆底腹膜+骶前引流组(48例)。
1.2方法
1.2.1 手术方式 所有患者手术体位均为截石位,手术方式采用标准的全直肠系膜切除标准(TME),通常采用五孔法操作,首先探查腹腔内各脏器,确定无明显转移,肿瘤能够切除,然后用超声刀切开乙状结肠和直肠右侧腹膜黄白交界处,小心切开,通过超声刀和气腹双重作用,在Toldt's间隙无血管区钝性解剖分离拓展间隙,注意辨清和保护左侧输尿管,完整裸化暴露肠系膜下动脉根部,清除肠系膜下动脉其周围的淋巴组织,根部结扎离断,不保留左结肠动脉,向上继续分离直至十二指肠屈氏韧带附近,显露肠系膜下静脉,其根部结扎离断,超声刀切开乙状结肠和直肠的外侧腹膜,上至降结肠,下至盆底,进入直肠后间隙需注意保护两侧的腹下神经,防止术后出现尿潴留和影响性功能,直肠解剖直至盆底的肛提肌平面,充分游离裸化乙状结肠,在腹腔内距肿瘤上缘 10 cm以上使用一次性腹腔镜切割闭合器60 mm切断乙状结肠,近端乙状结肠常规行腹膜外乙状结肠造口。同时会阴组先用7#慕丝线缝合关闭肛门,距离肛门3 cm做一梭形切口,切开皮肤和皮下组织,沿坐骨结节前方和臀大肌内侧分离,切除坐骨直肠窝脂肪,显露肛提肌,切除围绕直肠的部分肛提肌,与腹部手术组会合,完整切除直肠癌标本。会阴部创面彻底止血,骶前间隙留置橡胶引流管1根,逐层关闭会阴切口。关闭气腹,CO2气腹压力调至9 mmHg,冲洗腹、盆腔,观察创面彻底止血。(1)未行盆底腹膜关闭患者骶前引流管放置后不关闭盆底腹膜。(2)行盆底腹膜关闭患者使用3-0可吸收缝合线关闭盆底腹膜,缝线长度约 15 cm,针距约 1.0 cm,两侧距 0.5 cm,从膀胱直肠陷窝或子宫直肠陷窝开始连续缝合盆底腹膜,注意缝合间距和张力不应过大,不能遗留间隙或缺损。所有患者如骶前引流管无异常于术后第4~5天拔出,如骶前引流管有混浊渗液或脓液,行持续灌洗,预防骶前感染。
1.2.2 观察指标 收集并分析患者年龄、性别、肿瘤分期、手术时间、手术出血量、术后住院时间、术后骶前感染、术后肠梗阻、放射性肠炎、术后肿瘤复发的情况。以门诊和电话形式进行随访,随访标准:术后1年以内,每3~6个月复查胸部、腹部增强CT和盆腔MRI、肠镜、肿瘤标志物,术后 1~2年,每6个月复查胸部、腹部增强CT和盆腔MRI、肠镜、肿瘤标志物。
1.3统计学处理采用SPSS 18.0统计软件进行统计分析。计数资料比较采用χ2检验,取P<0.05为差异有统计学意义。
2 结果
两组患者的年龄、性别、肿瘤分期、手术时间、手术出血量、术后住院时间、术后骶前感染、术后随访情况如下。
2.1两组临床资料比较96例患者根据年龄是否大于60岁分为两组,两组在年龄方面差异无统计学意义(P>0.05)。两组患者按性别比较,显示差异有统计学意义 (P<0.05),按肿瘤TNM分期比较χ2=4.05,P=0.036,显示差异有统计学意义(P<0.05)。见表1。

表1 96例腹腔镜低位直肠癌Miles术患者的一般资料(例)
2.2两组患者术中和术后恢复情况比较两组患者手术时间、手术出血量、术后住院时间及术后骶前感染发生情况比较,差异均无统计学意义 (P>0.05),说明关闭还是不关闭盆底腹膜本身在手术安全性和术后恢复情况方面并无显著差异。见表2。
2.3两组患者术后2年随访结果情况比较随访标准:术后1年以内,每3~6个月复查胸部、腹部增强CT和盆腔MRI、肠镜、肿瘤标志物,术后1~2年,每6个月复查胸部、腹部增强CT和盆腔MRI、肠镜、肿瘤标志物,随访截止时间为2019年6月。所有患者均得到随访,无随访缺失。
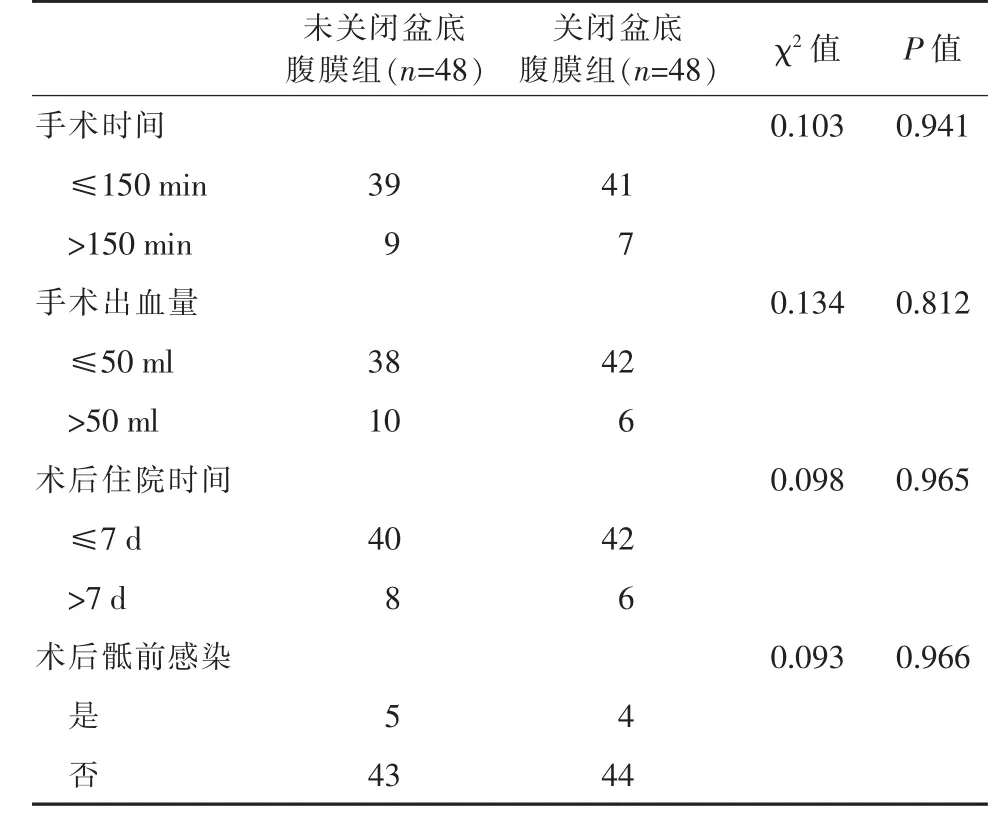
表2 两组患者的术中、术后恢复情况比较
术后2年的随访结果显示未关闭盆底腹膜组出现9例肠梗阻,其中有3例出现盆底疝再次手术治疗,4例因出现盆腔创面粘连性肠梗阻再次手术治疗后好转出院,2例出现肠梗阻保守治疗后好转,而关闭盆底腹膜组仅出现1例肠梗阻,且保守治疗好转,显示差异具有显著性,有统计学意义,P=0.029(P<0.05)。未关闭盆底腹膜组有18例患者因临床分期在Ⅲ期和Ⅳ期接受术后放疗,出现放射性小肠炎3例,其中1例出现放射性肠炎并肠穿孔再次手术治疗,2例保守治疗症状逐渐缓解,而关闭盆底腹膜组有36例术后接受放疗,未出现放射性小肠炎(P=0.041),提示有明显的统计学差异(P<0.05)。 关闭盆底腹膜和未关闭盆底腹膜组两组患者术后2年随访结果提示肿瘤复发分别为4/44、3/45,P=0.359,提示腹腔镜直肠癌Miles手术是否关闭盆底腹膜对于术后肿瘤的复发无统计学意义(P>0.05)。见表3。

表3 两组患者的术后随访情况比较
3 讨论
直肠癌是临床发病率较高的消化道恶性肿瘤,其中低位直肠癌居多,早期可见大便性状、排便习惯改变,便血、大便隐血试验阳性,晚期表现下腹痛、腹胀、腹部不适、排便困难、消瘦等表现,不易引起重视,早期呈被误诊为痔疮出血,故而大多患者就诊时病情已进展,导致预后不佳,对患者生活质量造成严重影响[4]。对于肿瘤下缘距离肛缘5 cm以内的低位直肠癌患者,手术方式以经腹会阴联合切除术(Miles术)为主,以往主要采用开腹,但该术式创伤大,并发症多,恢复时间很长,不利于患者恢复[5]。近年来,腹腔镜直肠癌经腹会阴联合切除术已广泛应用于临床,其手术的安全性、可行性、肿瘤根治性及远期疗效已得到前瞻性随机对照研究结果的证实[6,7]。但由于腹腔镜下行盆底腹膜缝合操作相对较困难,对腹腔镜直肠癌的盆底腹膜是否必须关闭成为目前临床医师研究的热点。
盆底腹膜关闭是直肠癌开腹手术的标准术式,但是对于腹腔镜直肠癌Miles术后是否关闭盆底腹膜,一直存在着争议。持反对意见的学者认为,因为腹腔镜下关闭盆底腹膜需要比较高的镜下操作技巧,难度大、费时,关闭盆底腹膜,如关闭不严密则可能有腹膜裂孔疝的风险,且并不能降低粘连性肠梗阻的发生率,同时增加了手术时间和住院时间[8]。持支持意见的学者认为腹膜是人体天然的屏障,直肠癌术后盆腔创面难免有渗出液,如引流不畅,残存积液极易滋生细菌造成骶前感染,造成弥漫性腹膜炎,甚至出现败血症及脓血症[9]。关闭的盆底腹膜与手术创面早期粘连,减少了继发出血与感染的概率[10]。骶前感染取决于局部感染因素的去除、通畅的引流,最彻底、有效的引流措施才是治疗骶前感染的关键[11]。亦有人报道选择经下腹部放置骶前引流管[12],但是该研究中两组患者放置骶前引流管后均未出现骶前感染,笔者认为,由于引流管出口位置太高且易被粘连的肠管压迫而导致引流不畅,而笔者采用经骶前引流,因引流管及戳孔留置于盆腔最低位,符合低位引流原则,能够达到充分引流目的,同时因关闭了盆底腹膜,亦不会导致严重的腹腔感染,大大缩短了愈合时间,促进了术后康复。
还有持支持意见的学者认为,因盆腔是“漏斗”型结构,上宽下窄,空间相对狭小,经腹会阴联合切除术后,由于失去了直肠及其系膜的填充和支持,盆腔呈“空洞”状,且因直肠癌手术创面宽,如果不缝合切开的盆底腹膜,小肠很容易滑入盆底,出现盆底疝、肠梗阻[13,14]。 该研究显示,96 例患者中选择关闭盆底腹膜组术后2年的随访结果显示,未关闭盆底腹膜组出现9例肠梗阻,其中有3例出现盆底疝再次手术治疗,4例因出现盆腔创面粘连性肠梗阻再次手术治疗后好转出院,2例出现肠梗阻保守治疗后好转,而关闭盆底腹膜组仅出现1例肠梗阻,且保守治疗好转,两组比较有显著差异 (P<0.05),其结果支持关闭盆底腹膜可以减少术后肠梗阻的发生。回顾性分析显示,是否关闭盆底腹膜与年龄无相关性,但是两组患者的性别比较有统计学差异(P<0.05),可能是因女性患者的子宫在行腹腔镜直肠癌根治术后,盆腔空虚,即使不关闭盆底腹膜,但是子宫依靠重力作用自然而然地落入盆腔,间接地起到了关闭盆腹膜炎的作用,提示如对于女性且子宫未切除患者,亦可考虑不必强行关闭盆底腹膜。两组患者的肿瘤pTNM分期比较有统计学差异(P=0.036,P<0.05),其原因考虑肿瘤临床分期越晚,清扫范围越大、切除的腹膜可能越多,创面越广,缝合可能就越难,特别是对于已行新辅助放化疗的患者尤为困难。两组手术时间、手术出血量、术后住院时间、术后骶前感染比较,差异无统计学意义(P>0.05),提示是否关闭盆底腹膜在术后恢复情况方面并无显著性差异,说明两种处理办法本身在手术质量的控制上是安全有效的。因而有学者认为[15-17],强行关闭盆底腹膜不宜选择以下病例:(1)肿瘤(T3、T4)外侵侧腹膜患者,切除时因盆腔腹膜缺损较大,不易缝合或缝合不严密的患者;(2)肥胖患者;(3)新辅助放疗后的直肠癌手术患者。对于关闭盆底腹膜困难患者的研究仍然需进一步探讨。
研究报道[18],低位直肠癌腹会阴联合切除术(Miles术)将腹膜返折以下的直肠和乙状结肠远端切除,同时因切除较多盆腔脏器及具有支持作用的组织结构,如不关闭盆底腹膜,则可使部分小肠不可避免地坠入盆腔中,术后放疗会造成小肠损伤,出现放射性小肠炎,肠穿孔。该研究中未关闭盆底腹膜组有18例患者因临床分期在Ⅲ期和Ⅳ期接受术后放疗,出现放射性小肠炎3例,其中1例出现放射性肠炎并肠穿孔再次手术治疗,2例保守治疗症状逐渐缓解,而关闭盆底腹膜组有36例术后接受放疗,未出现放射性小肠炎(P=0.041)。急性放射性小肠损伤多发生在放射治疗期间,包括腹痛、腹泻和恶心呕吐、便血等,导致部分患者不得不暂停甚至终止治疗,严重影响患者治疗效果。如症状持续>3个月,则迁延为慢性消化道损伤,其临床特点包括病变呈多灶性且进行性加重,需再次或多次手术,长期肠内与肠外营养支持相结合,并发症发生率及死亡率高,因手术难度大,术后并发症较多,放射性肠炎引起肠梗阻、肠穿孔、肠瘘的治疗更为棘手,需引起警惕[19]。
亦有学者认为关闭盆底腹膜前,为了减少腹膜缝合的张力而保留过多腹膜,可能增加肿瘤残存的概率[20]。但是该研究提示,是否关闭盆底腹膜或切除多少腹膜对于腹腔镜直肠癌Miles手术的术后肿瘤复发无明显相关性,不会增加肿瘤的残留和术后的复发率。
综上所述,关闭盆底腹膜联合骶前引流可以明显减少腹腔镜直肠癌经腹会阴联合切除手术(Miles术)的术后肠梗阻和放射性肠炎的发生,如果条件允许,建议常规关闭盆底腹膜和骶前引流,但是对于女性且子宫未切除、肿瘤pTNM临床分期晚,或因清扫后创面广、盆底腹膜弹性差而导致张力大而无法缝合,可考虑放弃关闭盆底腹膜。
