转录因子EB在同型半胱氨酸诱导滋养细胞凋亡中的作用
2020-01-16柴丽芬王艳华吴琪瑞王睿李淑霞刘林英石青吴凯张慧萍
柴丽芬 王艳华 吴琪瑞 王睿 李淑霞 刘林英 石青 吴凯 张慧萍
宁夏医科大学1临床医学院,2基础医学院(银川750001);3宁夏医科大学总医院(银川750004)
子痫前期(preeclampsia,PE)是一种妊娠期特有疾病,胎盘滋养细胞的凋亡与增殖平衡失调是PE发生的关键[1]。研究[2]发现,与正常妊娠的妇女相比,PE患者胎盘滋养细胞凋亡数量明显增加,但其机制不清。同型半胱氨酸(homocysteine,Hcy),是蛋氨酸代谢过程中的重要产物,通过影响细胞功能、参与氧化应激、炎症反应以及改变基因表达活性等多种环节参与细胞凋亡调控,进而诱发疾病的发生[3]。另有研究[4]发现,正常妊娠时,血清Hcy浓度降低,而PE患者的血清Hcy浓度较正常孕妇升高,以上提示,在PE发生的过程中,Hcy可能促进胎盘滋养细胞的凋亡,但机制不清。转录因子EB(transcription factor EB,TFEB)是亮氨酸拉链转录因子家族中的成员,以磷酸化状态稳定于细胞浆,受到不良刺激后转位进入细胞核启动下游基因转录,从而参与多种病理生理过程,如:调节线粒体功能、增强细胞凋亡、抑制炎症因子释放等[5],但其在Hcy引起的滋养细胞凋亡中的作用尚不清楚。因此,本研究以人源胎盘滋养细胞为研究对象,利用不同浓度Hcy干预滋养细胞并过表达TFEB后,检测凋亡相关指标的变化,从而探讨TFEB在Hcy诱导滋养细胞凋亡中的作用。
1 材料与方法
1.1 材料人胎盘滋养细胞株(HTR8-S/Vneo)购自上海瑞鹿生物科技有限公司;RPMI1640培养基、胎牛血清(Gibco公司);青链霉素、胰蛋白酶消化液(碧云天生物技术研究所);CCK8试剂盒(日本同仁化学研究所);Cell Viability Imaging Kit试剂盒(Roche Applied Science公司)RNA提取试剂盒、逆转录和qRT-PCR试剂盒(Takara生物公司);蛋白提取试剂盒、蛋白定量试剂盒(南京凯基有限公司);Cleaved-caspase3抗体(ab49822)、Bcl-2抗体(ab692)、TFEB抗体(D207D),羊抗兔或鼠二抗(Abcam公司);引物由上海生工公司合成。
1.2 方法
1.2.1 细胞培养采用含10%胎牛血清、1%双抗1640培养基,于37℃、含5%CO2的培养箱中培养滋养细胞(HTR8-S/Vneo)。
1.2.2 CCK8检测HTR8-S/Vneo细胞活力取对数生长期的HTR8-S/Vneo,制成2×103个/mL的细胞悬液接种于96孔板中,培养24 h待细胞贴壁及生长状态良好,换无血清培养基培养4 h后,各组分别加入不同浓度Hcy(0、0.1、0.2、0.5、1、2、2.5、5 mmol/L)孵育48 h,然后,每孔加入10 μL CCK8试剂,放至培养箱共同孵育4 h,取出培养板于酶标仪上490 nm测定各孔OD值,通过与正常组比较求出存活率。同时,绘制不同浓度Hcy对HTR8-S/Vneo生长活力的影响曲线图。
1.2.3 细胞活力荧光测定使用Cell Viability Imaging Kit试剂盒,检测前选择生长状态较好的HTR8-S/Vneo细胞,分为正常组和Hcy组:(1)Hcy组,细胞经 1 mmol/L Hcy处理 48 h;(2)正常组,10%1640培养基培养,然后使用细胞活力荧光测定试剂盒进行染色,共聚焦显微镜下观察两组细胞活力情况。
1.2.4 qRT-PCR法检测两组TFEB mRNA表达按照总RNA抽提试剂盒说明书抽提总RNA,分析样品纯度及浓度。根据GeneBank数据库查询TFEB的基因序列并设计相应引物。TFEB引物,上游:5′-ACCTGTCCGAGACCTATGGG-3′,下游:5′-CGTCCAGACGCATAATGTTGTC-3′,GAPDH 引物,上游:5′-GGTGAAGGTCGGTGTGAACG-3′,下游:5′-CTCGCTCCTGGAAGATGGTG-3′,按反转录试剂盒说明书加入相应试剂反转录成cDNA,以cDNA为模板进行qRT-PCR。荧光PCR反应条件为:95℃ 预变性 30 s,95℃变性5 s、57℃退火34 s,扩增40个循环。待反应结束后,分析qRT-PCR原始数据,用内参基因GAPDH校正,结果用2-△△CT计算。
1.2.5 TFEB腺病毒感染HTR-8/SVneo细胞委托上海吉玛制药技术有限公司构建TFEB腺病毒过表达载体,感染前选择生长状态较好的HTR8-S/Vneo进行培养,吸去旧培养液,PBS洗1遍,加入调整好滴度的腺病毒液,病毒感染细胞6 h后,弃掉培养液,加入新含血清培养液,感染48 h后,收集细胞。
1.2.6 Westernblot检测Cleaved-caspase3、Bcl-2、TFEB蛋白表达 收集各组滋养细胞,提取总蛋白并定量,加入上样缓冲液煮沸变性。每孔蛋白样品30 μg,SDS PAGE电泳,转移至孔径0.22 μm 硝酸纤维素薄膜;含5%脱脂奶粉的PBST室温封闭2 h;加入一抗(兔抗TFEB,1∶1 000;鼠抗Bcl-2,1∶1 000;兔抗Cleaved-caspase3,1∶1 000;β-actin兔抗,1∶1 000),4℃ 过夜;PBST 洗涤10 min,3次;再加入HRP 标记的二抗(1∶5 000),摇床孵育2 h;PBST洗涤10 min,3次;加入ECL显色底物,凝胶成像分析仪上成像。进行目的基因灰度值分析,以β-actin为内参对照。
1.3 统计学方法用Prism 5.0统计软件进行统计学分析,数据结果以表示,计量资料两组对比采用t检验,多样本均数间比较采用One-way ANOVA检验,组间的两两比较采用Student-Newman-Keuls检验,P<0.05表示差异有统计学意义。
2 结果
2.1 Hcy对滋养细胞存活率的影响不同浓度的Hcy干预HTR-8/SVneo细胞48 h后,CCK8法检测并计算各组细胞存活率。与正常组比较,Hcy干预后细胞存活率降低,在浓度为1 mmol/L时细胞存活率69.4%,而在2 mmol/L时,细胞存活率降低至33%(故后续实验中均选用1 mmol/L Hcy浓度为实验组),提示Hcy对滋养细胞生长有抑制作用。见图1。
2.2 细胞活力荧光测定观察Hcy对滋养细胞活力的影响1 mmol/L Hcy干预HTR-8/SVneo细胞后,细胞活力荧光测定法检测细胞活力(绿色为细胞有活力,红色为细胞无活力,蓝色为细胞核),结果发现:正常组细胞活力正常;Hcy组与正常组比较,红染细胞及细胞碎片明显增多,细胞活性显著降低。见图2。
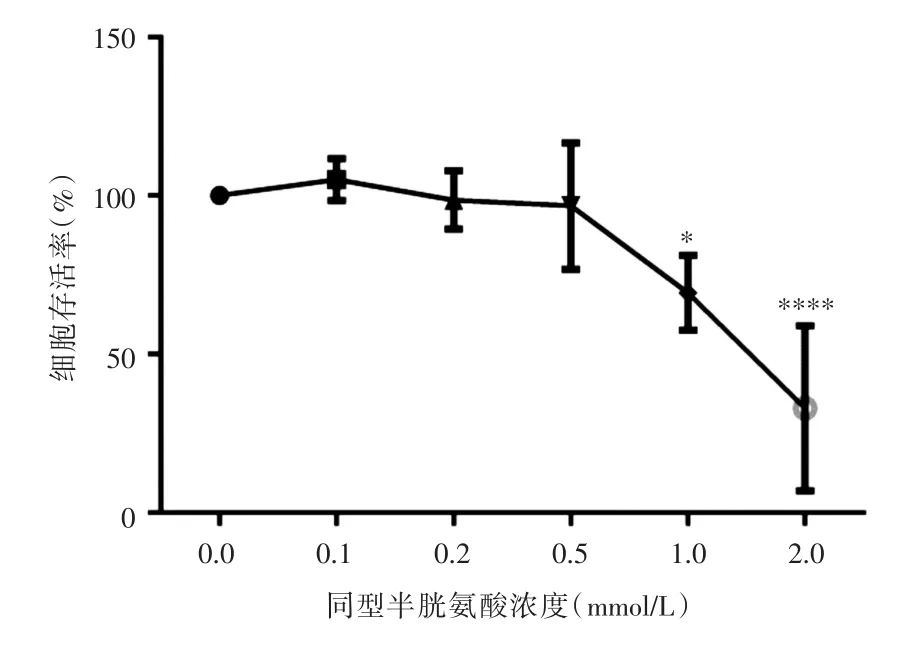
图1 Hcy对HTR-8/SVneo增殖活力的影响Fig.1 Effect of Hcy on proliferation activity of HTR-8/SVneo
2.3 Hcy干预滋养细胞后Cleaved-caspase3、Bcl-2的蛋白表达1 mmol/L Hcy干预滋养细胞48 h后,运用Western blot检测Cleaved-caspase3、Bcl-2的蛋白表达改变。与正常组比较,Hcy组Cleaved-caspase3蛋白表达量增高,Bcl-2表达量降低,差异有统计学意义(P<0.05),结果提示:Hcy可能促进滋养细胞凋亡。见图3。
2.4 Hcy干预滋养细胞后TFEB的表达1 mmol/L Hcy干预滋养细胞48 h后,采用qRT-PCR及Western blot检测TFEB的mRNA和蛋白表达水平。结果显示:与正常组比较,Hcy组中TFEB mRNA表达量降低,TFEB蛋白表达趋势与TFEB mRNA表达趋势一致,差异具有统计学意义(P<0.05),提示Hcy抑制了TFEB的表达。见图4。

图2 Hcy干预HTR-8/SVneo细胞后细胞活力的变化Fig.2 Changes of cell viability after Hcy intervention of HTR-8/SVneo cells
2.5 过表达TFEB并验证表达效果为进一步探讨TFEB在Hcy促滋养细胞凋亡中的作用,将TFEB重组包装的腺病毒感染滋养细胞,并运用Western blot验证过表达效果,结果呈现出Ad-TFEB组TFEB表达显著升高,提示TFEB重组腺病毒感染成功。见图5。
2.6 过表达TFEB后检测滋养细胞凋亡的改变HTR-8/SVneo感染TFEB过表达腺病毒,同时再给予1mmol/L Hcy干预48 h后,运用Western blot检测各组细胞Cleaved-caspase3、Bcl-2蛋白表达。结果显示,过表达TFEB后,Cleaved-caspase3蛋白表达水平降低,Bcl-2升高,差异具有统计学意义(P<0.01),提示TFEB抑制Hcy诱导的滋养细胞凋亡。见图6。
3 讨论
胎盘是母体与胎儿间进行物质交换的器官,其中胎盘滋养细胞是妊娠得以建立和维持的基础,占妊娠胎盘的主要部分。已有研究表明胎盘滋养细胞功能和形态异常影响其浸润、迁移及胎盘的种植[6-8]。PE患者胎盘滋养细胞凋亡较正常孕妇明显增加,提示妊娠期间胎盘滋养细胞凋亡可能是PE的重要致病因素之一[9]。同时,有研究发现,妊娠早期高的Hcy能影响滋养细胞的增殖从而影响其侵袭过程[10]。周登诗等研究发现,PE患者的血清Hcy浓度较正常孕妇升高,而在正常妊娠时,血清Hcy浓度是降低的[11-13],这意味着在PE发生的过程中,较高浓度的同型半胱氨酸可能会导致滋养细胞的凋亡,从而影响其浸润、迁移及胎盘的种植。本研究中Hcy干预滋养细胞后发现,细胞活力及存活率均降低,凋亡相关蛋白Cleaved-caspase3明显升高、Bcl-2降低,与文献报道一致。细胞凋亡通路包括死亡受体通路、内质网通路及线粒体通路,研究表明过高浓度Hcy可通过过度激活细胞内质网及线粒体应激,引起细胞凋亡[14-15]。其中,在线粒体应激途径中,Hcy诱导线粒体功能障碍,导致caspase依赖的级联凋亡反应激活,从而促进细胞凋亡事件发生。
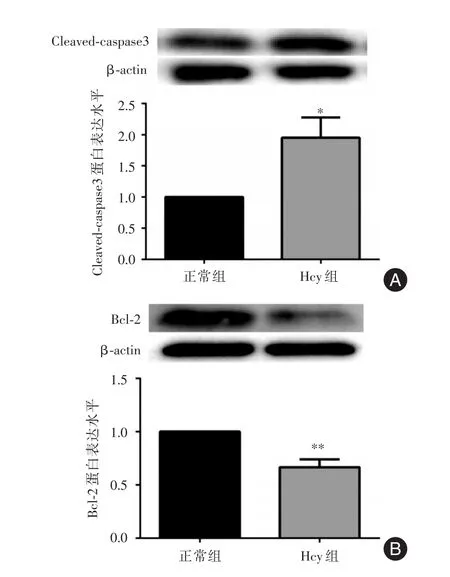
图3 Hcy干预HTR-8/SVneo细胞后Cleaved-caspase3、Bcl-2的蛋白表达Fig.3 Protein expression of Cleaved caspase3 and Bcl-2 in HTR-8/SVneo cells after treated with Hcy
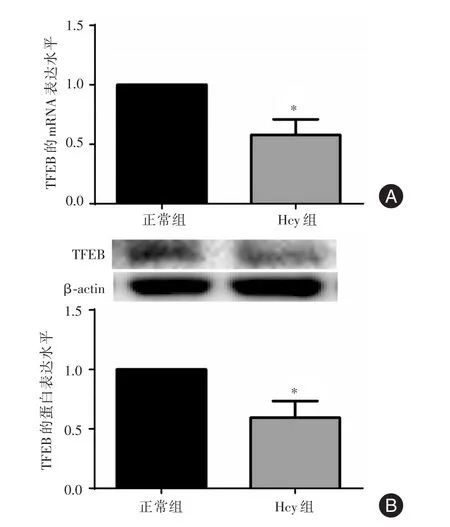
图4 Hcy干预HTR-8/SVneo细胞后TFEB的表达Fig.4 Expression of TFEB in HTR-8/SVneo cells after treated with Hcy
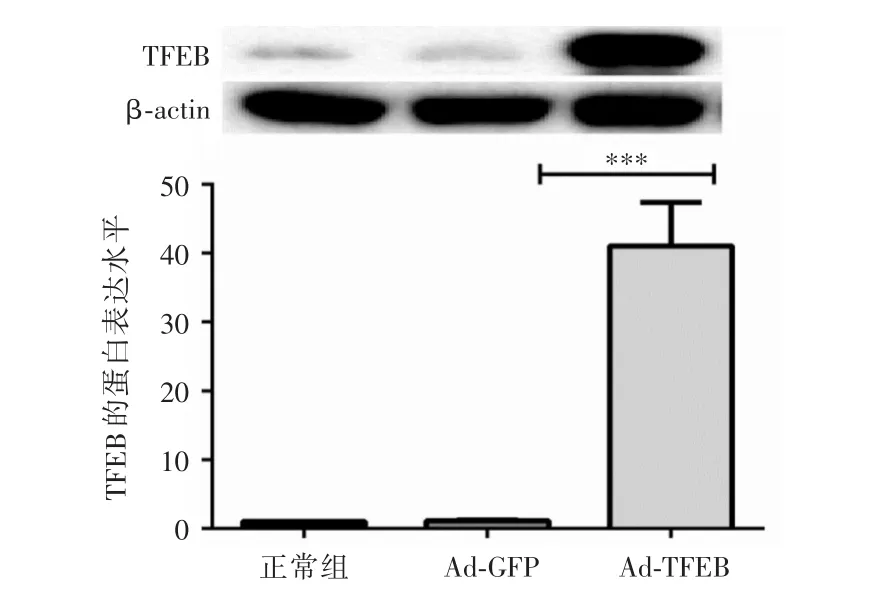
图5 TFEB腺病毒感染HTR-8/SVneo后Western blot检测TFEB的蛋白表达Fig.5 The protein expression of TFEB detected by Western blot after infected with TFEB adenovirus in HTR-8/SVneo

图6 过表达TFEB同时Hcy干预后检测Cleaved-caspase3、Bcl-2蛋白表达Fig.6 The protein expression of Cleaved caspase3 and Bcl-2 were detected after over-expressed TFEB and treated with Hcy
近年,研究发现TFEB这一家族的分子在脊椎动物中结构相似,具有遗传保守性,序列中都包含有一段可识别的DNA特殊结合的结构域,与细胞的发生和分化密切相关。并发现,TFEB可在多种类型的细胞中广泛表达,正常状态下大部分TFEB以无活性的磷酸化形式定位于胞浆,当受到负性应激时被激活脱磷酸化转位进入细胞核,通过识别、启动下游相应基因的转录,参与多种生理病理过程[5,16-17]。LI等[18]发现柠檬酸克罗米芬(CC),可促进TFEB的核易位,增加细胞的溶酶体生物发生,抑制细胞活力,导致细胞凋亡。在糖尿病足细胞,帕金森病患者神经细胞等的细胞凋亡过程中TFEB也均发生明显变化,提示TFEB可参与调控细胞凋亡,但目前在滋养细胞的凋亡中是否亦同样发生变化,尚无文献报道[16,19]。本实验利用Hcy干预胎盘滋养细胞促进滋养细胞凋亡模拟PE病理变化,检测TFEB的表达情况,发现较高浓度Hcy干预滋养细胞可导致其降低,提示TFEB在Hcy诱导的滋养细胞凋亡分子机制中可能起到了重要作用。为了进一步探讨TFEB在Hcy诱导的滋养细胞凋亡过程中的作用,本实验过表达TFEB后发现滋养细胞凋亡水平降低,暗示TFEB抑制了Hcy诱导的滋养细胞凋亡。同时,在KANG等[20]的研究中发现,过表达TFEB可以明显增加抗氧化应激蛋白的表达,促进线粒体生物合成,维持线粒体稳态,从而抑制凋亡的线粒体调控途径。
综上,TFEB在Hcy诱导滋养细胞凋亡的分子机制中可能起到保护作用,这就提示TFEB可能参与了高Hcy致PE的发病过程,但机制不明,是否与其抑制凋亡作用相关需进一步研究。
