硒化铜纳米晶体的高效抗菌活性研究
2020-01-15吕文毅郭青娟邹鸿雁黄承志
吕文毅, 李 雪, 郭青娟, 邹鸿雁, 黄承志*
(1.发光与实时分析化学教育部重点实验室,西南大学药学院,重庆 400715; 2.生化医学分析重庆市重点实验室,西南大学化学化工学院,重庆400715)
细菌是所有生物中数量最多的一类,它是最为常见的一种病原体,可引起许多严重疾病的爆发[1 - 2],如肺结核、淋病、梅毒、鼠疫等。抗菌材料是指通过一定工艺,将抗菌剂添加到基体材料中制备成的具有杀灭和抑制微生物生长的一类新型功能材料[3],该材料在医疗卫生、家庭用品、家用电器、食品包装等领域有极其广阔的应用前景。在人们对环境卫生要求日益提高的今天,抗菌材料的应用受到更加广泛的关注。

图1 Cu2-xSe NCs抗菌活性示意图Fig.1 Schematic representation of the antibacterial activity of Cu2-xSe NCs
对病原微生物有杀死或抑制生长作用的抗菌剂是抗菌材料的核心部分,它可分为无机抗菌剂、有机抗菌剂和天然抗菌剂[4]。其中,无机抗菌剂一般利用银、铜、锌等金属自身的抗菌能力而制成抗菌剂[5],其耐热性较好且抗菌广谱;有机抗菌剂主要为香草醛或乙基香草醛类化合物[6],但耐热性较差,容易水解,且有效期短;天然抗菌剂主要来源于天然植物的提取,这也导致其数量较少且不能广谱抗菌。纳米技术的快速发展提供了用纳米材料控制病原微生物的可能和机会,由于其具有独特的化学和物理性质,现今已成为新型抗菌剂[7 - 8]。与银相比,铜的价格更低廉,且对各种细菌菌株具有优异的抗菌活性,因此铜基纳米材料越来越受欢迎。革兰氏阴性菌大肠杆菌和革兰氏阳性菌金黄色葡萄球菌对铜基纳米颗粒特别敏感,因此可用于治疗烧伤、手术伤口和糖尿病足溃疡感染[9]。作为抗菌剂,硫属铜化物拥有耐热性好、毒性低的优点,且可广谱持续抗菌[10]。基于硫属铜化物的这些特点,本实验利用硫属铜化物的重要代表之一的硒化铜纳米晶体(Cu2-xSe NCs)进行广谱抗菌。我们以常见的E.coli(革兰氏阴性菌)和S.aurues(革兰氏阳性菌)为模型菌株(图1),通过测定细菌存活率、细菌生长曲线和杀菌曲线,纳米材料的最小抑菌浓度(MIC)和最小杀菌浓度(MBC),以及杀菌动力学来评价Cu2-xSe NCs的抗菌性能。实验结果显示,Cu2-xSe NCs对大肠杆菌及其耐药菌株的MIC均为32 μg/mL,而对金黄色葡萄球菌及其耐药菌株的MIC则为4 μg/mL,这是由于大肠杆菌具有双层膜而金黄色葡萄球菌仅有单层膜。此外,仅需32 μg/mL Cu2-xSe NCs就可在1 h内杀死所有大肠杆菌和金黄色葡萄球菌,证明了Cu2-xSe NCs拥有良好的抗菌性能。
1 实验部分
1.1 实验仪器
细菌实验使用的所有玻璃器皿、试剂和材料均用LDZX-40SBI蒸汽压力灭菌锅(上海申安医疗器械厂)进行高温灭菌;所有细菌实验均在SW-CJ-IF(苏净集团安泰公司)洁净工作台上进行;细菌培养均在型号为QYC211 INCUBATOR SHAKER的全温空气摇床(上海福玛实验设备有限公司)中进行;Biotek多功能酶标仪Synergy H1(美国)用于测定细菌的OD600;实验所用细菌菌种均在-80 ℃的冰箱中保存,接种和纯化后的细菌均在0 ℃的冰箱中保存。
1.2 实验试剂及材料
合成Cu2-xSe NCs所用的十六烷基三甲基溴化铵(CTAB)和CuSO4·5H2O(99%)从国药化学试剂(上海)有限公司购买。SeO2(99.9%)购自阿拉丁化学(上海)有限公司。维生素C(VC)购自Alfa Aesar Co.Ltd(美国)。配制细菌Luria-Bertani(LB)培养基所用酵母提取物来自拜尔迪生物(OXOID)公司,蛋白胨来自北京奥博星生物技术有限公司,NaCl(分析纯)来自成都市科龙化工试剂厂,琼脂粉来自北京鼎国昌盛生物技术有限责任公司。实验中其他溶剂均为分析纯,水为超纯水(18.2 MΩ·cm)。
实验菌种大肠杆菌(Escherichiacoli,E.coli,ATCC 25922)、金黄色葡萄球菌(Staphylococcusaureus,S.aureus,ATCC 25923)、大肠杆菌耐药菌(L339)、金黄色葡萄球菌耐药株(L393)均由西南医院检验科提供。
1.3 硒化铜纳米晶体的制备
本文采用温和的室温水相法合成Cu2-xSe NCs。具体方法参照Lie等的合成原理[11]并略有改进。将800 μL 30 mmol/L CTAB和2.4 mL H2O加入圆底烧瓶中,在剧烈搅拌下,依次加入50 μL 0.2 mol/L SeO2和300 μL 0.2 mol/L VC。反应10 min后,加入50 μL 0.4 mol/L CuSO4·5H2O和400 μL 0.2 mol/L VC。剧烈搅拌混合溶液,在30 ℃下反应1.5 h,并将混合溶液用10 kDa透析袋透析纯化24 h以去除小分子,然后再离心去除大分子。将合成的等离子体Cu2-xSe NCs储存在4 ℃冰箱,待用。
1.4 培养基的配制
按照每1 L培养液中含5 g酵母提取液、10 g蛋白胨、10 g NaCl、15 g琼脂的比例配制LB固体培养基,并按照每200 mL培养液中含1 g酵母提取液、2 g蛋白胨、2 g NaCl的比例配制LB液体培养基。将制备的培养基放入锥形瓶中,摇晃均匀,并配制50 mL含0.9%NaCl溶液备用。将抑菌实验使用的培养皿、试管(试管上端用棉花堵住)、移液枪枪头、EP管(微量离心管),以及加入培养液的锥形瓶、加入NaCl溶液的广口瓶、接纯水的广口瓶用报纸包好,在高温灭菌锅中于120 ℃灭菌30 min。待灭菌锅降温至60 ℃ 左右时取出所有物品,并轻轻摇晃锥形瓶中的培养液使其混合均匀,待没有气泡后将其倒入培养皿中使其自然冷却凝固,用保鲜膜包裹后放入4 ℃的冰箱中待用。上述过程均在无菌操作台上进行,且无菌操作台必须提前打开紫外灯杀菌30 min,倾倒培养液和自然冷却的过程需一直通风确保没有杂菌。
1.5 标准菌株细菌悬液的配制
于-80 ℃冰箱中取出标准菌株,将接菌环置于酒精灯上直至烧红,冷却后用接菌环沾取菌液在培养基上轻轻平行地画线,梯度稀释三次。将画好线的培养基置于全温空气摇床中进行细菌的一代活化,时间为12 h。取出一代活化的细菌,重复接菌的步骤,挑取单菌落,将其放入全温空气摇床,在37 ℃下孵育12 h进行细菌的二代活化。测其OD值,当OD在0.6~0.8,表明细菌处于旺盛生长的对数生长期。
向试管中加入1 mL 0.9% NaCl溶液,将接菌环置于酒精灯上直至烧红,冷却后用接菌环挑取单菌落,并将其放入试管中,让细菌分散于NaCl溶液中,此时溶液将变得浑浊。采用BaSO4比浊法,制得浓度为1.0×108CFU/mL(CFU:菌落形成单位)的细菌悬液。以下抑菌实验所用的细菌悬液均在此基础上稀释了100倍,即细菌悬液的浓度均为1.0×106CFU/mL。以上步骤均在无菌操作台上进行。
1.6 细菌存活率的测定
取100 μL浓度为1.0×106CFU/mL的细菌悬液,100 μL不同浓度的Cu2-xSe NCs溶液和800 μL LB液体培养基加入已灭菌的试管,混合均匀后放入恒温摇床,在37 ℃、120 r/min下孵育24 h。用酶标仪测其OD600值并计算细菌的存活率。
1.7 最小抑菌浓度和最小杀菌浓度的测定
最小抑菌浓度(MIC)和最小杀菌浓度(MBC)是描述药物抗菌活性的主要定量参数,也是衡量抗菌试剂抑菌能力的重要指标。在本文中,我们使用液体培养基稀释法测定MIC和MBC。取一系列EP管并写上编号,采用二倍稀释法,依次加入100 μL不同浓度的Cu2-xSe NCs溶液,再加入100 μL 1.0×106CFU/mL细菌悬液和800 μL LB液体培养基,混匀后置于37 ℃全温摇床孵育24 h。取出试管,观察各EP管的浑浊程度,第一个澄清透明的EP管所对应的浓度即为MIC。
将所有未生长细菌试管及MIC的前一个试管中的培养液取200 μL转移到干净的固体LB培养基上,涂板并在37 ℃全温摇床中孵育12 h,观察细菌生长情况。如果培养基上有菌落出现,则说明该浓度只能抑制细菌生长而不能杀死细菌,若无菌落或只有少量菌落(小于5)出现则表明该浓度有杀菌效果。第一个无细菌生长的板所对应的浓度即为MBC。
1.8 细菌生长曲线的测定
取一块96孔板进行该实验,向每孔中加入100 μL溶液,该溶液为1.0×106CFU/mL细菌悬液和Cu2-xSe NCs的混合溶液。其中,对于E.coli,Cu2-xSe NCs的浓度依次为0、2、4、8、16、32 μg/mL;对于S.aureus,Cu2-xSe NCs的浓度依次为0、0.5、1、2、4、8 μg/mL。每个浓度做3个平行样,第4个孔为调零孔,该孔溶液为只含有相应浓度Cu2-xSe NCs的LB液体培养基,即为菌液存在。加好样后将其置于37 ℃恒温箱中孵育,并分别于0、1、2、4、6、8、12、16 h取出,摇匀后用酶标仪测定OD600。去除底物吸光度后,以孵育时间为横坐标,OD600值为纵坐标,绘制细菌的生长曲线。
1.9 时间-杀菌曲线的测定
取100 μL浓度为1.0×106CFU/mL的细菌悬液,100 μL不同浓度的Cu2-xSe NCs溶液和800 μL LB液体培养基加入已灭菌的试管。其中,Cu2-xSe NCs的浓度依次为0、0.5倍MIC、1倍MIC、2倍MIC、4倍MIC和8倍MIC,即对于E.coli,Cu2-xSe NCs的浓度依次为0、16、32、64、128、256 μg/mL;而对于S.aureus,Cu2-xSe NCs的浓度依次为0、2、4、8、16、32 μg/mL。每个浓度做3个平行样。加好样后将其置于37 ℃恒温箱中孵育,并分别于0、1、2、4、8、12 h取出,涂板后继续置于37 ℃恒温箱中孵育12 h,计算菌落数。以时间为横坐标,菌落数为纵坐标,绘制时间-杀菌曲线。
1.10 硒化铜纳米晶体中铜离子的释放
取一定量的Cu2-xSe NCs装入10 kDa透析袋中,并将其放入500 mL超纯水中,在室温下搅拌透析。分别于1、2、4、6、8、12、24 h用原子吸收光谱仪测定透析袋外液中Cu2+的浓度并绘制Cu2+释放曲线。
2 结果与讨论
2.1 硒化铜纳米晶体的表征
用水热法合成的Cu2-xSe NCs分散均匀且粒径均一,约为12.8 nm,因其独特的铜缺陷结构而在近红外区具有强烈的局域表面等离子体共振吸收。此外,由于所用包被剂为CTAB,所以该Cu2-xSe NCs表面带正电。Cu2-xSe NCs的表征结果见图2。

图2 Cu2-xSe NCs的表征。(A)Cu2-xSe NCs的透射电镜(TEM)图像;(B)Cu2-xSe NCs的粒度分布,其通过在视野中随意计数100个颗粒而获得;(C)Cu2-xSe NCs的UV-Vis吸收光谱;(D)Cu2-xSe NCs和H2O的Zeta电位Fig.2 Characterization of Cu2-xSe NCs.(A) TEM image of Cu2-xSe NCs;(B) Particle size distribution map of Cu2-xSe NCs obtained by randomly counting 100 particles in the field of view;(C) UV-Vis absorption spectrum of Cu2-xSe NCs;(D) Zeta potential of Cu2-xSe NCs and H2O
2.2 硒化铜纳米晶体对常见致病菌的抗菌活性
本实验从Cu2-xSe NCs对E.coli和S.aureus的细菌存活率、MIC和MBC三个方面考察其抗菌活性。如图3所示,随着Cu2-xSe NCs浓度的增加,无论是E.coli还是S.aureus,其细菌存活率都逐渐下降。此外,Cu2-xSe NCs对S.aureus的影响明显强于对E.coli的影响。对于E.coli,当Cu2-xSe NCs的浓度为32 μg/mL时,细菌存活率为0,即无细菌生长,而对于S.aureus,只需4 μg/mL的Cu2-xSe NCs已可以抑制其生长。Cu2-xSe NCs对常见致病菌的MIC测定进一步证实了上述结论。因MIC是指引起细菌肉眼观察下未见生长的药物最低浓度,故我们选择肉眼可见细菌培养液澄清透明的EP管对应的Cu2-xSe NCs浓度为该材料的MIC。如图4所示,Cu2-xSe NCs对E.coli的MIC为32 μg/mL,对S.aureus的MIC为4 μg/mL。这一现象也和其细菌存活率结果一致。

图3 Cu2-xSe NCs对E.coli(A)和S.aureus(B)细菌存活率的影响Fig.3 Effect of Cu2-xSe NCs on bacterial viability of E.coli(A) and S.aureus(B)

图4 Cu2-xSe NCs对常见致病菌的MIC(Cu2-xSe NCs浓度单位为μg/mL)Fig.4 MIC of Cu2-xSe NCs against common pathogens(Cu2-xSe NCs concentration unit is μg/mL)
以MIC为界,将MIC及其后未长菌试管和MIC的前一个试管中的培养液取200 μL转移到干净的固体LB培养基上,涂板并在37 ℃全温摇床中孵育12 h,观察细菌生长情况,结果见图5。对于E.coli,Cu2-xSe NCs的最小杀菌浓度MBC为32 μg/mL,而对于S.aureus,Cu2-xSe NCs的最小杀菌浓度MBC则为4 μg/mL。

图5 Cu2-xSe NCs对常见致病菌的MBCFig.5 MBC of Cu2-xSe NCs against common pathogens
2.3 硒化铜纳米晶体对耐药菌株的抗菌活性

图6 Cu2-xSe NCs对E.coli耐药菌株(A)和S.aureus耐药菌株(B)细菌存活率的影响Fig.6 Effect of Cu2-xSe NCs on bacterial viability of E.coli resistant strains (A) and S.aureus resistant strains (B)
考察了Cu2-xSe NCs对耐药菌株的抗菌活性,其内容为Cu2-xSe NCs对E.coli耐药菌株和S.aureus耐药菌株的细菌存活率、MIC和MBC三个方面。如图6所示,Cu2-xSe NCs对耐药菌株细菌存活率的影响和对其普通菌株的影响相似,对于E.coli耐药菌株,当Cu2-xSe NCs浓度为32 μg/mL时,细菌存活率为0,而对于S.aureus耐药菌株,只需4 μg/mL Cu2-xSe NCs。
Cu2-xSe NCs对耐药菌株的MIC也和对其普通菌株的MIC一致,对于E.coli耐药菌株和S.aureus耐药菌株,MIC分别为32 μg/mL和4 μg/mL(图7)。而Cu2-xSe NCs对耐药菌株的最小杀菌浓度MBC则不太相同(图8)。对于E.coli耐药菌株,Cu2-xSe NCs的MBC为32 μg/mL,对于S.aureus耐药菌株,Cu2-xSe NCs 的MBC为8 μg/mL,和Cu2-xSe NCs对S.aureus普通菌株的MBC 4 μg/mL相比,略高。

图7 Cu2-xSe NCs对耐药菌株的MIC(Cu2-xSe NCs浓度单位为μg/mL)Fig.7 MIC of Cu2-xSe NCs against resistant strains(Cu2-xSe NCs concentration unit is μg/mL)

图8 Cu2-xSe NCs对耐药菌株的MBCFig.8 MBC of Cu2-xSe NCs against resistant strains
2.4 硒化铜纳米晶体的抑菌动力学
为了探究Cu2-xSe NCs对革兰氏阳性菌和革兰氏阴性菌的的抑菌动力学,我们测定了细菌生长曲线和时间-杀菌曲线。如图9所示,对于E.coli,细菌在孵育2 h后开始进入对数生长期,直至12 h后进入平台期。随着Cu2-xSe NCs浓度的逐渐增加,虽然细菌的生长趋势并未改变,但是增长速度逐渐减小,当其浓度为16 μg/mL时,细菌在孵育8 h后才进入对数生长期并于12 h后进入平台期;而当Cu2-xSe NCs浓度增加到32 μg/mL时,即达到MIC时,细菌不再生长。对于S.aureus,细菌在孵育1 h后就开始进入对数生长期,12 h后进入平台期。并且S.aureus受Cu2-xSe NCs浓度影响更大,随着其浓度的逐渐增加,细菌的增长速度大幅降低。当Cu2-xSe NCs浓度到达MIC时,细菌基本不生长。再一次证明了S.aureus对Cu2-xSe NCs更敏感。

图9 Cu2-xSe NCs抑制常见致病菌的生长曲线Fig.9 The growth curve of common pathogens inhibited by Cu2-xSe NCs
时间-杀菌曲线可以评估一种抗菌药物对细菌的杀菌速率。我们取Cu2-xSe NCs的浓度依次为0、0.5倍MIC、1倍MIC、2倍MIC、4倍MIC和8倍MIC进行实验(图10)。对于E.coli,当Cu2-xSe NCs浓度为0或者0.5倍MIC时,细菌数目持续增长,但当其浓度到达32 μg/mL,即Cu2-xSe NCs对E.coli最小杀菌浓度MBC时,细菌在1 h内全部死亡。对于S.aureus,当Cu2-xSe NCs浓度为0时,细菌不断生长,但随着其浓度的增加,细菌逐渐减少,当其到达Cu2-xSe NCs对S.aureus最小杀菌浓度的MBC(4 μg/mL)时,细菌在8 h 内全部死亡。伴随着Cu2-xSe NCs浓度的不断增大,细菌死亡时间愈来愈短,当其为32 μg/mL时,细菌在1 h内全部死亡。即,当Cu2-xSe NCs浓度为32 μg/mL时,不管是革兰氏阳性菌还是革兰氏阴性菌,都会在1 h内全部死亡,证明了Cu2-xSe NCs拥有较强的杀菌性能。
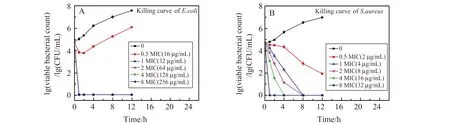
图10 Cu2-xSe NCs抑制常见致病菌的时间-杀菌曲线Fig.10 The times-killing curve of common pathogens inhibited by Cu2-xSe NCs
2.5 硒化铜纳米晶体的抗菌机制

图11 Cu2-xSe NCs中Cu2+的释放曲线Fig.11 Cu2+ release curve in Cu2-xSe NCs
在抗菌剂抗菌机制研究中,较为公认的有四种途径:其一,金属离子接触反应,这也是无机抗菌剂最普遍的抗菌作用机理;其二,催化激活机理,即通过催化产生活性氧物质从而杀死细菌;其三,阳离子固定机理,即抗菌剂携带阳离子基团,以此固定负电荷的细菌,从而使其接触性死亡并破坏细胞壁和细胞膜;其四,细胞内容物、酶、蛋白质、核酸损坏机理,这是许多有机抗菌剂的抗菌机理。为考察Cu2-xSe NCs的抗菌机制,我们首先测定Cu2-xSe NCs中Cu2+的释放曲线(图11),不断增加的Cu2+浓度证明了Cu2-xSe NCs可以持续释放Cu2+,从而实现持久抗菌的作用。其次,我们使用了活性氧(ROS)荧光探针DCFH-DA,并通过荧光共聚焦分析Cu2-xSe NCs与细菌作用是否有活性氧物质的产生,通过实验我们发现Cu2-xSe NCs并不会产生ROS,即不是通过催化激活机理杀死细菌。Zeta电位(图2D)证实Cu2-xSe NCs因其包被剂为CTAB,一种带季胺盐基团的阳离子表面活性剂而带正电,证明Cu2-xSe NCs可通过阳离子固定机理实现杀菌。最后我们考察了细胞内容物、酶、蛋白质、核酸损坏机理,实验结果证明Cu2-xSe NCs并不能通过该途径灭菌。
综上所述,Cu2-xSe NCs的杀菌性能主要依靠金属离子接触反应和阳离子固定机理实现。
3 结论
本实验研究发现,Cu2-xSe NCs拥有较强的杀菌性能,对常见的E.coli(革兰氏阴性菌)和S.aureus(革兰氏阳性菌)表现出杀菌活性,并且对其耐药菌株具有良好抑菌能力,而S.aureus对Cu2-xSe NCs更为敏感,这是由于E.coli具有双层膜而S.aureus仅拥有单层膜。此外,当Cu2-xSe NCs浓度为32 μg/mL时,不管是革兰氏阳性菌还是革兰氏阴性菌,都会在1 h内全部死亡,证明了Cu2-xSe NCs拥有较强的杀菌性能。因此,在新型抗菌药的研究中,纳米材料Cu2-xSe NCs具有成为新型抗菌剂的潜力。
