15种高危型人乳头瘤病毒核酸检测方法验证及人群感染情况调查*
2020-01-15王萌萌孔凡虹宗曾艳张水兰阚丽娟汤花梅张秀明
王萌萌,孔凡虹,宗曾艳,,张水兰,阚丽娟,汤花梅,张秀明,,熊 丹,△
(1.安徽理工大学医学院,安徽淮南 232000;2.深圳大学第三附属医院医学检验科,广东深圳 518001)
人乳头瘤病毒(HPV)是一种球形无包膜的环状双链DNA病毒,主要通过性传播感染人皮肤和黏膜上皮。HPV感染易引发多种疾病,其中高危型HPV的持续感染是引起女性宫颈癌及癌前病变的主要原因;低危型HPV感染主要引起生殖器疣[1]。宫颈癌是世界上发病率位居第二的妇科肿瘤,仅次于乳腺癌。据调查,约99.7%的宫颈癌患者患有人乳头瘤病毒(HPV)感染,因此,了解我国不同地域HPV基因型的分子流行病学概况,对HPV早期、快速、准确检测和相关疾病的诊断与治疗具有重要意义[2]。本研究依据CNAS-CL02:《医学实验室质量和能力认可准则》对医学实验室检测系统性能评价的相关要求和CNAS-CL02-A009:《医学实验室质量和能力认可准则在分子诊断领域的应用说明》,CLSI-MM03和CNAS GL-039《分子诊断检验程序性能验证指南》等文件,对实时荧光定量PCR(qPCR)方法检测HPV-DNA试剂盒的重复性、准确度、检测下限和抗干扰能力进行评价,为使用该检测方法的实验室提供参考,并通过对深圳市罗湖区人民医院妇产科HPV感染情况的调查分析,了解深圳罗湖地区HPV15种高危基因型别的分子流行病学特征,为宫颈病变的早期防治提供理论依据。
1 资料与方法
1.1一般资料 选取2018年6月至2019年4月在深圳市罗湖区人民医院(下称本院)妇产科就诊的门诊和住院女性患者剔除给药后复查的检测结果,共23 272例,年龄为11~73岁,中位数为34岁。纳入标准:自愿进行宫颈筛查的女性;无宫颈手术治疗史;近期未服用过抗生素或其他抗感染药物。排除标准:用药治疗后复查患者;有子宫切除或宫颈病变史;有其他重症疾病或癌症的患者。按年龄分为5个年龄段,分别为≤25岁,26~35岁,36~45岁,46~55岁,≥56岁。
1.2仪器与试剂 上海之江Autrax192全自动核酸提取仪,上海宏石SLAN-96S荧光定量PCR仪,上海之江高危型HPV分型核酸测定试剂及其配套耗材。
1.3检测方法 依据CLSI-MM03和《医学实验室质量和能力认可准则在分子诊断领域的应用说明》以及厂家试剂说明书对qPCR方法检测HPV试剂进行重复性、准确度、最低检出限、分析特异度,抗干扰能力性能验证。并按照仪器和试剂盒操作SOP,对2018年6月至2019年4月在本院妇产科门诊和住院就诊的患者的宫颈脱落上皮细胞标本15种高危型HPV(16、18、31、33、35、39、45、51、52、56、58、59、66、62、68、82)检测结果大样本调查,根据厂家说明书判读实验结果。样本Ct≤38,且扩增曲线呈典型的S型时,为阳性;Ct显示“No Ct”时为阴性;Ct值在38~40之间,须重测,如仍在38~40之间,且扩增曲线呈典型的S型时为阳性;若呈非典型S型曲线则为阴性。若样本在所有混合液中均为阴性;或样本在混合液I(含IC)的通道Ct值>32或显示“No Ct”,且在混合液I的其余通道以及其余混合液的各通道Ct栏都显示“No Ct”,无法判断结果,说明提取过程或PCR检测存在问题,需重复试验。
1.3.1重复性 对Autrax全自动核酸提取仪及SLAN-96S荧光定量PCR仪全面维护保养,确保仪器正常工作状态。依据广州邦德盛生物科技有限公司的《标准物质、第三方质控产品目录手册》中相关产品浓度换算,分别取1 例HPV16型强阳性样本(20≤Ct≤26)(编号:HY,样本类型为宫颈脱落上皮细胞)、1例 HPV58型临界阳性样本(31≤Ct≤36)(编号LY,样本类型为宫颈脱落上皮细胞)和1例 HPV阴性(无扩增)样本(编号:YX,样本类型为宫颈脱落上皮细胞),每次5个重复,分4批测定,共计20个数据,记录每次检测结果,如为阳性,则记录相应亚型的Ct值。阈值设为默认值。根据相应阳性样本的阳性型别Ct值,计算均值、SD值、CV值。计算4次实验的总阴阳性符合率,依据CLSI-MM17A文件关于重复性指标要求,可知要求4次实验的总阴阳性符合率均≥95.00% ,且每次实验相应阳性样本的阳性型别的Ct值的CV值≤5.00% 。
1.3.2准确度 通过分析本实验室参加2018年卫生部临床检验中心室间质评结果,从室间质评统计结果评价实验室定性检测结果的一致性,从而评价和验证实验室检测结果的准确性。上海之江高危HPV试剂盒室间质评的样本中仅涉及到HPV16、31、52以及低危型HPV6和阴性样本的型别,故本实验的室间质评通过检测已知的这5个标准物质样本,进行准确度评估。依据CLSI-MM17A和CNAS GL-039文件关于准确度指标要求可知,阴阳性符合率≥95.00%,则准确度符合要求。
1.3.3测定下限 检测下限的实验设计依据上海之江高危型HPV试剂盒说明书和《感染性疾病个体化医学分子检测技术指南》,具体方法取1例阳性对照品稀释至Ct值约等于35(浓度约在10 000 copy/mL,厂家声称的检测下限)进行10次扩增,记录每次检测结果,如为阳性,则记录相应的Ct值。评判标准参考CNAS GL-039文件关于检测下限的标准可知,10次扩增结果,检测出的总阳性符合率均≥95%,则符合标准。
1.3.4分析特异度 分别选取约3×104copy/mL(Ct值为29~31)的HPV16型阳性样品,HPV18型阳性样品,HPV52型阳性样品和HPV阴性的标本,加入包含HPV11型、HPV6型、HPV42型、HPV43型、HPV44型、HPV73型、HPV26型、HPV53型、沙眼衣原体、解脲支原体、淋球菌、人型支原体、生殖支原体、白色念珠菌、HIV-1和B 组链球菌的质粒,质粒浓度约5×106copy/mL,然后进行检测,重复2次。参考CLSI-MM03和CNAS GL-039对于分析特异度评价标准,阴阳性符合率≥95% ,则结果符合标准。
1.3.5抗干扰能力
1.3.5.1抗交叉反应 上海之江公司提供一个包含HPV11、 6、42、43、44、73、26、53型、沙眼衣原体、解脲支原体、淋球菌、人型支原体、生殖支原体、白色念珠菌、HIV-1、B 组链球菌的质粒,质粒浓度约5×106copy/mL,分别加入到10例HPV分型阴性标本内,进行扩增。依据上海之江高危型HPV试剂盒说明书和CNAS GL-039标准要求10例HPV分型阴性标本的扩增结果,检测出的总阴性符合率≥95%。
1.3.5.2内源性干扰 依据上海之江高危型HPV试剂盒说明书和《标准物质、第三方质控产品目录手册》取一份HPV16型阳性样本分成4份,各300 μL,每份标本加入健康者的红细胞0、6、10、12 μL的样本进行提取,提取DNA后再进行复孔扩增,重复3次。依据CNAS GL-039标准,要求每个样品的Ct值CV值均≤5%,并评判符合性。
1.4流行病学调查 对2018年6月至2019年4月本院妇产科送检样本,共23 272例,年龄11~73岁,按年龄分为5个年龄段,分别为≤25,26~35岁,36~45岁,46~55岁,≥56岁,进行调查分析。
1.5统计学处理 采用Excel与SPSS22.0软件,通过χ2检验对本院2018年6月至2019年4月妇产科5个年龄组HPV感染的阳性检出率进行统计与分析,P<0.05认为不同年龄段之间的HPV的感染率差异存在统计学意义。
2 结 果
2.1重复性 每次实验的每个亚型的阴阳性符合率及4次实验每个亚型总阴阳性符合率均为100%。每次实验相应阳性样本的阳性型别的Ct值的CV值均≤5%,见表1。该试剂批内及批间重复性良好,满足临床要求。
2.2准确度 5个样本检测的不同型别的HPV检测结果和室间质评结果均一致,符合率为100%(5/5),HPV基因分型检测准确度符合要求。见表2。

表1 HPV-DNA 重复性验证实验结果
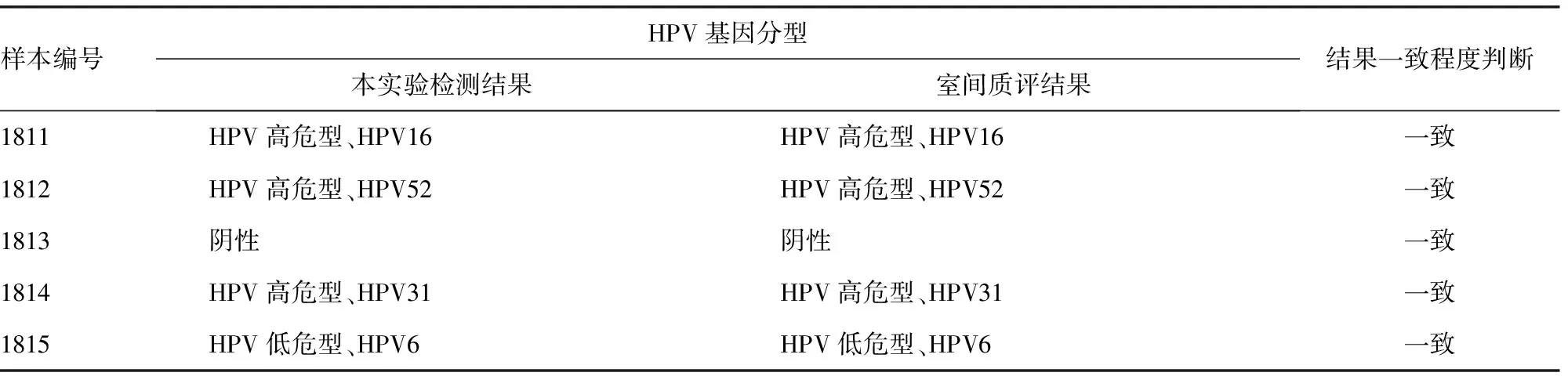
表2 HPV基因分型一致性比对结果
注:批次为2018年第11次室间质评实验的5个样本。
2.3测定下限 15种型别阳性10次测得均值均为阳性,阳性符合率为100.00%(10/10),符合临床检测要求,见表3。
2.4分析特异度 加入干扰物之前后,同一样本,同一型别的HPV检测结果Ct值均值显示,阳性结果(Ct≥38)和阴性结果(无Ct值)的符合率均为100.00%,符合临床检测要求。见表4。
2.5抗干扰能力
2.5.1抗交叉反应 10例HPV阴性标本加入干扰物前后扩增后检测结果均为阴性,阴性符合率=100.00%(10/10),表明无交叉反应,符合本实验室要求。
2.5.2内源性干扰 当标本中红细胞的浓度达到4.00%,每个样品的Ct值CV值均≤5.00%,表示对检验结果依然没有影响。说明当标本中红细胞的浓度为4%,对检测结果没有干扰。
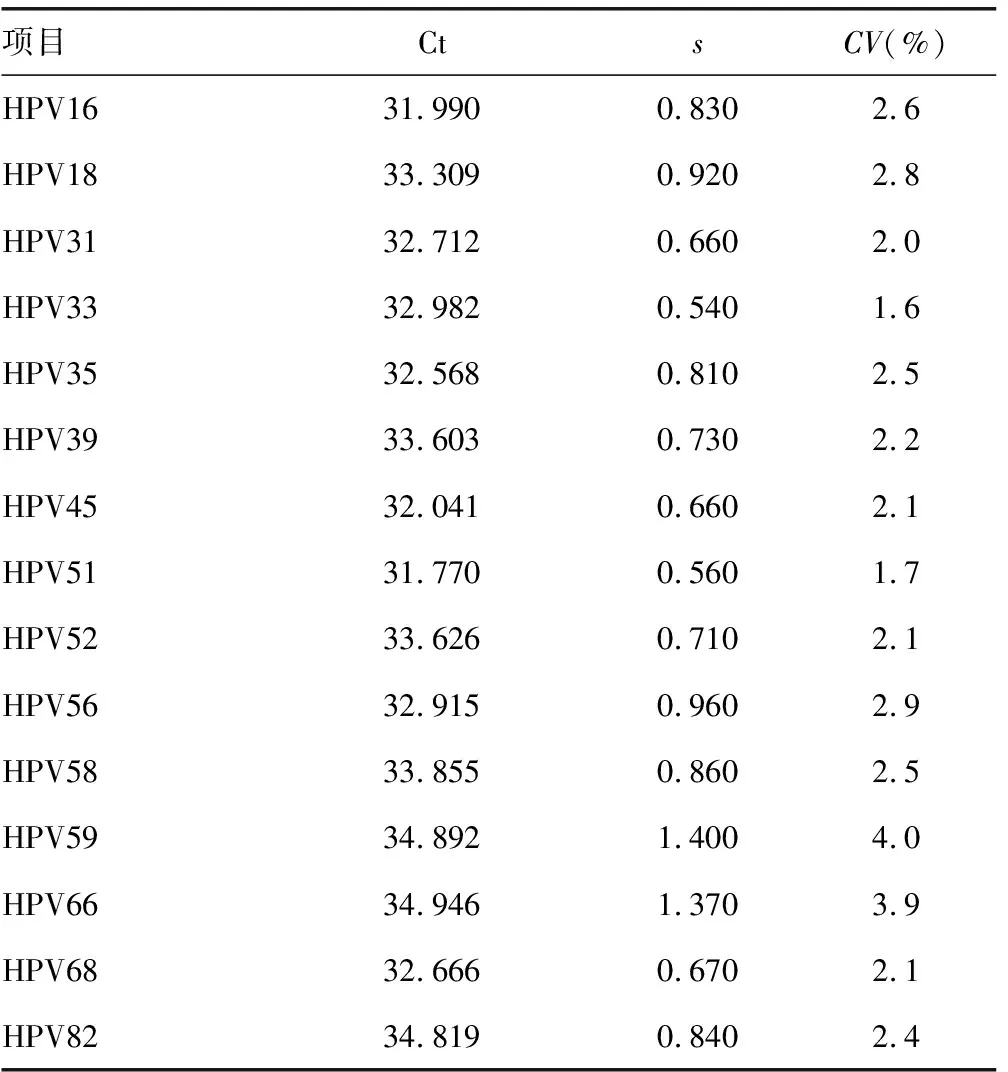
表3 测定下限实验结果
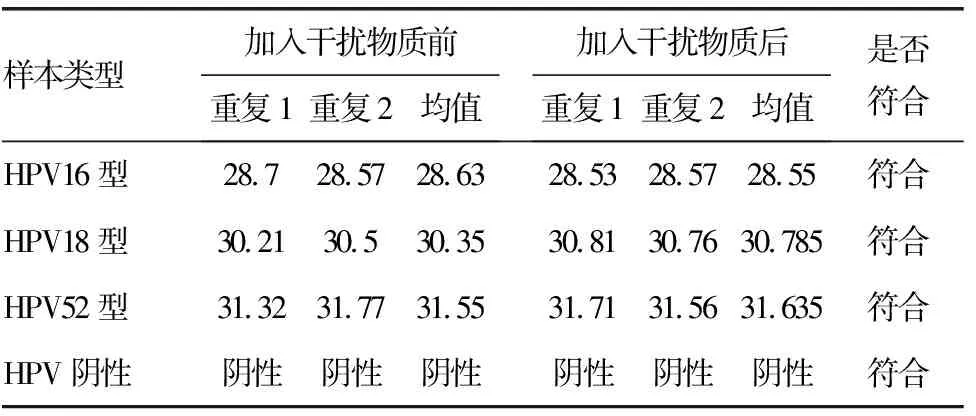
表4 分析特异性实验结果(Ct值)
2.6感染情况调查
2.6.1HPV感染总体情况及亚型结果 本次研究调查的23 272例15种HPV高危亚型就诊女性当中,有4 601例感染HPV,感染率为19.77%,其中以单一亚型感染率高达3 443例,占总感染率的74.83%;多重感染有1 158例,占总感染率的25.17%。同时感染HPV基因型种类可高达7种亚型(HPV16、33、45、52、56、58、66型)。感染率居前5位亚型分别为HPV56(5.00%)、HPV58(3.00%)、HPV16(2.70%)、HPV51(2.30%)、HPV68(2.00%)。
2.6.2不同年龄段HPV感染及亚型分析 受检者按年龄不同分为5组:≤25岁组、26~35岁组、36~45岁组、46~55岁组、≥56岁组。≤25岁组HPV感染率为28.70%(594/2 070);26~35岁组HPV感染率为20.41%(1 468/7 192);36~45岁组感染率为17.89%(2 364/13 211),46~55岁组感染率为20.56%(133/647),≥56岁组感染率为27.63%(42/152),HPV总感染率在26岁以下最高,形成第一个高峰,随之逐渐降低,在36~45岁达最低,在46~55岁有所抬高,各年龄组感染率成“U”形分布。见图1。≥56岁组与≤25岁组和45~55岁组间的HPV总感染率比较差异无统计学意义(P>0.05),此外46~55岁组与26~35岁组以及36~45岁组之间的差异也没有统计学差异(P>0.05)。其余两两比较差异均有统计学意义(P<0.05)。
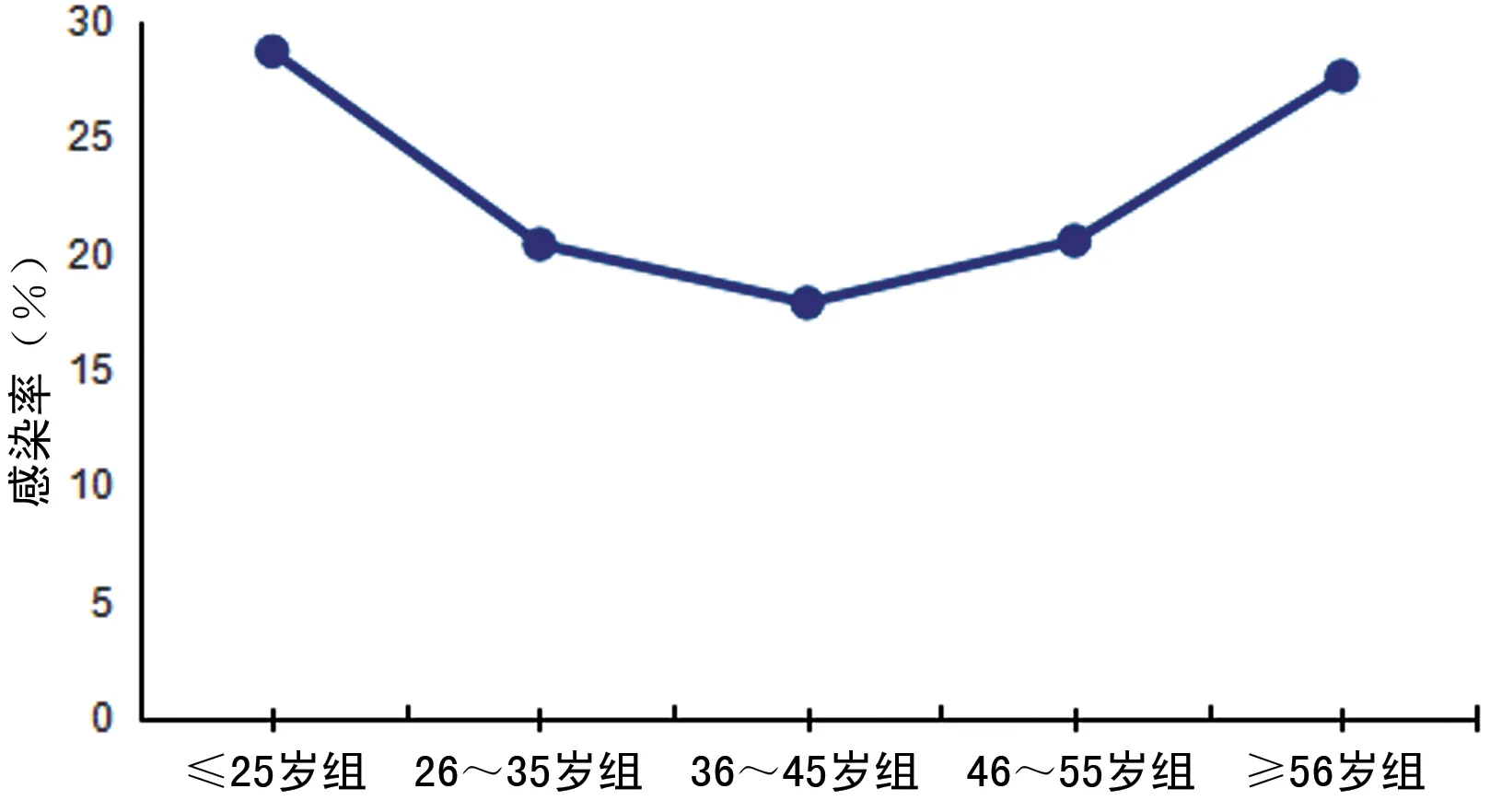
图1 各年龄组HPV总感染率分布
3 讨 论
宫颈癌在女性肿瘤发病率中居第2位,是女性最常见的恶性肿瘤之一[3-5]。HPV感染是目前确认的宫颈癌发生的重要因素[6-7],几乎所有的宫颈癌中均可检测到HPV感染[8-9]。高危型HPV持续感染与宫颈癌发生密切相关,主要包括HPV16、18、31、33、35、39、45、5l、52、56、58、59、68、26、53、66、67、69、73、82等型别[10-11]。因此,高危HPV检测对宫颈癌筛查具有重要意义。新试剂和新项目引进之前需要进行性能验证,本实验室采用上海之江生物的Autrax192全自动核酸提取仪和上海宏石SLAN-96S荧光定量PCR仪,依据CNAS-CL02:《医学实验室质量和能力认可准则》,对医学实验室检测系统性能评价的相关要求和CNAS-CL02-A009:《医学实验室质量和能力认可准则在分子诊断领域的应用说明》,CLSI-MM03,CLSI-MM17A和CNAS GL-039等文件,对上海之江HPV高危分型试剂盒的重复性、准确度、检测下限和抗干扰能力进行了评估。研究结果显示,HPV高危分型试剂盒每次实验的每个亚型的阴阳性符合率及4次实验每个亚型总阴阳性符合率均≥95.00% ,且每次实验相应阳性样本的阳性型别的Ct值的CV值均≤5.00%,参与室间质评结果符合率为100.00%,表明该试剂盒测定重复性和准确度良好,满足临床检测要求。将1例阳性对照品稀释至Ct值约等于35(浓度约在10 000 copy/mL,厂家声称的检测下限),重复性检测,阳性检出率为100.00%,符合临床对临界阳性标本的检测要求。分别选取HPV16、HPV18、HPV52、HPV阴性标本,加入包含HPV11型、HPV6型、HPV42型、HPV43型、HPV44型、HPV73型、HPV26型、HPV53型、沙眼衣原体、解脲支原体、淋球菌、人型支原体、生殖支原体、白色念珠菌、HIV-1和B 组链球菌的质粒进行检测,加入干扰物质后检测的阴阳性符合率≥95.00%,检测特异性良好,各型别之间及与其他微生物之间无交叉反应,符合临床要求。当标本中红细胞的浓度达到4.00%,对检验结果依然没有影响,符合率100.00%,带血标本对检测无影响。说明该HPV高危分型试剂盒具有良好的重复性、准确度、检测下限和抗干扰能力,可满足临床和科研对宫颈拭子的分析需求,并可广泛使用于各等级医院进行的HPV感染的早期筛查和大范围使用。
妇产科就诊患者为HPV的高发人群,本研究使用实时荧光定量PCR方法对2018年6-12月以及2019年1-4月本院妇产科送检标本进行大样本调查。结果显示本院就诊女性HPV感染率为19.77%,低于WANG等[12]对中国的HPV总感染率的调查,与江等对深圳福田地区HPV感染率调查相近,但远高于江卫红等[13]对福田区女性HPV 10.60%的感染率初步认为该差异是由收集病例群体和标本例数导致的。此外不同地区的HPV感染率也存在很大差异。如李军等[14]对陕西地区HPV总感染率调查为32.14%,重庆地区HPV的总感染率为25.38%[15],福州地区为15.70%[16],可能与地域位置、当地经济条件、生活习俗及人口迁徙等有关。笔者认为可能由于受调查人群,气候条件,区域经济卫生条件,生活习俗及人口迁徙因素影响。
本次调查显示不同年龄段高危型HPV感染率呈“U”型分布,≤25和≥56岁HPV感染率最高,这与XUE等研究结果一致[17],与朱丹玲等[18]报道的<30岁组HPV高危亚型感染率最低不同,可能与样本调查量有关。在≤25是感染高峰期,可能是因为年轻女性宫颈发育不成熟,自身防御机能较差导致感染概率增高。随后,在26~35岁开始下降,36~45岁HPV感染率降到最低,可能由于女性宫颈发育成熟,机体抵抗病毒能力力较强。46~55岁感染率开始上升直至56岁以上女性HPV感染率形成另一个高峰期,可能是绝经期激素变化引起的机体免疫系统功能紊乱,对病毒抵抗力降低,导致病毒的持续性感染或处于潜伏期的HPV被激活[19]。因此应该加强深圳罗湖地区≤25岁和≥50岁女性HPV筛查力度,以减低降低宫颈病变风险。本次调查结果显示,深圳市罗湖区HPV高危型感染各年龄段高发的型别均为HPV56、HPV58、HPV16、HPV51、HPV68,故接种九价疫苗可有效预防宫颈癌发生。但针对本地区最常见的前5位高危亚型,九价疫苗仅涵盖58、16型,而56、68、51型等则未涵盖。因此通过了解我国不同地区的HPV的基因型感染情况,从而研发针对本国国情的多价疫苗,降低HPV的感染率具有重要意义。
4 结 论
本实验室所用的HPV高危分型试剂盒具有良好的重复性、准确度、检测下限和抗干扰能力,可满足临床和科研对宫颈拭子的分析需求,并可广泛使用于各等级医院。且通过对本地区HPV感染流行病学分析建议加大56岁以上的妇女HPV的筛查力度,普及26岁以下的妇女HPV九价疫苗注射。
