红枣提取物对虹鳟血清指标和头肾免疫相关基因表达的影响
2020-01-15李聪歌马雅雯朱荣帅黄琼波
刘 飞,王 凡,李聪歌,马雅雯,朱荣帅,黄琼波
(洛阳师范学院,河南洛阳 471934)
虹鳟(Oncorhynchusmykiss)于1959年引进国内,因其刺少肉多、味道鲜美、营养价值高、适应性较广、生产经济效益好等众多优点,其养殖规模迅猛发展,现已成为我国重要的冷水性经济鱼类。近年来,随着人民生活水平和对优质鱼肉蛋白需求的日益提高,鳟鱼养殖产量在2017年已达到4.146万吨[1],但仍存在很大的需求缺口。为应对大规模高密度养殖很可能带来的病害频发问题,开发绿色安全的鱼类保健饲料成为有效的重要途径。中草药具有高效、低毒、低残留等优点,作为饲料添加剂在水产动物病害防治中具有广阔的应用前景[2-3]。
红枣又名大枣,其味甘香甜,风味独特,不仅富含维生素C和多种矿物质等营养物质,还含有大枣多糖、大枣皂苷、环磷酸腺苷、芦丁等多种生物活性物质,具有调节免疫力、抗氧化等多样化功效[4-6],是药食兼用的佳品。近些年来,关于红枣提升机体免疫能力的研究报道较多,有研究表明大枣多糖能够刺激哺乳动物机体免疫器官,促进免疫细胞增殖分化,提高机体的特异性及其非特异性免疫效应[7-10];而关于红枣直接应用于经济养殖动物饲料以增强其机体免疫力的研究报道很少见[11]。本试验以虹鳟为试验对象,研究红枣提取物饲料添加对虹鳟幼鱼血清生化指标和头肾免疫相关基因表达的影响,以探讨红枣提取物作为鱼类饲料促免疫功能添加剂的可能性,从而为虹鳟健康绿色饲料研发和红枣的应用领域拓展提供参考。
1 材料与方法
1.1 试验材料
试验所用虹鳟幼鱼购自四川省眉山市东坡区天贵水产养殖场,体形正常,无病无畸形。暂养于冷水鱼循环养殖系统的饲养缸(直径1 m×高1 m)中备用。参考红枣在其他动物饲料中的适宜添加量[11],同时考虑虹鳟的食性及其饲料适口性,选用红枣20∶1提取物作为试验饲料添加剂,其购自陕西森弗天然制品有限公司。
1.2 饲料制作
设计以鱼粉和豆粕为蛋白源,豆油和鱼油为脂肪源的虹鳟基础饲料配方(见表1),分别添加0%、0.25%、0.5%、1%红枣提取物配置成4种试验饲料,其中0%为对照组饲料。饲料原料按比例称重、粉碎、混匀、加水后使用ZL-600颗粒机制得颗粒饲料,经24 h风干后装入密封袋中,置于-20 ℃冰箱保存备用。
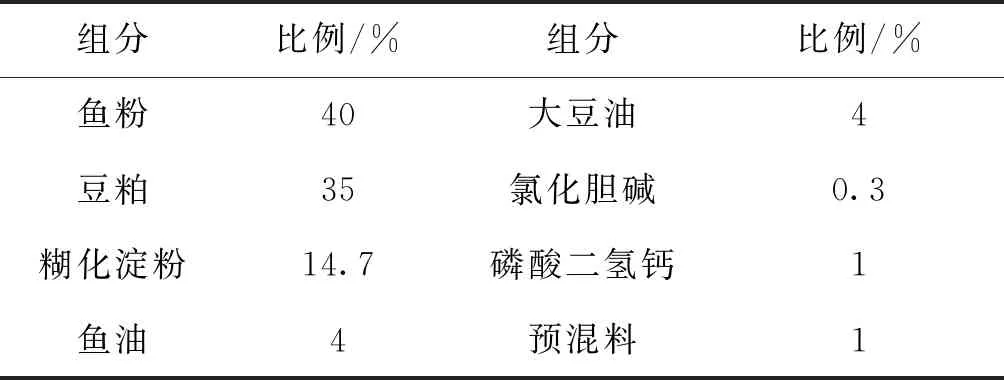
表1 虹鳟基础饲料配方Tab.1 Formula of rainbow trout basic feed
注:饲料原料购自中粮饲料(新沂)有限公司,预混料包括虹鳟所需的维生素和矿物质。
1.3 试验设计
暂养14 d后,试验分组前停食24 h,选取大小基本一致(体长7.2~8.4 cm)、生长状态良好的虹鳟幼鱼随机分成4组,分别投喂添加0%(对照组)、0.25%、0.50%、1.00%红枣提取物的4种试验饲料,试验养殖期为56 d,每组设置3个平行缸,每缸30尾。每天分3次按体重2%~5%进行定时定点饱食投喂。全天使用氧气泵增氧和水体循环过滤、每天及时清理残饵残渣、清洗滤材和适量换水,以保持溶氧充足和水质良好。饲养期间水温为11~15 ℃,pH 7.0±0.2,DO>8 mg/L。
养殖试验结束,停食24 h后,每个试验组随机取18尾,测量体长、体重,鱼体酒精棉消毒后,尾静脉采集血液于离心管中,室温放置1 h,4 ℃过夜后,3 500 r/min离心15 min,制取血清,每三尾鱼为一个混合样(共6个样品)保存备用。同时试验鱼取血后在冰上进行解剖,取头肾放入无RNA酶离心管中。所取样品置于-80 ℃超低温冰箱保存备用。
1.4 血清生化指标的测定
谷丙转氨酶(GPT)、谷草转氨酶(GOT)、溶菌酶(LZM)活性、酸性磷酸酶(ACP)和碱性磷酸酶(AKP)活性、以及尿素氮(BUN)、肌酐(CREA)、总蛋白(TP)、补体4(C4)、肿瘤坏死因子(TNF-α)和白介素6(IL-6)含量等血清指标均按照相应试剂盒(南京建成生物工程研究所)说明书进行测定。超氧化物歧化酶(SOD)采用WST-8法进行测定,其试剂盒购自碧云天生物技术公司。
1.5 头肾免疫相关基因表达测定
从-80 ℃冰箱中随机选取5个先前保存备用的虹鳟头肾组织,采用总RNA 极速提取试剂盒(上海飞捷生物技术有限公司)提取RNA。采用东洋纺生物科技有限公司试剂盒进行反转录。将反转录后得到的各样本的cDNA、目的基因和内参基因(EF1 alpha)的上下游引物[12-13](见表2,华大基因合成),按照Bestar SYBR Green qPCR MasterMix(德国DBI公司)说明书步骤制备20 μL的实时荧光定量PCR反应体系,然后放入实时荧光定量PCR仪(美国伯乐)中进行扩增。反应程序为:95 ℃ 2 min;95 ℃ 10 s,55 ℃ 30 s,72 ℃ 30 s,40 cycles;95 ℃ 1 min,55 ℃ 1 min,55~98 ℃(10 s/cycle,0.5 ℃/cycle)。荧光定量PCR结束之后提取各基因的Cq值,并用2-ΔΔt法计算目的基因的相对表达结果。

表2 实时荧光定量PCR引物序列Tab.2 Gene primers used for real-time PCR
1.6 数据分析
所有数据采用EXCEL2016进行整理,采用SPSS 13.0对实验数据进行单因素方差分析,各指标数据表示为平均值±标准差,采用LSD法来分析各浓度处理组与对照组之间的差异显著性,P<0.05为存在显著差异,P<0.01为极显著差异。
2 结果与分析
2.1 红枣提取物对虹鳟肝肾功能的影响
各试验组GPT和GOT活性、BUN和CREA含量检测结果见表3。从表中可看出,除0.25%红枣提取物组的GOT活性相对于对照组有增加外,其他所有三个浓度的红枣提取物添加组在这4个指标上均相对于对照组呈现下降趋势。其中,与对照组相比,CREA含量和BUN含量三个浓度组均出现极显著下降;GPT活性在0.50%和1.00%红枣提取物组极显著下降;GOT活性也在0.50%和1.00%红枣提取物组出现一定程度的下降,但无显著差异。
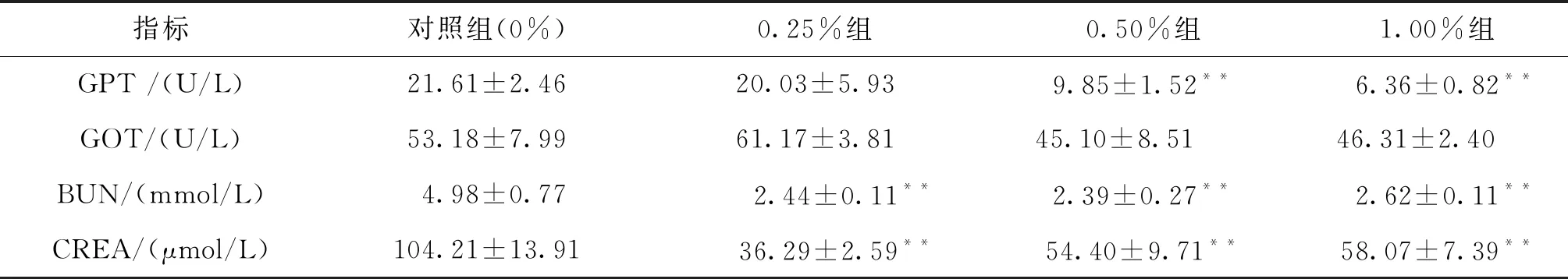
表3 红枣提取物对虹鳟肝肾功能血清指标的影响Tab.3 Effects of jujube extracts on liver and kidney function indexes in serum of O.mykiss
注:*表示与对照组相比差异显著(P<0.05),**表示与对照组相比差异极显著(P<0.01),下同。
2.2 红枣提取物对虹鳟血清免疫指标的影响
各试验组虹鳟血清中与免疫相关的8个指标的测定结果见表4。从表中可以看出,与对照组相比,ACP和AKP活性在三个添加红枣提取物试验组基本均有下降趋势(仅0.25%红枣提取物组ACP略有上升),但均无显著差异。而其他的6个指标在三个添加红枣提取物试验组几乎均呈现增加趋势(除IL-6含量在1.00%红枣提取物组略有下降外),并且TP含量在0.25%红枣提取物组出现显著增加;LZM活性均显著高于对照组;SOD活性在0.50%红枣提取物组极显著增加;C4含量在0.25%和0.5%红枣提取物组均极显著增加;IL-6含量在0.25%红枣提取物组显著增加;TNF-α含量在0.25%和0.5%红枣提取物组也极显著增加。
2.3 红枣提取物对虹鳟头肾免疫相关基因表达定量分析
SOD、CAT、C3、Factor H、IL-1β和LZM等基因在不同红枣提取物浓度试验组的表达情况如下(图1)。与对照组相比,SOD、CAT、C3、Factor H、IL-1β和LSZ等基因表达量除CAT和LZM基因在0.25%红枣提取物组略有下调外,其他都呈现上调趋势。所得数据在进行单因素方差分析后,多重比较结果表明:与对照组(0%红枣提取物组)相比,SOD、IL-1β和C3基因在0.50%和1.00%红枣提取物组均为显著或极显著上调;Factor H基因在0.50%红枣提取物组呈显著上调;其他试验组各基因表达量虽也有一定上调趋势,但均不显著。总体而言,在这六个基因中,仅CAT和LZM基因未在红枣提取物添加组出现显著性上调。
*表示与对照组相比差异显著(P<0.05),**表示与对照组相比差异极显著(P<0.01)。
3 讨论
3.1 红枣提取物添加对虹鳟幼鱼血清生化指标的影响
血清生化指标水平能够多角度地反映机体的健康和营养状况。作为肝肾功能的重要血清指标,BUN和CREA含量能反相关地反映机体肾脏肾小球的滤过功能,而GPT和GOT活性能正相关地反映肝脏受损害的程度。本研究中,除0.25%红枣提取物组的GOT活性相对于对照组有增加外,其他所有三个浓度的红枣提取物添加组在这4个指标上均相对于对照组呈现下降趋势,且大多数组的多个指标均有极显著下降(详见表3),这说明红枣提取物添加不仅能较大程度地提高机体肾功能,而且对肝脏有一定的保护作用,这对于属于肉食性鱼类的虹鳟保持健康状况极为重要。董立军等[14]研究表明红枣浓缩汁能显著减低血清中的BUN含量;冯鑫欢等[15]的组织学研究也表明红枣水提物能有效保护糖尿病小鼠肝脏和肾脏,以减少损伤,这些均与本研究结果基本一致,均说明红枣摄入能保护或改善动物体的肝肾组织及其功能。
血清蛋白具有维持渗透压和pH、运输、调节生理作用、免疫作用以及营养作用等多种生理功能,因此血清TP含量能间接反映机体的营养和免疫水平[16]。 AKP和ACP是机体维持正常生长和健康所必需的酶,其变化能够在一定程度上反映吞噬细胞非特异性免疫能力的强弱[17]。本研究中血清ACP和AKP活性在红枣提取物各组均与对照组相比无显著差异,表明红枣提取物添加不能显著影响其吞噬细胞非特异性免疫能力。而红枣提取物组的TP含量在三个红枣提取物组均呈现增加趋势,且相对于对照组TP含量在0.25%组显著增加。这说明一定量的红枣提取物能通过增加血清TP含量提高机体的营养和免疫水平。
3.2 红枣提取物添加对虹鳟幼鱼非特异性免疫能力的影响
LZM能专一性水解微生物细胞壁肽聚糖中的β-1,4糖苷键,从而溶解细菌和抑制微生物生长,具有增强机体免疫力的作用[18]。本试验结果表明,血清中LZM活性三个红枣提取物组均显著提高,且头肾其基因表达也在较高红枣提取物添加量的两个组呈现上调趋势,这说明红枣提取物添加能明显增强LZM活性从而提高机体免疫力。常江等[19]的研究也表明红枣注射液能使小鼠溶菌酶含量增加,这与本研究结果具有一致性。而作为生物抗氧化防御系统重要关键酶的SOD和CAT,前者是天然存在的超氧自由基清除因子,将其歧化为过氧化氢;而后者能催化过氧化氢分解为水和氧气,从而最终避免细胞遭受氧化损伤。本研究结果中相对于对照组,0.50%组血清SOD活性极显著增加,0.50%和1.00%组头肾SOD基因表达极显著上调,CAT基因表达也呈上调趋势,这说明红枣提取物添加能强化虹鳟机体的抗氧化防御系统功能。有研究表明,适宜的枣粉添加饲料能显著提高蛋鸡血清总抗氧化能力[10];红枣水提物能提高糖尿病小鼠肝脏的SOD活性及其抗氧化能力[9];以西洋参提取物和红枣提取物为原料制成复方制剂对小鼠连续灌胃能显著提高其组织的SOD和CAT活性[20]。这些研究结果都说明红枣提取物添加能提高动物机体的抗氧化能力,从而增强其非特异性免疫能力。
鱼类补体系统是机体内最为复杂的限制性蛋白溶解系统,直接参与机体免疫防御,不论是在先天性免疫,还是获得性免疫过程中都有着重要的作用。C3是补体系统的最关键成分,处于补体经典、凝集素和旁路三条激活途径的汇聚点上;C4参与经典激活途径,而Factor H是补体激活家族的调节剂的成员[21-23]。在本试验中发现,与对照组相比,头肾C3基因和Factor H基因的表达量,以及血清C4含量在三个红枣提取物添加组均呈现增加趋势,且在0.50%组均呈现显著增加,而当添加浓度提高到1.00%时三个指标均有所回落。这说明红枣提取物添加能通过提高虹鳟体内补体水平来增强机体免疫力。
细胞因子中的促炎性细胞因子是一类主要由免疫系统细胞生成的具有许多强大生物学效应的内源性多肽,可介导多种免疫反应,主要包括TNF-α、IL-1β和IL-6等[24-25]。在本试验中相对于对照组,血清TNF-α含量在0.25%和0.50%组显著增加,IL-6含量在0.25%组显著增加,头肾IL-1β基因在0.50%和1.00%组呈极显著上调,这些说明红枣提取物添加能激活虹鳟机体的免疫体系,增强其免疫能力。张庆[26]报道大枣中性多糖能够促进小鼠腹腔巨噬细胞诱导分泌IL-1和TNF-α;姬玉洁[27]研究表明较高剂量的发酵冬枣粉能显著提高小鼠血清IL-2、TNF-α含量,这些与本试验研究结果基本一致。由此可见,适量的红枣提取物添加能通过提高细胞因子水平来促进动物机体免疫能力增强。
4 小结
综上,本试验的研究结果发现,适量的红枣提取物添加能起到显著增强机体肾脏功能,保护肝脏的作用,同时能显著提升血清LZM和SOD 活性,TP、C4 、IL-6和TNF-α的含量,以及显著上调头肾的C3、Factor H、IL-1β和SOD基因的mRNA表达量。
