不同发酵方式下枸杞饮料主要成分及其抗氧化活性
2020-01-13李佩佩颉向红王聪李冬冬刘军王丽萍张喜康马露刘敦华
李佩佩,颉向红,王聪,李冬冬,刘军,王丽萍,张喜康,马露,刘敦华
(宁夏大学 农学院,宁夏 银川,750021)
红茶菌又称胃宝,由乳酸菌、酵母菌、醋酸菌组合而成,原料经发酵,产生蛋白质、维生素、微量元素和茶多酚等营养物质,有降血脂和保肝等保健功能[1]。红茶菌生长因茶类如红茶、绿茶茶汤的不同受影响,以发酵液的pH和还原糖含量等指标评估其生长状况[2]。国内外研究发现大多数乳酸菌和酵母菌混合发酵使产品风味成分更复杂,呈现丰富的口感[3]。但结合乳酸菌和酵母菌制备发酵饮料时,不同的发酵方式是否影响发酵饮料品质的研究,目前还未见报道。本文以pH值和菌膜质量为指标来探讨红茶、绿茶两种茶汤对红茶菌生长情况的影响;测定红茶菌中分离出的酵母菌的生长曲线;采用乳酸菌和酵母菌制备发酵枸杞饮料,比较2种不同发酵方式过程中枸杞饮料的主要成分和抗氧化活性的变化,进而运用SPSS软件进行抗氧化活性与主要成分的相关性分析,建立回归模型[4],旨在为枸杞发酵饮料的开发提供理论依据。
1 材料与方法
1.1 试验材料
枸杞,市售;红茶菌,宁夏大学农学院培养;YPD培养基,山东浩中化工科技有限公司;WL培养基,上海信裕生物科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH),北京索莱宝科技有限公司;2,2′-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS),上海化成工业发展有限公司;D-酒石酸等标准品,北京索莱宝科技有限公司;甲醇(色谱纯)和硝酸铝等分析纯,银川伟博鑫生物科技有限公司。
1.2 仪器与设备
U3000HPLC色谱仪,ThermoFisher公司;6890-5975C气相色谱-质谱联用仪,美国安捷伦公司; DSX-280B灭菌锅,上海申安医疗器械厂;LRH培养箱,广州航信科学仪器有限公司。
1.3 实验方法
1.3.1 工艺流程

将大小颜色均一的枸杞在65 ℃浸泡30 min。打浆后加果胶酶和纤维素酶酶解,酶解液经杀菌后冷却,一组先接种2.5%乳酸菌(嗜热乳杆菌∶植物乳杆菌∶鼠李乳糖杆菌质量比为1∶2∶1,下同),在30 ℃下发酵40 h,再接种酵母菌二次发酵;另一组同时接种2.5%乳酸菌和酵母菌在30 ℃发酵40 h。发酵好的枸杞饮料装罐灭菌。
1.3.2 红茶汤、绿茶汤对红茶菌生长的影响
红茶菌培养液:参考左勇等[5]的方法。
培养红茶菌:
红茶/绿茶→浸泡15 min→过滤→冷却→接菌→发酵(纱布封住容器,30 ℃培养)
红茶菌菌液pH值和菌膜质量测定:每隔2 d测红茶和绿茶培养的红茶菌的pH值和菌膜质量,以探讨2种茶汤对红茶菌生长的影响。
1.3.3 粗分离非酿酒酵母并测定生长曲线
(1) 非酿酒酵母的粗分离
参考分离红茶菌的文献[6]和GB 4789.2-2010,符合要求的活菌接到YPD培养液培养,初步粗分离得酵母菌。
用WL培养基对粗分离酵母菌复筛,根据非酿酒酵母能把赖氨酸作为氮源的特性再次筛选,能在含赖氨酸的培养基上生长的为非酿酒酵母[7]。
(2) 测定非酿酒酵母生长曲线
接种1.5%活化菌于YPD培养液,28 ℃恒温培养,新鲜培养基作对照,每隔2 h测OD600值。
1.3.4 乳酸菌和酵母菌单独发酵时枸杞饮料有机酸的测定
色谱条件[8]:HypersilC18色谱柱(250 mm×4.6 nm×5 μm),流动相:0.01 mol/LV(KH2PO4)∶V(甲醇)=98∶2,缓冲溶液(pH 2.8)过0.45 μm水系滤膜,流速:1.0 mL/min,进样量:10 μL,检测波长:210 nm,柱温为室温。
标准溶液:柠檬酸、D-酒石酸、L-苹果酸标准品用流动相溶解至2.0 g/L。
试样:流动相将2 mL枸杞饮料定容至10 mL容量瓶,取2 mL经0.45 μm微孔滤膜过滤到进样瓶,避光4 ℃保存。
1.3.5 总酚和黄酮含量的测定
参考KOLEY等[9]的方法,采用比色法测定。总酚标准曲线方程:y=0.096 5x+0.022 9(R2=0.999 1),黄酮标准曲线方程:y=0.008x-0.002 1(R2=0.999 7)。
1.3.6 体外抗氧化活性测定
(1)DPPH自由基清除率
根据BOLLING等[10]的方法作修改,甲醇稀释枸杞饮料,甲醇配0.04 mg DPPH/mL的溶液,在517 nm测处吸光度。DPPH自由基清除率按公式(1)计算:
(1)
式中:A0为空白组吸光度,A1为样品吸光度。
(2)ABTS自由基清除率
(2)
式中:A0为空白组吸光度,A1为样品吸光度。
(3)羟自由基清除率
根据YANG等[12]的方法。羟自由基清除率按公式(3)计算:
(3)
式中:Ax为试样吸光度,A0为空白对照样品吸光度,Ax0为水替代 H2O2的本底吸光度。
(4)超氧自由基清除率
根据兰永丽等[13]的方法作修改。取1 mL试样和0.4 mL邻苯三酚(25 mmol/L),反应25 min加1 mL 8 mmol/L的HCl,在299 nm处测的吸光值,空白为蒸馏水。超氧自由基清除率按公式(4)计算:
(4)
式中:Ax为试样吸光度,A0为空白对照样品吸光度,Ax0为水替代邻苯三酚的本底吸光度。
1.3.7 测定挥发性物质
采用顶空-固相微萃取和气相色谱-质谱联用技术。萃取条件:萃取头插入含3 mL试样的萃取瓶,推出100 μm PDMS萃取头。50 ℃水浴20 min,萃取15 min。再插入进样器250 ℃解吸5 min。GC和MS条件:参照林晓姿等[14]的方法。定性分析用NIST 11谱库检索结合人工谱图解析确定化合物;定量分析参照束文秀等[15]方法用峰面积归一化法。
1.3.8 数据处理
Origin 9.0绘图、Excel 2016统计数据并绘表、SPSS 20.0分析显著性和相关性并作多模型曲线拟合图。
2 结果与分析
2.1 红茶菌的培养情况
如图1所示,培养红茶菌的红茶和绿茶中pH都趋于快速下降且变化趋势在整个过程基本一致,说明两种茶中有机酸的积累速度和含量基本相同。绿茶中菌膜生成量明显大于红茶,可能因为绿茶没经过发酵,保留了茶叶的营养物质如茶多酚、碳水化合物、氨基酸、维生素和脂多糖等,能促进醋酸菌生长繁殖,利于形成菌膜[16]。综合pH值和菌膜量2个参数,采用绿茶汤培养红茶菌。

图1 对红茶菌发酵液菌膜生成量和发酵pH值的影响Fig.1 Effects of fermentation liquid of tea fungus on the production of membrane and fermentation pH
2.2 非酿酒酵母生长曲线的测定结果
如图2所示,非酿酒酵母在10~18 h进入对数期,20 h后进入稳定期。区别于酿酒酵母,非酿酒酵母在发酵时产生酯酶、糖苷酶、脂肪酶、蛋白酶和纤维素酶等。这些酶与特定底物结合,酶解未加工汁液中的大分子物质(果胶、纤维素、蛋白质、半纤维素和木质素等),促进汁液的澄清,有利于发酵过程中风味物质的释放,改善饮料的口感、风味和香气[17]。

图2 酵母菌生长曲线Fig.2 Yeast growth curve
2.3 乳酸菌和酵母菌单独发酵枸杞饮料时产物含量对比
与未发酵的枸杞饮料进行对比,经乳酸菌、酵母菌发酵后饮料的有机酸、总酸含量都显著提高,pH值降低,还原糖含量减少。对比乳酸菌和酵母菌单独发酵液,发现柠檬酸和总酸含量在乳酸菌发酵液中明显多于酵母菌发酵液,而酵母菌发酵后D-酒石酸和L-苹果酸含量明显更多。总体显示乳酸菌产酸能力更强(表1、表2和图3)。

表1 有机酸标准曲线方程Table 1 Standard curve equation for organic acids
注:x表示有机酸,mg/g,y表示峰面积。

表2 枸杞饮料中乳酸菌和酵母菌发酵后产物含量Table 2 Content of lactic acid bacteria and yeast fermented products in Lycium barbarum beverage
注:数据为平均数±标准差。表中*代表差异显著(P<0.05);**代表差异极显著(P<0.01)。下同。
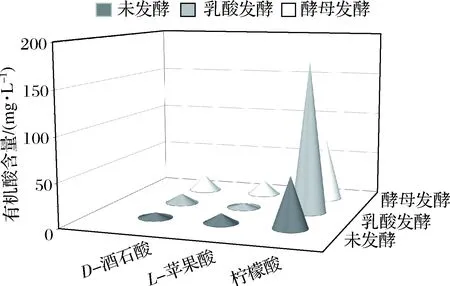
图3 乳酸菌和酵母菌发酵后有机酸的含量Fig.3 Organic acid content after fermentation of lactic acid bacteria and yeast
2.4 不同发酵方式对枸杞饮料的主要成分和抗氧化活性变化分析
2.4.1 枸杞饮料发酵过程中pH值和还原糖的变化
pH是发酵过程影响风味的重要参数,其变化可能是发酵时有机酸浓度增加所致[18]。由图4可知,pH值在0~84 h总体呈下降趋势,0~36 h下降较快,36 h 后趋于平缓。这与MENEZES等[19]研究的益生菌酵母和乳酸菌组合起始培养物生产玉米饮料的pH有相似的变化趋势。2种不同发酵方式下枸杞饮料还原糖含量都显著性降低,但先乳酸菌发酵再酵母发酵还原糖含量下降更显著。

1LAB,2SB-先乳酸菌发酵,再酵母发酵;LAB+SB-乳酸菌和酵母菌同时发酵图4 发酵枸杞饮料过程中pH值和还原糖的变化Fig.4 Changes of pH and reducing sugar during fermentationof lycium barbarum juice注:图中不同小写字母表示差异显著(P<0.05),反之不显著。下同。
2.4.2 枸杞饮料发酵过程中总酚和总黄酮的变化
酚类影响枸杞饮料的色泽和香味,在抗氧化功能中也发挥重要作用[20]。由图5可知,2种发酵方式下枸杞饮料的总酚和总黄酮含量在0~84 h均呈升高趋势,且先乳酸菌发酵再酵母菌发酵枸杞饮料的总酚和总黄酮含量均高于混合发酵。未发酵时,可溶性结合酚羟基与长链醇类结合,Folin-酚法不能与其反应,故总酚含量整体偏低;而发酵后,微生物将可溶性结合酚分解成小分子酚释放出来,故发酵后总酚含量增加[21]。发酵过程中黄酮会随发酵周期的增加被溶解,含量显著增加[22]。

图5 枸杞饮料发酵过程中总酚和总黄酮的变化Fig.5 Changes of total phenols and total flavonoids during the fermentation of lycium barbarum beverage
2.4.3 不同发酵方式过程中枸杞饮料抗氧化活性变化
用4种抗氧化方法评价不同发酵方式下枸杞饮料的抗氧化活性。总酚和总黄酮决定DPPH自由基清除率的变化[23]。在2种发酵方式下枸杞饮料DPPH自由基清除率变化趋势相反,相对于混合发酵时DPPH清除率先增加后减少,先乳酸菌发酵再酵母菌发酵时始终增加;ABTS自由基清除率均有所增加,但先乳酸菌发酵再酵母菌发酵时增加更显著,增加了26.663%;超氧自由基清除率均降低,羟自由基清除率则均显著升高。可能由于氧化反应不能被超氧自由基阻止,反而有助于形成羟自由基[24]。又因酚类和黄酮类物质都有较强的自由基,且发酵过程生成有抗氧化性的产物,故枸杞发酵饮料的抗氧化活性总体显著增高[25]。
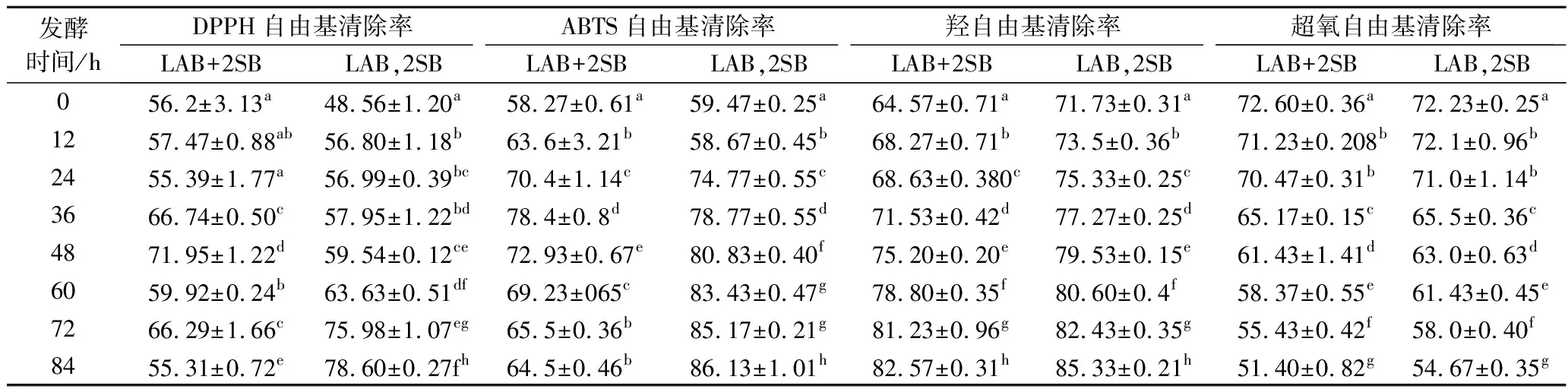
表3 发酵枸杞饮料的抗氧化活性变化 单位:%
注:同列不同小写字母表示差异显著(P<0.05)。
2.5 主要成分与抗氧化活性的相关性分析
2.5.1 Pearson相关性分析
依据2.4结果,选择先乳酸菌发酵、再酵母菌发酵的方式制备枸杞饮料,测定其主要成分与抗氧化活性,并分析相关性。
由表4可知,总酚与DPPH自由基清除率(r=0.918,P<0.01)、ABTS自由基清除率(r=0.79,P<0.05)、羟自由基清除率(r=0.925,P<0.01)呈显著性正相关,与超氧自由基清除率(r=-0.931,P<0.01)呈显著性负相关。总黄酮与DPPH自由基清除率(r=0.896,P<0.01)、羟自由基清除率(r=0.851,P<0.01)呈显著性正相关,与超氧自由基清除率(r=-0.862,P<0.01)呈显著性负相关。与任红等[26]关于黄酮抗氧化性和CHAILLOU等[27]关于多酚抗氧化性的研究结论相似,本研究发现总黄酮、总酚对发酵枸杞饮料抗氧化活性起决定性作用,但在不同抗氧化体系中它们的影响程度不完全一致。由相关系数得枸杞饮料中不仅黄酮和多酚有抗氧化性,其他如类胡萝卜素、活性多糖等也有抗氧化能力。这与YANG等[28]关于枸杞汁抗氧化活性还与其他成分如还原糖等有关的研究结论相似。
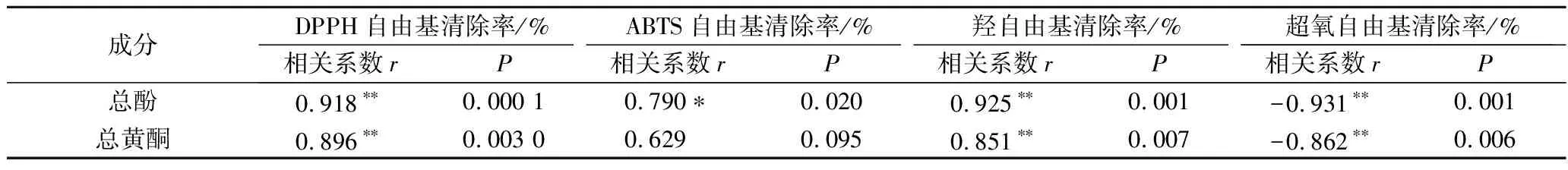
表4 主要成分与抗氧化活性的Pearson相关性分析结果Table 4 Pearson correlation analysis of main components and antioxidant activity
注:**表示P<0.01,呈显著性相关。下同。
2.5.2 回归模型分析
由2.5.1的分析结果,对和抗氧化活性相关系数最大的成分进行多模型曲线拟合,建立回归方程,见表5和图6-a~图6-d。由表5可知,DPPH自由基清除率、ABTS自由基清除率、超氧自由基清除率的二次项曲线决定系数R2最高,建立回归方程分别为:y=38.220-2.257x+2.355x2(y-DPPH自由基清除率)、y=-428.218+258.236x-32.166x2(y-ABTS自由基清除率)、y=195.193-60.371x+6.602x2(y-超氧自由基清除率),x均表示总酚含量,mg/L。
羟自由基清除率的对数曲线决定系数R2最高,建立回归方程:y=43.657+26.868lnx(x-总酚含量,mg/L;y-羟自由基清除率)。

表5 抗氧化活性试验的多模型拟合结果Table 5 Multi-model fitting result of antioxidant activity test

a-DPPH自由基;b-ABTS自由基;c-羟自由基;d-超氧自由基图6 自由基清除率与总酚的曲线拟合图Fig.6 Curve fitting of free radical scavenging rate and total phenol
2.5.3 挥发性成分的分析
发酵过程产生的次生代谢产物影响饮料的香气,其中挥发性物质决定饮料的品质[29]。由表6和图7可知,发酵后挥发性物质有显著变化,先乳酸菌发酵再酵母菌发酵枸杞饮料产生的挥发性物质种类最多,包括醇类6种、烷烃类7种、酯类8种。
如图8所示,发酵枸杞饮料生成的主要风味物质是醇类、烷烃类、酯类。枸杞汁含少量醇类,发酵是产生醇类的主要来源,醇类均有香气,如3-辛烯-1-醇散发药草味,类似薰衣草的味道[30]。酯类主要由醇和酸的缩合反应和微生物代谢产生,其中甲酸辛酯、乙酸异戊酯、辛酸乙酯产生果香和酒香,可增加饮料的香气[31-32]。一些酮类化合物包括有豆香和果香的2,3-二氢香豆酮等可通过发酵、熏焙过程、脂质降解和氧化产生,赋予饮料花香、果香的香气[33]。
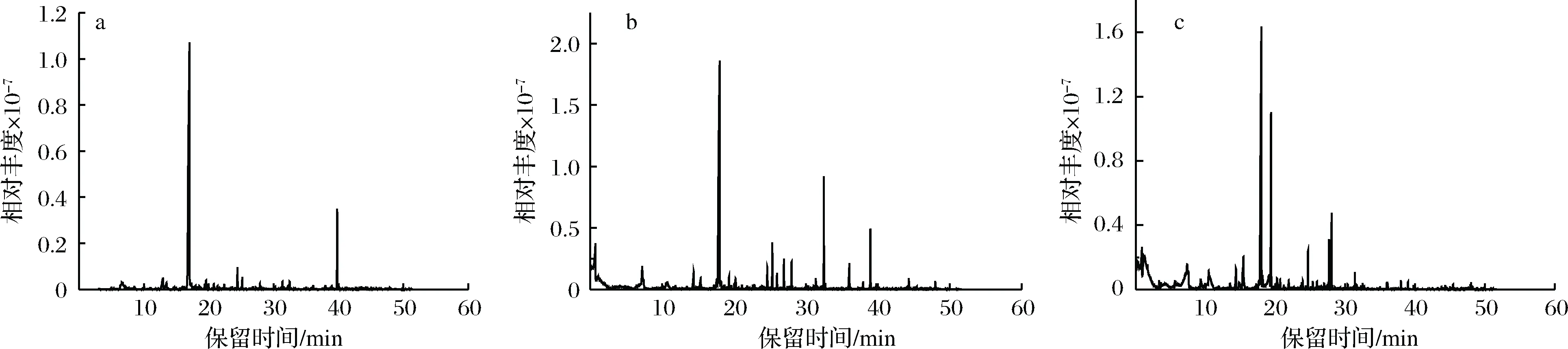
a-未发酵;b-LAB+SB;c-LAB,2SB图7 挥发性成分的总离子流图Fig.7 Total ion flow diagram of volatile components
3 结论
对比红茶和绿茶中红茶菌的菌膜质量和pH,发现绿茶更有利于红茶菌生长。从红茶菌中分离酵母菌,接种酵母菌和乳酸菌单独发酵枸杞饮料,结果显示,乳酸菌单独发酵枸杞饮料时柠檬酸和总酸含量较高,而酵母菌发酵枸杞饮料D-酒石酸和L-苹果酸含量更高。
枸杞汁为原料,接种2.5%乳酸菌和酵母菌(红茶菌中分离出的),采用混合发酵和先乳酸发酵再酵母发酵2种不同发酵方式在30 ℃制备发酵枸杞饮料。结果显示,2种不同发酵方式下枸杞饮料的pH、还原糖、总黄酮、总酚含量和抗氧化活性的变化趋势基本一致。与乳酸菌和酵母菌混合发酵相比,先乳酸菌发酵后再酵母菌发酵枸杞饮料的总黄酮、总酚含量较高,抗氧化活性更强;且生成6种醇类、7种烷烃类和8种酯类的挥发性风味物质。相关性分析表明,先乳酸菌发酵后再酵母菌发酵枸杞饮料的总酚和总黄酮含量与DPPH自由基清除率、ABTS自由基清除率、羟自由基清除率均呈显著性正相关,与超氧自由基清除率呈显著性负相关。

表6 挥发性物质分析 单位:%(相对含量)
续表6
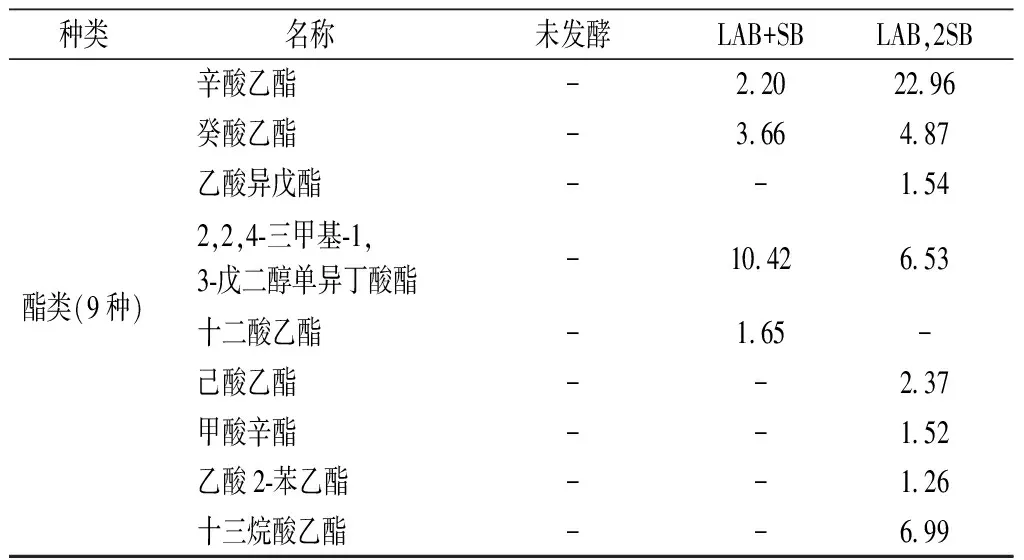
种类名称未发酵LAB+SBLAB,2SB酯类(9种)辛酸乙酯-2.2022.96癸酸乙酯-3.664.87乙酸异戊酯--1.542,2,4-三甲基-1,3-戊二醇单异丁酸酯-10.426.53十二酸乙酯-1.65-己酸乙酯--2.37甲酸辛酯--1.52乙酸2-苯乙酯--1.26十三烷酸乙酯--6.99
注:“-”表示未检出物质。

a-相对含量;b-种类图8 挥发性物质种类及相对含量Fig.8 Types and relative content of volatile substances
