Bi/BiOI可见光催化氧化去除NO的性能
2020-01-13幸小卜王鑫雅徐长长董帆
幸小卜,王鑫雅,徐长长,董帆
(1.重庆大学 环境与生态学院,重庆 400045; 2.重庆工商大学 环境与资源学院;催化与环境新材料重庆市重点实验室,重庆 400067)
能源短缺和环境污染是当今人们所面临的重大挑战,因此,利用太阳能解决能源问题和环境问题备受重视。自1972年Fujishima等[1]报道TiO2为电极光催化分解H2O以来,人们对光催化进行了一系列探索。研究显示,导致光催化技术无法得到有效应用的主要因素是其可见光利用效率和光量子效率较低[2]。当前,光催化剂的研究工作主要集中于对TiO2材料进行元素掺杂、半导体复合和加氢处理等手段;另一方面则是开发新型可见光催化材料,将光响应范围拓展至可见光范围内。如钛酸铋、钨酸铋、钒酸铋、铌酸铋、卤氧化铋、钼酸铋、碳酸氧铋及其他一些比较复杂的Bi基半导体催化剂[3-10]。
相关研究表明,Au、Ag、Pd等贵金属表面沉积的半导体,可以通过表面等离子共振(SPR)和肖特基效应有效提高电荷分离效率[11-14]。由于贵金属价格昂贵,一些具有类贵金属性质的廉价非贵金属开始被人们所青睐。Bi单质作为一种非贵金属等离子体,具有类贵金属的表面等离子效应。Bi单质不仅能够促进光吸收,同时,能有效促进光生电荷迁移,从而提高光催化活性[15-18]。研究者们在铋单质表面沉积调控光催化材料的微观结构与催化性能等方面取得了显著进展。例如,董帆等[19]通过将纳米Bi球引入g-C3N4体系,运用Bi单质的SPR效应成功提升了材料的可见光催化性能;熊婷等[20]将纳米Bi线负载到BiOI纳米片上,利用SPR效应、切面和氧缺陷的协同作用,成功提高了材料的可见光催化性。目前,关于NO光催化的研究主要集中在对光催化材料的形貌调控、电子结构优化、催化剂负载以及引入助催化剂等方面,而关于光催化反应过程中吸附、氧化以及中间产物变化等方面的研究相对较少。

研究采用室温沉淀法制备了Bi/BiOI分级微球,引入Bi单质,通过等离子体共振扩展催化剂对可见光的吸收范围,同时,激发肖基特结[24-25]迁移BiOI上的光生电子,有效提高光生电子与空穴的分离效率,并将制得的催化剂运用于净化大气污染物NO。通过一系列表征技术对催化剂的微观结构进行分析,本研究重点运用原位红外光谱对样品在可见光照射下催化氧化NO进行动态监测,并对其反应机理进行了分析。
1 实验
1.1 原料和制备方法
制备纯的BiOI。称取碘化钾0.166 g,加入30 mL去离子水中,搅拌至溶解。将1 mmol Bi(NO3)3·5H2O放于有磁力搅拌子的100 mL烧杯中,加入去离子水30 mL,搅拌至溶解。把配置好的碘化钾溶液滴加至硝酸铋溶液中,搅拌20 min,静置20 min。最后,用离心法分离出产物,将所得固体样品用水、乙醇各洗3次,于60 ℃烘箱中烘干。
制备Bi/BiOI。称取1 g PVP加入至100 mL去离子水中,搅拌至溶解。再加入2 mmol BiOI,搅拌20 min。然后,在此悬浮液中滴加入一定浓度的NaBH4溶液30 mL,搅拌1 h,静置1 h。最后,用离心法分离出产物,将所得固体样品用水、乙醇各洗2次,于40℃烘箱中烘干,得到的样品记为Bi/BiOI。
1.2 特征描述

1.3 可见光光催化活性评价

η(%)=(1-C/C0) ×100%
(1)

1.4 光催化净化NO原位红外研究
采用红外光谱仪(IENSOⅡFTIR, Bruker,德国),将催化剂放置于红外漫反射室(Harrick,德国)内进行原位测量分析。该红外漫反射室有3个窗口,包括2个进行红外测试的窗口和1个用可见光原(MVL-210,日本)进行光照的石英窗口。首先,将光催化剂样品放入红外漫反射室内,使用氦气(100 mL / min)去除残留的碳氢化合物、H2O和CO2。将通气一段时间后的实时红外光谱作为背景基线光谱。然后,将反应混合物(50 mL /min NO, 50 mL /min O2)通入红外漫反射室,用催化剂进行吸附20 min。接下来,使用可见光光源(MUA- 210)对催化剂照明1 h,每8 min探测到实时FT-IR光谱,同时,气通量保持不变(50 mL /min NO, 50 mL/min O2)。最后,每2 min用相同的气体通量记录下FT-IR光谱。红外扫描范围为600~4 000 cm-1,对催化剂上发生的光催化氧化过程进行分析。
2 实验分析与讨论
2.1 晶体结构分析
图1为BiOI与Bi/BiOI的XRD图谱。其中,BiOI与标准卡(PDF #41-1488) 比对后非常吻合,表示生成产物为BiOI晶体。而在加入NaBH4作为还原剂生成的Bi/BiOI样品中,代表BiOI的衍射峰强度明显减弱,并在XRD图谱中检测到一种新的物相,即Bi单质(PDF#85-1330)。通过XRD分析表明成功合成纯度较高的BiOI和金属Bi表面沉积的Bi/BiOI。
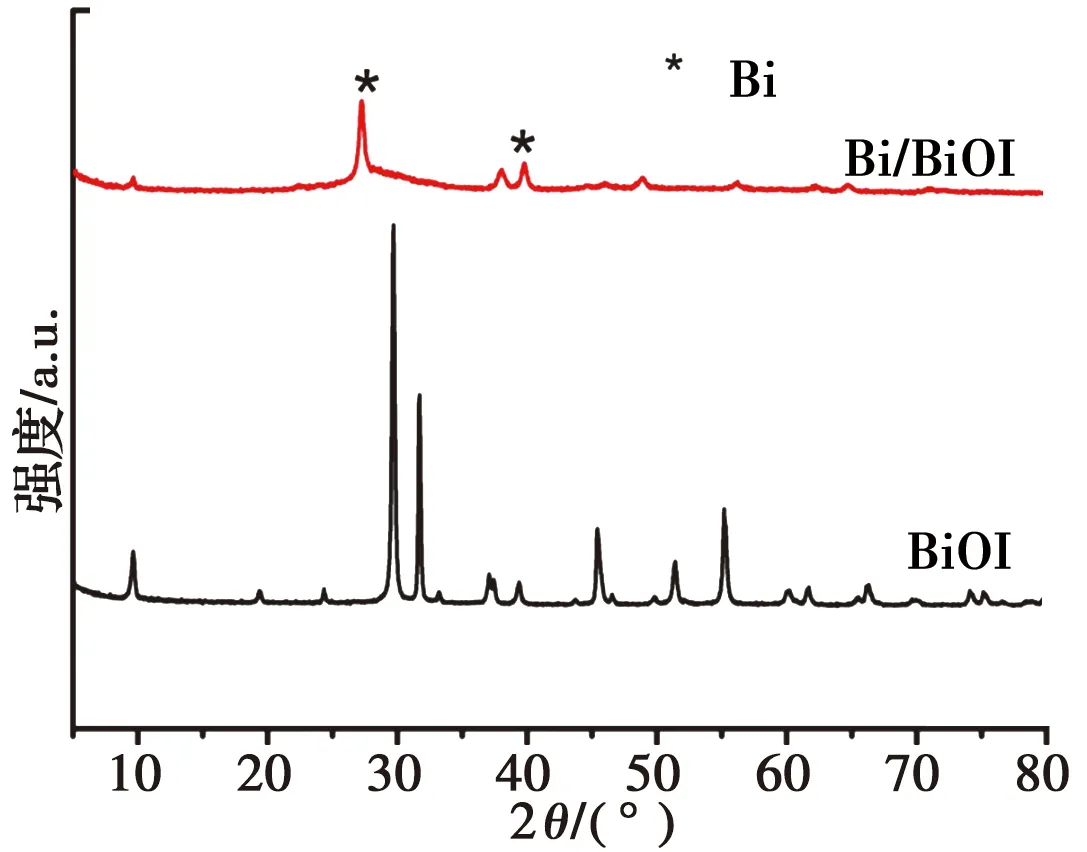
图1 BiOI及Bi/BiOI的XRD图谱Fig.1 XRD pattems of BiOI sample and Bi/BiOI
2.2 形貌分析
通过扫描电镜(SEM)可以直观观察制备样品的形貌特征。图2(a)、(b)为BiOI样品的SEM图,可以观察到制备的BiOI由约55 nm厚纳米薄片组成的微球花状结构,其直径大约2~3 μm。由图2(c)可知, Bi/BiOI也具有分级微球花状结构,但其形态与BiOI相比较更松散。Bi/BiOI表面均匀分布了细小颗粒,结合XRD测试结果,研究得出成功将铋单质负载到了BiOI表面。为进一步观察样品的微观结构,将样品进行TEM表征,如图 2(d)所示,可测得宽度为 0.277 nm的晶格条纹,接近于BiOI(001)晶面理论值0.283 nm。TEM和XRD的结果都表明, Bi成功掺杂到BiOI纳米片上并自组装形成BiOI微球花状结构。

图2 电子显微镜图像Fig.2 Electron microscope
2.3 XPS化学组成分析
X射线光电子能谱(XPS)对制备样品的元素组成进行表征,结果如图3所示。测量光谱表明所制备的样品中共存有Bi、O、I和C元素,其中,C为无定形碳。除此之外,无其他元素的峰值,这表明制备的样品具有较高纯度。

图3 BiOI及Bi/BiOI的的XPS图谱Fig.3 XPS spectra of BiOI sample and Bi/BiOI

2.4 光学性质分析
UV-Vis漫反射光谱可以表征样品光学吸收结果,如图4(a)所示。BiOI在可见光范围内有较强吸收,其吸收边缘在约525 nm,根据式(2)可计算出制得的BiOI对应的带隙宽度约为1.68 eV。
ΔEg=1 240/λ
(2)
值得注意的是,引入Bi单质金属后,Bi/BiOI几乎有完整的吸收光谱,特别是在可见光范围(450~800 nm)有强烈的吸收。这种由于Bi金属引起的对整个可见光区域的吸收可归结于形成了表面等离子体共振[11,17]。从图4(b)可以看出,BiOI的PL峰主要出现在465~550 nm处,Bi/BiOI样品的荧光强度比纯的BiOI低,说明Bi金属沉积后光电荷分离效率提升,使得光生电子与空穴的分离效率提高。

图4 BiOI及Bi/BiOI的光学性质图Fig.4 Spectra of optical properties of BiOI and Bi/BiOI
2.5 可见光催化活性分析
研究所制备样品在可见光照射下去除目标污染物NO的性能,结果如图5所示。从图中可知,BiOI的光催化活性较低,可见光照射30 min对NO的去除效率只有1.38 %,计算得到其反应速率常数k1(min-1)=3.836 8×10-4。可归因于BiOI分级微球结构对可见光具有表面折射与反射效应。然而,通过加入PVP和NaBH4溶液还原后制得的Bi/BiOI表现出较好的光催化性能,可见光照射30 min时对NO的去除效率为51.42%。将Bi引入后得到的Bi/BiOI样品显示出活性的增强,得到其反应速率常数k2(min-1)=0.023 9。
活性的显著提高可归因于金属Bi单质的引入改变了其电子结构,促进了光生载流电子的分离[31],同时,Bi单质的引入使得BiOI表面产生更多氧缺陷作为反应位点,具有更强的氧化能力[32],增强了其光催化活性,证实了Bi单质的引入对催化剂活性增强起着关键作用。
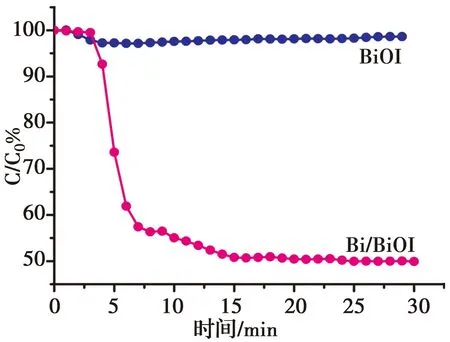
图5 BiOI及Bi/BiOI的可见光降解低浓度NO曲线图Fig.5 Visible light photocatalytic activities of BiOI and Bi/BiOI for low concentration NO
2.6 光催化氧化NO的反应机理
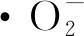
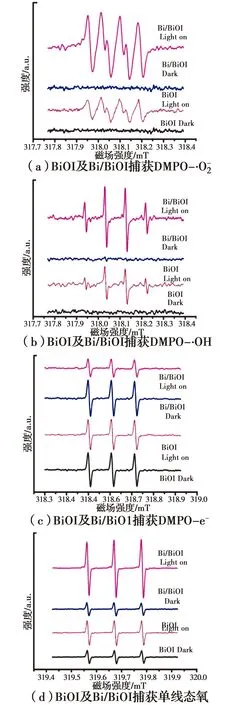
图6 BiOI及Bi/BiOI样品的ESR自由基捕获图谱Fig.6 ESR spectra of radical adduct trapped by
2.6.2 原位红外光谱分析 采用原位红外技术直接监测NO在BiOI和Bi/BiOI样品表面的吸附和反应产物,分析得到NO氧化机理。BiOI在无光照条件下对NO的吸附过程如图7(a)所示,通入O2后随着吸附时间增加,1 320~742 cm-1波长范围内NO的吸收峰呈现后逐渐趋于稳定[33],742 cm-1处出现的红外峰归属于NO2[34],表明NO被氧化为NO2。在可见光照射20~40 s后,NO3-波长段1 278~1 052 cm-1[33]的峰呈现上升趋势。1 013 cm-1可以标定为单齿NO3-,对比图7(a)和图7(b)发现1 217 cm-1的吸收峰增强。这说明在可见照射下BiOI具有一定催化降解NO的能力。
相同条件下,对Bi/BiOI样品进行测试,在无光照条件下,Bi/BiOI样品对NO吸附过程如图7(c)所示,说明Bi/BiOI样品的吸附能力明显强于BiOI,表明Bi掺杂使得样品对NO有较强的吸附能力。在1 275~800 cm-1区间内的吸收峰均呈现出先迅速升高,后逐渐稳定的趋势,10~12 min后, 样品吸附达到饱和状态, 吸附量不再增加。950~800 cm-1波长范围内的峰可标定为各种振动形态的NO2-,为NO的N桥接在两相邻的O原子上形成O—N—O键后所形成。在1 237~1 058 cm-1波数范围内的峰可标定为各种振动形态NO3-,此现象可能与氧缺陷激发产生的活性自由基有关,是NO2-被·OH氧化后的产物。
图7(d)为Bi/BiOI样品吸附NO 20 min后,在可见光照射下进行光催化氧化反应。从图中可以观察出,NO3-波长段的峰呈现上升趋势,有活性基团诱导迅速产生NO3-,随着可见光的照射,在波数1 329 cm-1和1 217~1 052 cm-1中检测到吸收峰,可标定为单齿亚硝酸盐和双齿亚硝酸盐[35]。由于单配位基NO3-不够稳定,在吸收能量后部分会转变成稳定性更好的1 278 cm-1处的双配位基NO3-[33]。同BiOI相比,硝酸盐相关物种的吸收峰明显增强,这与Bi/BiOI的活性测试结果相吻合。其光催化反应主要过程为







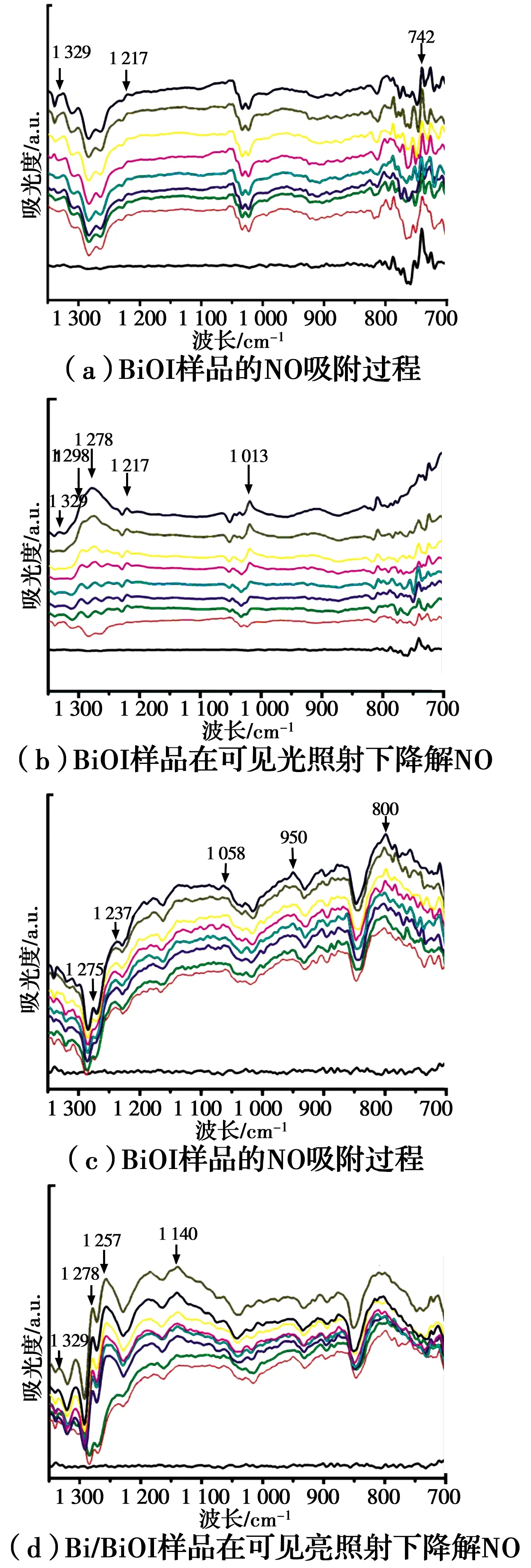
图7 原位红外图谱Fig.7 The in situ FT-IR
3 结论
通过沉淀法制备了BiOI和Bi沉积Bi/BiOI纳米级微球。研究表明,在可见光下,Bi沉积使得BiOI光催化性能更佳。相比于BiOI,Bi/BiOI电子的传递速率增强,促进强电子与空穴分离。改性后的样品在光催化反应过程中生成更多活性自由基团,改变了光催化氧化NO的反应路径,从而有效提高催化反应效率。运用原位红外动态监测,对样品吸附NO和在可见光照射下催化净化NO的反应过程进行研究,从分子层面揭示了相应的反应机理,为今后深入研究光催化机理提供了新的认识。
