磁力引导背景下的纳米颗粒靶向给药
2020-01-11戴卓君
戴卓君
在疾病的治疗中,药物治疗是不可或缺的一部分。对于某些疾病而言,例如,固体肿瘤,传统的给药方式往往具有生物分布差、毒性大、敏感性差等缺点,如何将药物准确、专一地输送到病灶,发挥其最大效果,一直是科学家致力的方向。
纳米颗粒靶向给药,实现精准治疗
近年来,使用纳米颗粒(Nanoparticle)作为药物载体对疾病进行治疗受到了研究者的广泛关注。这种给药的方式,可以通俗地理解为船和货物,纳米颗粒是船,包裹在颗粒里面的药是货物,当我们把纳米颗粒通过静脉注射的方式使其进入血管,就相当于船进入河流,每一艘航行的船都有它想要停靠的码头。而在人体的“河流”中,每一艘“小船”的“码头”就是引起疾病的病灶,比如,固体肿瘤。当承载着药物的纳米颗粒到达它的“码头”——病变组织,被精妙设计的它会以某种方式进行“卸货”,释放出的药物和病变组织进行一系列的反应,最后达到治疗的目的。
相比于传统给药方式,纳米颗粒作为载体给药的优势在于,通过对颗粒做一定的修饰,在外力的作用下(比如磁场),可以将载药微粒富集于病变部位,所负载的药物受控释放,实现靶向治疗,从而增强治疗效果,减少对其他正常组织的影响。此外,在磁场引导下的靶向给药系统还具有磁响应性好、载药量大、不容易被网状内皮系统吞噬等优点,是肿瘤治疗中的理想给药系统,对肝、肺、胃等实体癌都有较好的治疗作用[1]。
纳米颗粒难以进入血管内皮,靶向给药受阻
随着研究和实验进一步加深,科学家发现,纳米颗粒作为药物载体,在人体内输送药物到病变组织的过程中,仍然存在阻碍。对于不同的病变组织,所碰到的阻碍类型也有所不同。
以癌症为例,癌细胞虽然是不正常的细胞,但也是细胞,生长也需要营养。为了获取营养,癌变组织内会长出新的血管来支持癌细胞的存活以及分裂生长。前面提到,纳米颗粒是行走在血管内的。当包裹着抗癌药物的纳米颗粒随着血液流达到肿瘤附近区域时,需要穿过血管内皮才能真正接触到癌细胞,从而释放药物杀死癌细胞。但是,因为癌变组织里新生的血管结构不同于普通的血管,这样不正常的结构让纳米颗粒很难通过血管内皮进入到癌变组织附近,所以,纳米颗粒所携带的药物也不能够有效地释放在癌变组织周围,这让药物浓度大大降低,治疗效果大打折扣。
对流的产生为纳米颗粒靶向给药助力
相关领域的科学家进行了一系列的研究,希望能够加强纳米颗粒穿过血管内皮的能力。其中,“对流”作为一个很重要的概念被科學家提出。对流是指流体(气体或液体)内部由于各部分温度不同而造成的相对流动,即流体通过自身各部分的宏观流动实现热量传递的过程。
在纳米颗粒作为药物载体给药领域,有理论提出,血液中对流的产生可以促进纳米颗粒穿过血管内皮,到达癌变组织。根据这个理论,许多科学家进行了相关尝试。例如,植入相关装置,再以导管的形式进行药物灌注,但是,这种导管和装置的存在对人体组织是有伤害的,并且,在产生有效的对流方面也存在很多问题。在对流可以促进纳米颗粒穿过血管内皮的理论基础上,纳米医疗技术专家、苏黎世联邦理工学院助理教授Simone Schuerle以及她的团队提出了两种无创产生对流的技术方法[2],进一步优化了纳米颗粒作为载体给药的方案。
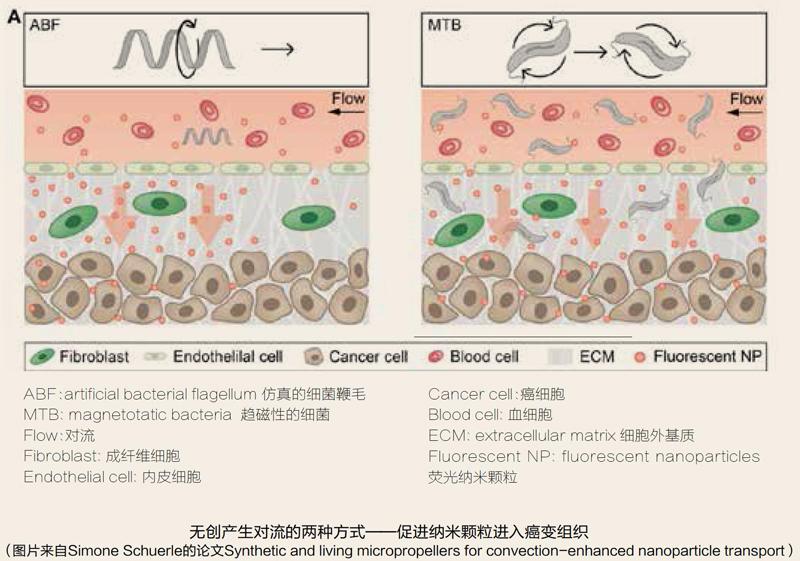
Simone Schuerle提出的第一种无创产生对流的技术受微型机器人以及细菌运动机制的启发。细菌虽小也不像动物一样有脚,但是大部分细菌是可以运动的。大部分能够运动的细菌都具有自身的运动器官——鞭毛。鞭毛外形长而细,附着于细菌的表面,一般长15~20μm,是细菌体长的数倍。通俗理解,细菌的鞭毛相当于船的螺旋浆,当细菌在水中时,鞭毛的高速旋转可以为细菌提供动力,推动菌体前行。
基于此,Simone Schuerle和她的团队合成了一种外形与细菌鞭毛类似的微型机器人。这种微型机器人可以模仿细菌依靠鞭毛运动产生推进力的方式来产生对流。当鞭毛外形的微型机器人到达纳米颗粒富集的血管区域时,在磁场的控制下发生运动,产生对流,促进携带药物的纳米颗粒穿过血管,到达癌变组织附近,释放药物杀死肿瘤细胞。
在第二种方法中,Simone Schuerle和她的团队则采用另外一种完全不同的方式来产生对流——具有趋磁性的细菌。在自然条件下,具有趋磁性的细菌一般存在于海洋中。这种细菌能够合成被脂质包裹的铁氧纳米颗粒,因此具有趋磁性。这些颗粒能够感知地磁场,其可以通俗地理解为细菌的指南针,为细菌提供方向,引导细菌在海洋中运动。利用这一特点,Simone Schuerle和她的团队将第一种方法中的微型机器人换成了大量具有趋磁性的细菌,通过体外磁场的控制,让这些细菌发生一定的运动,从而产生对流。这提高了载有药物的纳米颗粒通过血管内皮的成功率,使更多的药物能够有效、准确地释放在癌变组织附近,使得药物对于癌细胞的杀伤力进一步加强。
微型机器人引路赋能,打造无创优势
相比于对纳米颗粒本身的改造,Simone Schuerle和她的团队研究出的这两种方法有着明显的优势。因为影响纳米颗粒通过血管内皮的因素通常包括纳米颗粒本身的大小、其物化性质以及颗粒表面的性质,常规改善通过率的方法往往是从这3方面入手对纳米颗粒本身进行改造,以获得更大的通过率。但是,对纳米颗粒本身进行改造也存在着一系列问题。以颗粒本身大小为例,体积越小的纳米颗粒会更容易通过血管到达癌变组织,但体积越小的纳米颗粒会更容易被肾排泄出体外,也容易被免疫细胞吞噬清除。另外,考虑到稳定性以及药物的装载量,纳米颗粒并不是越小越好。
Simone Schuerle和她的团队研究出的这两种方法并不改变原有的纳米颗粒,而是采用了仿生的鞭毛形状的微型机器人以及具有趋磁性的细菌,在磁场的作用下运动,产生对流,就像微型的螺旋桨给飞机提供源源不断的动力一样,促进携带药物的纳米颗粒通过血管壁,进入癌变组织,释放药物杀死癌细胞。此外,这两种方式属于无创远程操控,能极大地降低对人体的伤害。
科学与技术的不断发展让人类生活质量的改善成为可能。虽然目前这两种技术只是在实验室得到了验证,还未投入临床使用。但是,相信在不久的将来,经过不断改进,这两种技术可辅助纳米颗粒给药,为纳米颗粒提供源源不断的动力,使其精准到达病灶,一起成为治疗疾病强而有力的手段。
