基于RNA-Seq技术的MDCK细胞成瘤性关键基因的验证
2020-01-10王家敏柏家林
贺 丹,杨 迪,王家敏,柏家林*
(1.西北民族大学生物医学研究中心 甘肃省动物细胞技术创新中心,甘肃 兰州 730030 2.西北民族大学实验教学部,甘肃 兰州 730030 3.西北民族大学生命科学与工程学院,甘肃 兰州 730030)
MDCK细胞(Madin-Daby Canine Kidney Cells,MDCK)由Madin和Darby于1958年从美国Cocker Spaniel母曲架犬肾脏组织分离培育建立[1],由于其病毒感染效率高、增殖快,且不易变异,是公认的适于流感病毒复制的3种细胞系之一。目前,MDCK细胞被用于分离流感病毒,分离菌株的抗原性和基因特征相对稳定,更接近原始标本[2]。流感(Influenza),是由甲(A) 、乙(B) 、丙(C) 三型流感病毒分别引起的急性呼吸道传染病,常造成不同程度的流行,包括世界大流行、局部暴发流行及散发。其中,甲型流感病毒由于其抗原性而易于突变,具有高度传染性,容易导致人畜死亡[3-4]。目前,国际上已有企业已批准利用MDCK细胞生产流感疫苗。
2005年11月16日疫苗和相关生物制品顾问委员会(VRBPAC)组织召开的会议讨论了MDCK细胞作为细胞基质用于流感疫苗生产的相关事宜,并且着重讨论了MDCK细胞的成瘤性问题。会议期间诺华公司、荷兰苏威制药公司、美国医学免疫学公司分别做了MDCK细胞的研究报告[5]。诺华公司的研究报告显示无血清悬浮培养型MDCK细胞的成瘤性非常强,10个细胞就可以对裸鼠成瘤,但是对该公司通过驯化获得的MDCK细胞株33016-PF的研究显示该细胞株对裸鼠不成瘤。荷兰苏威制药公司的研究报告显示MDCK细胞(CCL-34)母细胞(P56)接种的细胞量高于107细胞对裸鼠成瘤,建立的细胞库细胞传代至P98代时接种105细胞量就对裸鼠形成肿瘤。美国医学免疫学公司生产流感疫苗使用的细胞是该公司自主研发获得的无成瘤性MDCK贴壁细胞株,接种107细胞量对裸鼠不成瘤。
目前,获得无成瘤性MDCK细胞株仍是各国科研人员研究的重点。本研究使用单克隆技术建立了弱成瘤MDCK-CL35、较弱成瘤MDCK-CL09细胞株。运用RNA-Seq技术获得高成瘤性和单克隆细胞株低成瘤性MDCK细胞差异表达的基因(DEGs),发现了降低单克隆细胞致肿瘤性的潜在分子机制,为建立MDCK低成瘤的细胞系奠定基础。本研究通过对三株细胞(高成瘤MDCK-W73、弱成瘤MDCK-C35、较弱成瘤MDCK-C09)转录组测序结果分析可知,FLT4、GALNT12、SQSTM1、FOXN2、TNFAIP8、ELP1、STOM、RBMS2、RBMS2、SHB、GCAT、AFF4和GOPC可能是导致MDCK成瘤性的关键基因,对差异基因进行验证。
1 材料和方法
1.1 总RNA抽提
收取MDCK-W73、MDCK-CL35以及MDCKCL09细胞(6孔板80%细胞密度),放在新的无RNase 的1.5 ml离心管中,加入500μl Trizol,置于冰上5 min,使细胞充分裂解。4℃ 12 000 g,离心5 min,去除沉淀;每管加入200μl氯仿,振荡混匀,冰上静置15min。4℃12 000 g,离心15min,小心吸取200 μl上清,加入到新的预冷的无RNase的1.5 ml离心管中。在新的1.5ml离心管中加入等体积预冷的异丙醇,振荡混匀后冰上放置10 min;4℃ 12 000 g,离心10 min,弃上清,保留沉淀。加入500 μl 75 %乙醇(用DEPC水新鲜配制),将沉淀轻轻重悬;4℃ 8 000g,离心5 min,去除大部分上清液,保留沉淀;室温放置5 min,使残留液体挥发。待RNA沉淀基本透明时,加入无DNase/RNase ddH2O(加入体积视RNA沉淀量而定)至完全溶解,-80℃保存备用[6]。使用NanoDrop2000分析测定所抽提RNA浓度纯度,使用琼脂糖凝胶电泳测定抽提RNA的完整性。
1.2 反转录获得cDNA
根据promega reverse transcription system 操作说明,反应温度及程序设置:70℃反应5 min,冰上放置5 min。
如表1混合上述物质,按表2反应体系(冰上进行),混匀,短暂离心;反应温度及程序设置:25℃反应5 min,42℃水浴反应1 h,70℃水浴15 min(使RT酶失活),将得到的RT产物 -cDNA置于-20℃保存。
1.3 实时荧光定量反转录聚合酶链反应(qRTPCR)检测成瘤相关基因表达
收取细胞,提取RNA,反转录后,使用实时荧光PCR仪进行检测。按照All-in-one SYBR Green 实时荧光定量PCR试剂盒操作说明书对表3中的反应体系进行配置,利用内参基因β-actin进行不同基因(引物序列见表4)相对表达量的分析。反应程序为:95℃预变性30 s,94℃变性10 s,60℃退火10 s,72℃延伸15 s,共四十个循环。

表1 试剂及反应体系
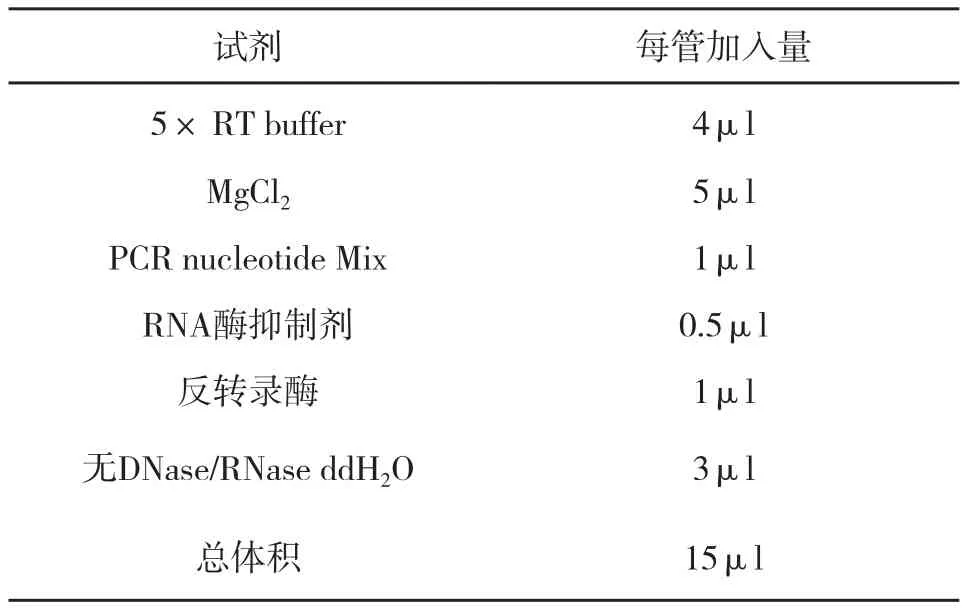
表2 试剂及反应体系
1.4 数据分析
使用相对定量分析F=2-ΔΔCt进行数据分析。
ΔCt=目的基因Ct值-内参基因Ct值;
-ΔΔCt=NC组ΔCt平均值-各样品ΔCt值;
2-ΔΔCt反映各样品相对NC组样品目的基因的相对表达水平。
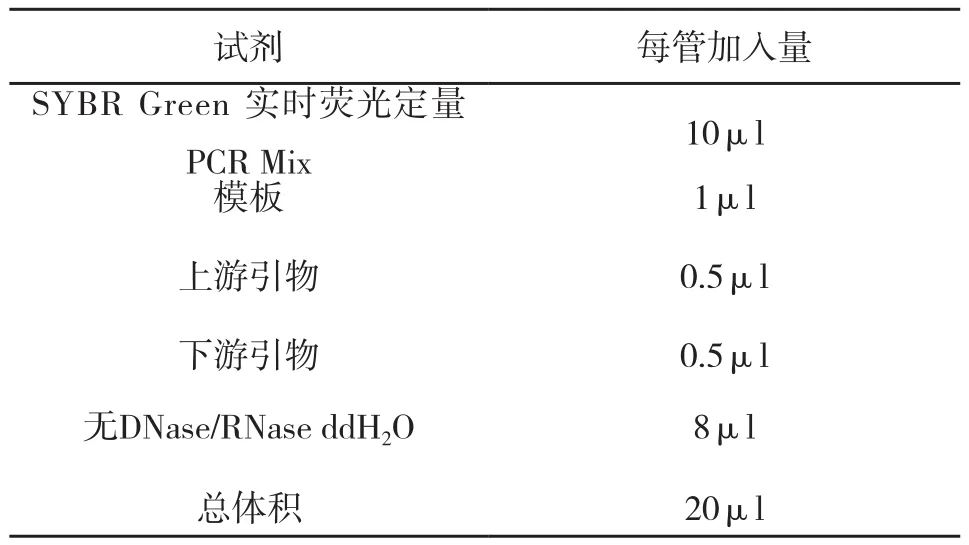
表3 反应体系
2 结果
2.1 总RNA提取与质检结果
使用NanoDrop2000分析测定所抽提RNA浓度纯度,使用琼脂糖凝胶电泳测定抽提RNA的完整性。如表5所示,所有样本的OD260/280均分布于2.01~2.08之间,OD260/230均分布于2.05-2.13之间。OD260/280比值分布于1.8~2.1之间,OD260/230≥1.5提示提取的RNA纯度高。
对各组样本的RNA进行琼脂糖凝胶电泳(图1),结果显示有18 s和28 s两条条带,RNA条带清晰,无色素、蛋白、糖类等杂质污染。结果表示试验中提取的RNA纯度高,没有发生降解;无蛋白质、DNA等其他残留,样品质量合格可以运用到后续的实验。
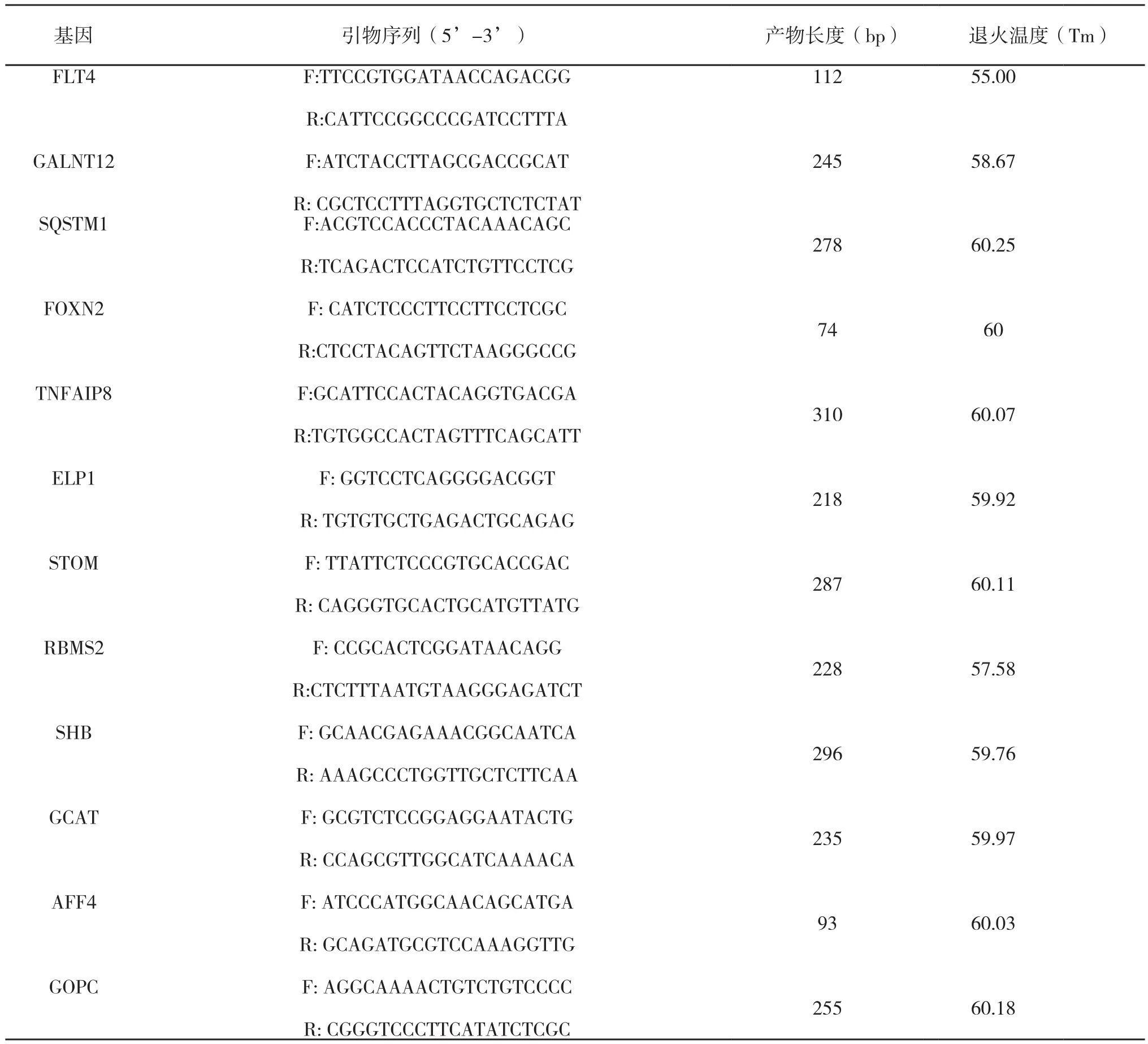
表4 引物序列信息
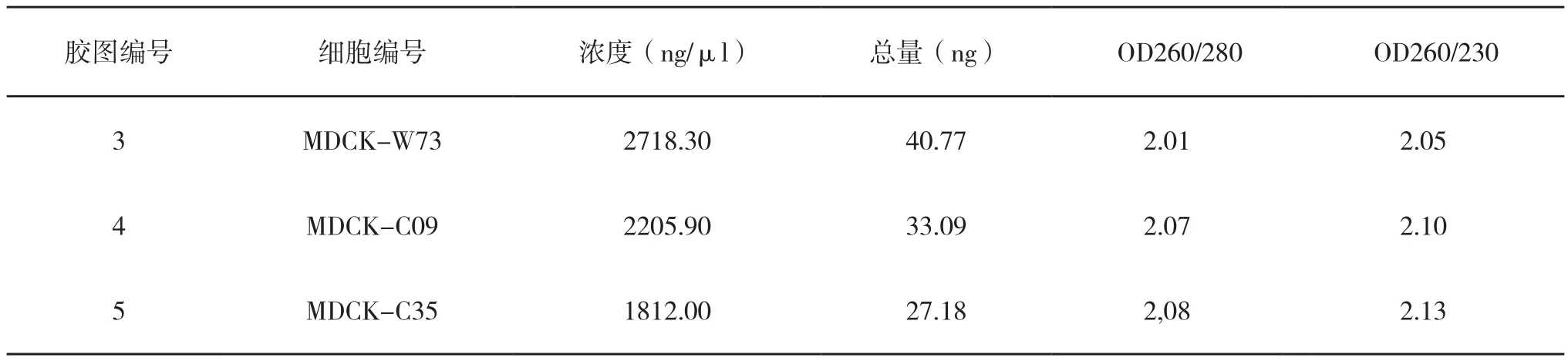
表5 RNA纯度检测结果

图1 琼脂糖凝胶电泳测定抽提RNA的完整性
2.2 qRT-PCR检测基因表达
在 MDCK-W73、MDCK=C09和MDCK-C35中,各基因的相对表达量如图2所示。试验结果显示,GALNT12、SQSTM1、ELP1、TNFAIP8和STOM 在各组细胞中均极显著表达(P≤0.01)。FLT4、FOXN2、GCAT、AFF4、SHB、GOPC 和RBMS2在各组细胞中均显著表达(P≤0.05)。
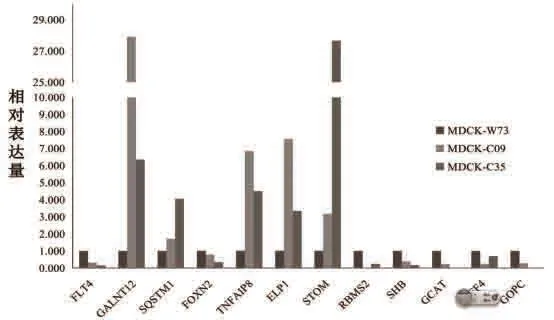
图2 MDCK细胞成瘤性相关基因的RT-PCR结果
2.3 qRT-PCR与高通量测序(RNA-Seq)的数据对比
将qRT-PCR的结果与细胞高通量测序(RNA-Seq)的结果进行对比,结果如表6所示。除了RBMS2在MDCK-C09细胞中未检测到基因表达,GCAT、GOPC在MDCK-C35细胞亦未检测到基因表达,其余基因在各组细胞中均有表达,RT-qPCR与RNA-Seq结果相一致。将各个基因的相对表达量和FPKM制作成折线图可以发现(图3),各基因在不同成瘤性细胞中的表达具有差异性,且qRT-PCR与RNA-Seq的差异性表达相一致。由此说明,RNA-Seq测序结果真实可靠,为后续的试验奠定了良好的基础。
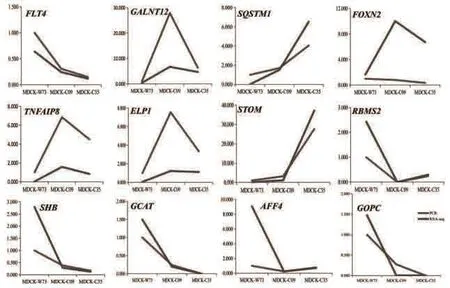
图3 各基因qRT-PCR的相对表达量和RNA-seq测序(FPKM)数据对比
3 讨论
高通量测序技术(High-throughput sequencing)又称“下一代”测序技术,以能一次并行对几十万到几百万条DNA分子进行序列测定和一般读长较短等为标志[7-8]。目前,高通量测序开始广泛应用于寻找疾病的候选基因上。在本研究的前期试验中,选择低成瘤细胞系MDCK-C09、MDCK-C35与高成瘤细胞系MDCK-W73进行高通量测序(RNA-Seq),以期筛选出与MDCK细胞成瘤性相关的关键基因进行后续研究。在高通量测序中,mRNA的表达量结果以FPKM为单位,FPKM 能消除基因长度和测序差异对计算基因表达量的影响,计算得到的基因表达量可直接用于比较不同样本间的基因表达差异。为了验证FLT4、GALNT12、SQSTM1、FOXN2、TNFAIP8、ELP1、STOM、RBMS2、RBMS2、SHB、GCAT、AFF4和 GOPC这12个关键基因是否如RNA-Seq测序中存在显著性差异,对12个基因进行了qRT-PCR测定。
实时荧光定量反转录聚合酶链反应(Realtime RT-PCR,qRT-PCR)就是结合了荧光定量技术的反转录PCR:先从 RNA 反转录得到cDNA(RT),然后再用 Real-time PCR进行定量分析(qPCR)的以微量DNA进行目的片段扩增的方法[9-10]。通过DNA链的热变性、引物退火、DNA聚合酶作用下引物的延伸三个步骤循环往复,可在短时间内扩增DNA达100万倍以上。本研究使用染料法进行qPCR检测。SYBR Green是一种非对称花菁染料,能够结合于所有双链DNA双螺旋小沟区域[11]。在游离状态下,SYBR Green只发出微弱的荧光,一旦与双链DNA结合后,荧光大大增强。因此,当将SYBR染料添加到PCR反应体系中,SYBR能结合到模板和扩增产物中发出荧光,随着每轮扩增,产物量呈指数型上升,荧光也随之上升并被仪器检测到[12]。在qPCR的反应程序设定中,通常情况下,即使模板是环状质粒或基因组DNA,预变性时使用95℃ 30 s即可,也可以依据模板情况适当延长变性时间到1~2 min。因变性时间过长可能会降低酶活性,所以不能超过2 min。如果Real Time PCR目的片段长度低于300 bp,则95℃变性3~5 s即可。对于退火温度,应先尝试常规程序。如需优化温度,在56~64℃范围内调整。如果反应效果不好,可以适当延长反应时间。

表6 MDCK细胞成瘤性相关基因的RT-PCR的相对表达量和测序数据(FPKM)
qRT-PCR 定量分析结果的可靠性与内参指标密切相关,为了筛选出在所有样本均能稳定表达的内参指标,本研究运用能综合分析的Ref Finder工具进行筛选,结果表明β-actin在所有样本中综合稳定度最高,其表达水平也与各因素无关,是理想的内参指标[13]。在整个PCR体系中,引物占有十分重要的地位。PCR的特异性要求引物与靶DNA特异结合,不与其他非目的DNA结合,PCR的灵敏性要求DNA聚合酶能对引物进行有效的延伸。
