植绒转运拭子联合显色培养基对鼻腔金黄色葡萄球菌定植的快速筛查
2020-01-10陈晓栋查定军刘家云马越云郝晓柯徐修礼
周 柯,孙 菲,陈晓栋,查定军,刘家云,马越云,郝晓柯,徐修礼
(空军军医大学西京医院 1. 检验科 全军临床检验医学研究所; 2. 耳鼻咽喉头颈外科,陕西 西安 710032)
金黄色葡萄球菌(Staphylococcusaureus,SA)为革兰阳性菌,能产生多种毒素和酶,是引起社区感染和医院感染的重要病原菌[1]。SA可长期或间断定植在部分人群的前鼻孔(鼻前庭)内,与其他微生物一起构成鼻腔共生菌群,在一定条件下可转化为机会致病菌并引起感染。当鼻腔定植的SA转移到皮肤或身体其他部位,可引起皮肤软组织、手术切口、呼吸道、骨关节、甚至血流等部位感染[2-3]。耐甲氧西林金黄色葡萄球菌(MRSA)是指含有mecA基因或者药敏试验对苯唑西林最低抑菌浓度(MIC)≥4 μg/mL的菌株,MRSA所致感染治疗困难,并且在社区和医疗机构分离率有逐渐升高趋势,已引起国内外学者的关注。国外医疗机构已常规开展住院患者鼻腔MRSA的定植筛查,在我国开展患者鼻腔SA定植筛查,对于预防和控制潜在的SA相关性感染和医院感染都具有重要意义。通过对鼻前庭标本进行常规细菌培养、分离、鉴定和抗菌药物敏感性试验是鼻腔SA定植筛查的常规方法,但其耗时长、成本较高。如何快速、准确、简便地进行鼻腔SA定植筛查是目前临床研究者关注的热点。
本研究采用植绒转运拭子采集某院耳鼻喉头颈外科门诊患者鼻前庭标本,通过微生物自动化系统接种于血琼脂培养基和MRSA/SA选择性显色培养基进行培养,快速筛查鼻前庭SA定植情况,并通过质谱鉴定、耐药表型、mecA基因等方法对培养结果进行验证,为鼻腔SA定植快速筛查提供新的方法和理论依据。
1 资料与方法
1.1 研究对象 选取2018年7月—11月空军军医大学西京医院耳鼻咽喉头颈外科门诊患者,所选对象均为急、慢性耳鼻咽喉疾病患者,有下列情况之一均予以排除:(1)近期1个月内使用抗菌药物;(2)有上颌窦漏、牙源性鼻窦炎或真菌性变应性鼻窦炎;(3)有慢性呼吸系统疾病[慢性阻塞性肺疾病(COPD)、支气管扩张]、免疫功能不全、慢性肉芽肿病、糖尿病和肿瘤等病史。本研究项目通过空军军医大学西京医院伦理委员会的批准,并与受试者签署知情同意书。
1.2 材料与设备 eSwab植绒转运拭子、WASPLabTM微生物自动化系统购于意大利Copan;羊血琼脂培养基(简称血培养基)、水解酪蛋白(MH)药敏琼脂培养基购于郑州安图生物;ChromIDTMMRSA / ChromIDTMS.aureus选择性显色琼脂培养基(简称为MRSA/SA显色培养基)、Vitek-GP革兰阳性菌鉴定卡片、AST-GP67革兰阳性菌药敏卡片、VITEK 2 Compact全自动微生物鉴定药敏仪、VITEK MS微生物质谱鉴定仪、质谱靶板和基质液购于法国Biomerieux;头孢西丁药敏纸片购于英国Oxoid;Premix Taq DNA聚合酶、100 bp DNA Loading Marker购于大连宝生物工程有限公司;Sub-Cell Systems水平电泳系统、MJ Mini PCR 扩增仪、Gel Doc XR+化学发光凝胶成像系统购于美国BIO-RAD。质控菌株金黄色葡萄球菌ATCC 25923、29213(MSSA)、ATCC 43300(MRSA),粪肠球菌ATCC 29212购于国家微生物菌种保藏中心;VITEK MS质谱仪质控菌株大肠埃希菌ATCC 8739由仪器生产商提供。
1.3 标本采集 拆开eSwab植绒转运拭子并打开含有转运基的保存管螺旋盖,用植绒拭子蘸取转运培养基使拭子头湿润,将其依次插入患者双侧鼻前孔约3/4英寸(2 cm),分别以顺时针和逆时针缓慢旋转2~5次,应轻柔擦拭鼻黏膜组织以保证采集到黏膜上皮细胞[4]。采集完将拭子插入保存管,在拭子柄中部折断并弃去手持部分,盖好保存管螺旋盖室温下保存,24 h内送至微生物实验室进行处理。
1.4 标本培养 植绒转运拭子通过手工或WASPLab微生物自动化系统分别接种于血培养基和MRSA/SA显色培养基,35 ℃孵箱培养16 h进行自动拍摄,并通过影像工作站软件观察菌落;如培养基无SA生长,则继续培养至40 h后进行第二次拍摄,防止漏检。
1.5 MALDI-TOF MS鉴定 根据VITEK MS检测标准操作规程,用一次性1 μL接种环挑取单个菌落,均匀涂布在靶板检测点制成厚度适中的菌膜,用微量移液器吸取1 μL基质液覆盖于菌膜之上;ATCC 8739质控菌落涂布于靶板质控点;待所有菌落干燥后,靶板装载入VITEK MS鉴定仪进行鉴定。
1.6 耐药表型检测 采用自动化仪器法和纸片扩散法药敏试验进行耐药表型检测。以一次性棉拭子挑取足量菌落,加入无菌生理盐水配制成0.5标准麦氏浊度菌悬液,采用GP革兰阳性菌鉴定卡片、AST-GP67革兰阳性菌药敏卡片通过VITEK 2 Compact系统进行药敏试验;同时,将菌悬液均匀涂布于MH药敏平板,将头孢西丁(30 μg/片)药敏纸片贴于平板,35 ℃孵箱培养过夜检测耐药表型。药敏结果判读依据美国临床实验室标准化协会(CLSI)抗菌药物敏感性试验2018年M-100-28th标准:苯唑西林MIC≥4 μg/mL或头孢西丁纸片抑菌圈直径≤21 mm时判断为MRSA,苯唑西林MIC≤2 μg/mL或头孢西丁纸片抑菌圈直径≥22 mm为MSSA。
1.7mecA 基因PCR检测 选取血培养基上生长良好的待测菌株5~8个纯菌落,以0.5 mL无菌水制备成菌悬液,95 ℃煮沸15 min,1 200 r/min离心10 min取上清为细菌基因组DNA模板。参考相关文献[5]设计引物:mecA上游引物5’-TGGCTATCGTGTCACAATCG-3’,下游引物5’-CTGGAACTTGTTGAGCAGAG-3’,扩增片段长度310 bp。PCR反应体系共25 μL,包括Premix Taq酶缓冲溶液12.5 μL,上、下游引物和DNA模板各1 μL,双蒸水9.5 μL。PCR反应条件为95 ℃预变性5 min,然后以95 ℃变性1 min,退火1 min,72℃延伸1 min,循环35次,72℃延伸10 min。取PCR 产物5 μL 进行琼脂糖凝胶电泳,100 bp DNA Loading Marker作为参照,加入荧光染料染色后进行电泳,采用凝胶成像系统检测电泳产物。MSSA(mecA-)ATCC 25923,MRSA(mecA+)ATCC 43300作为对照菌株。mecA检测阴性为MSSA,mecA检测阳性为MRSA。
2 结果
2.1 鼻腔SA定植快速筛查的阳性率和报告时间 共收集200份鼻前庭标本,通过培养初筛共检出SA菌株48株,其中MSSA 23株(占47.9%),MRSA 25株(占52.1%);鼻腔SA定植率为24.0%,MRSA定植率为12.5%。SA平均报阳时间为(17.6±6.1) h(包含鉴定时间),其中45份标本均在第一次拍摄时发现,报阳时间为16 h;3份标本培养16 h未在显色培养基上发现,仅在血培养基观察到少量疑似SA菌落,经分离纯化后鉴定为SA,报告时间为41 h;其余152份标本均未分离出SA菌落,阴性报告时间为16 h,为防止漏检,延迟孵育至40 h仍未分离出SA菌落,结果与16 h相符合。
2.2 鼻腔SA筛查菌落生长情况 试验可见以下四种菌落生长情况:(1)培养16 h显色培养基SA分区分离出绿色菌落,MRSA分区无绿色菌落生长,血培养基可有β溶血SA菌落生长(图1A),则可认定分离出MSSA;(2)16 h显色培养基MRSA和SA分区均分离出绿色菌落(图1B),血培养基可有β溶血SA菌落生长,则可认定分离出MRSA;(3)16 h显色培养基MRSA和SA分区无绿色菌落生长,而血培养基有β溶血SA菌落生长,对其分纯至显色培养基延长培养至40 h进行判断;(4)16 h血培养基未分离出β溶血SA菌落,显色培养基未分离出绿色菌落,暂判断为SA培养阴性,延长培养至40 h。
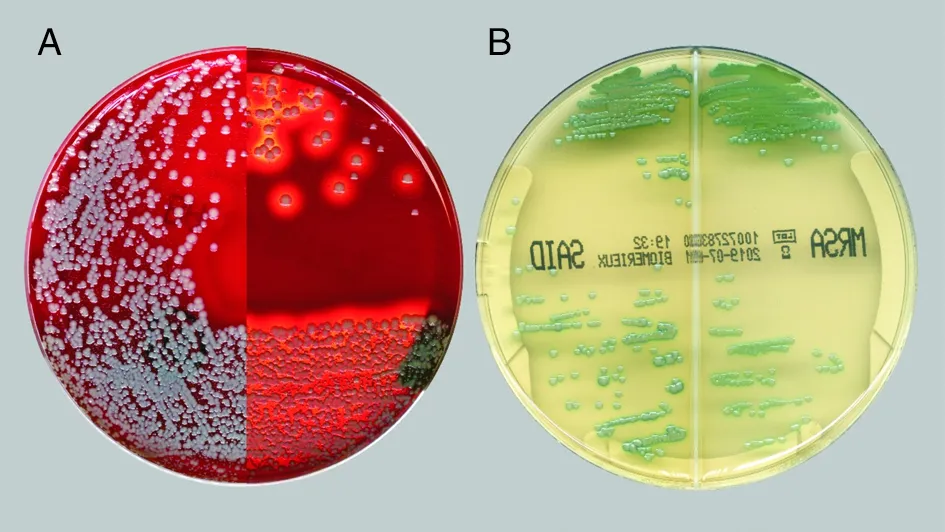
A: 鼻前庭标本接种于血培养基分离出β溶血SA菌株(左/右半图分别为白色/暗色背景色拍摄,拍摄时间16 h);B: 鼻前庭标本接种于MRSA/SA显色培养基,MRSA(右)和SA(左)分区均分离出绿色菌落(拍摄时间16 h)
图1耳鼻喉头颈外科患者鼻腔定植SA在培养基上的生长情况
Figure1Growth on culture medium for SA colonized in nasal cavity of patients in department of ORL-HNS
2.3 鼻腔SA定植快速筛查的准确性验证 48株SA菌株MALDI-TOF MS质谱鉴定结果均为SA,培养初筛和质谱鉴定的符合率为100.0%。通过自动化药敏试验和头孢西丁纸片筛选,初筛的23株MSSA苯唑西林MIC≤2 μg/mL,头孢西丁纸片抑菌圈直径≥22 mm;25株MRSA苯唑西林MIC≥4 μg/mL,头孢西丁纸片抑菌圈直径≤21 mm,培养初筛和耐药表型检测符合率为100.00%。经mecA基因检测,初筛的23株MSSA均未检出mecA基因,25株MRSA中24株检出mecA基因,有1株未检出mecA基因,初筛和mecA基因检测的符合率为97.9%。见表1。
表1耳鼻喉头颈外科患者鼻腔SA定植快速筛查的准确性验证(株)
Table1Accuracy verification of rapid screening for SA colonized in nasal cavity of patients in department of ORL-HNS(No. of isolates)
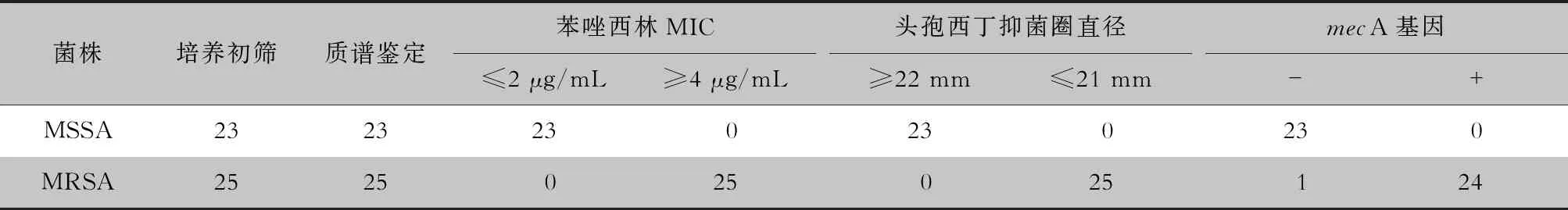
菌株培养初筛质谱鉴定苯唑西林MIC≤2 μg/mL≥4 μg/mL头孢西丁抑菌圈直径≥22 mm≤21 mmmecA基因-+MSSA2323230230230MRSA2525025025124
3 讨论
SA属于葡萄球菌属,是一类无动力、无芽孢革兰阳性球菌,可产生多种毒力因子,是对人类致病的重要病原体,大部分存在于哺乳动物鼻前庭、皮肤和黏膜中,约有50%人群长期或间断携带。定植在鼻前庭的SA与其他细菌共同构成鼻腔共生菌群,是人体正常菌群的一部分,在维持宿主正常生理功能中具有重要作用,菌群的多样性可以发挥免疫调节功能,抑制病原体入侵和增殖。当宿主免疫力低下,鼻腔共生菌群失衡,这些菌群可能成为致病菌和耐药菌的储存库,可转化为机会/条件致病菌并引起机体感染[2-3]。SA可以通过鼻前庭转移到皮肤或身体其他部位引起化脓性感染,如皮肤软组织感染、器官感染和全身性感染。MRSA所致感染治疗困难,最近在社区和医疗机构人群的分离率呈增高趋势,已成为重要的医院感染多重耐药菌。国外医疗机构已常规开展住院患者鼻腔MRSA的定植筛查和去定植干预,对于医院感染控制具有重要意义[1]。
目前,微生物检验的常规工作大部分仍然依赖于手工操作,自动化水平不高,提高微生物工作的效率,缩短时间是目前亟待实现的关键问题。微生物检验流程中,标本接种、孵育,病原菌鉴定和药敏试验任一步骤都制约着报告的时效性。随着检验技术的发展,目前有少数微生物实验室引进全自动微生物系统,实现了实验室自动化,该系统可实现自动化标本接种、培养基孵育、拍照、菌落观察、标记和后续处理,具有生物安全性较高、标本接种和处理速度较快、分离质量优等优势,有望提高检出率并缩短标本周转时间[6-7]。本院微生物实验室于2012年引进意大利Copan WASPLab微生物自动化系统,该系统在微生物检验流程优化和病原体快速检测工作中发挥举足轻重的作用。
Copan eSwab植绒转运拭子,其包装内含有一支植绒拭子和一支存有液态转运培养基的塑料保存管,与WASPLab系统匹配并可由其进行自动接种。植绒拭子由尼龙纤维制成,通过静电制作工艺黏附在塑料棒上,相对于棉质或涤纶拭子,其拭子头表面积更大,可吸附更多体积标本,其释放/洗脱能力也较强,当浸入液态转运培养基内,可将吸附的标本完全释放。塑料保存管内含有1 mL液态Amies转运培养基,可高效维持需氧菌、苛养菌、厌氧菌、真菌、病毒等病原体活性,室温条件下可保存24~48 h,并不改变各种病原体的含量,可用于病原学涂片、培养和核酸检测等多重检测[8-9]。通过植绒转运拭子采集鼻前庭分泌物,可提高鼻腔定植病原菌,特别是SA的检出率。
MRSA/SA显色培养基是目前临床常用的MRSA/SA筛选培养基,市售的商品化培养基包括法国Biomerieux ChromIDTMS.aureus、ChromIDTMMRSA和ChromIDTMMRSA/ChromIDTMS.aureus,以及法国CHROMagarTMStaph aureus、CHROMagarTMMRSA显色培养基。培养基中含有选择性抑制剂,可抑制大部分非葡萄球菌和假丝酵母菌生长,在SA作用下产色底物α-葡萄糖苷酶使菌落呈现绿色,可以用来直接筛选并鉴定SA。在此基础上,MRSA筛选培养基还含有头孢西丁等多种抗菌药物,可直接筛选并鉴定MRSA[10],具有较高的敏感性和特异性。ChromIDTMMRSA/ChromIDTMS.aureus为双分区显色培养基,可同时进行MRSA/SA筛选和鉴定,联合血培养基进行菌落判读能够最大程度地排除耐甲氧西林凝固酶阴性葡萄球菌菌落的干扰。此显色培养基筛选的特异性与孵育时间呈正相关,延长孵育至48 h可避免漏检,但其他菌属如产生相似的绿色菌落则会干扰结果判读,并降低检测特异性[11]。
本研究基于微生物自动化系统,通过植绒转运拭子联合显色培养基进行鼻腔SA定植的初步筛查,并通过细菌鉴定、耐药表型和mecA基因检测等进行结果确证。200例患者鼻前庭标本初步筛查出48株SA菌株,质谱鉴定与显色培养基初筛的符合率为100.0%,该人群鼻腔SA定植率为24.0%,MRSA定植率为12.5%,高于刘军等[12](SA 10%)、董宏亮等[13](SA 5.16%,MRSA 1.72%)报道的临床医务人员的定植率,也高于张亚莉等[14]报道的临床医务人员和患者(SA平均15.5%)的定植率,可能与研究对象、采样拭子和培养方法不同相关。耐药表型检测和初筛的符合率达100.0%,而mecA基因检测与初筛结果绝大部分符合,符合率为97.9%。mecA基因编码一种青霉素结合蛋白2a(PBP2a),其与β-内酰胺类抗生素亲和力降低,从而产生耐药性。尽管认为mecA基因介导SA对β-内酰胺类抗生素的耐药性,mecA基因可作为MRSA 鉴定的“金标准”,但多个研究发现与本研究结果相似的耐药表型和基因检测结果不一致的情况,即存在少部分不携带mecA基因的MRSA菌株,以及携带mecA基因的MSSA菌株,可能是由于存在其他耐药机制,如青霉素结合蛋白结合力改变导致β-内酰胺酶过度产生或其他未知机制等[5,15-16]。
传统的鼻腔SA定植筛查方法,需要对鼻前庭标本进行常规细菌培养,并对分离的菌株进行鉴定和药敏试验,报告时间往往需要3 d左右。本研究借助微生物自动化系统完成自动标本接种、培养基孵育、拍摄和菌落观察,对常规培养基和显色培养基生长菌落进行初筛,能够在早期快速筛查鼻腔定植的SA和其β-内酰胺类耐药性,和mecA基因检测相比准确性可以达到97.9%,并有望在16 h报告阴性筛查结果。与传统培养和耐药表型、mecA基因检测等方法相比,本方法在检测时间和成本上具有一定优势,有望用于临床鼻腔SA或MRSA定植筛查,但需考虑其与耐药基因检测存在差异的可能性。
综上所述,基于微生物自动化系统的植绒转运拭子联合显色培养基的快速检测方法,可以优化患者鼻腔SA定植快速筛查的流程并缩短报告时间,有望为SA感染防治提供新的技术手段。
