腺苷A2a受体在胃间质瘤中的表达及其临床意义
2020-01-10吴兆映樊瑞智江涛史沛聪时林森宋军
吴兆映,樊瑞智,江涛,史沛聪,时林森,宋军
作者单位:1徐州医科大学研究生学院,江苏 徐州221002;2徐州医科大学附属医院胃肠外科,江苏 徐州221002
胃肠道间质瘤(Gastrointestinal Stromal Tumors,GISTs)是消化道最常见的间叶组织源性肿瘤,c-kit或PDGFRA基因突变是其标志性特征,可以发生于消化道的任何部位,其中以胃最多见,约占50%~70%[1]。A2aR属于G蛋白偶联受体超家族,是腺苷(Adenosine,ADO)的受体之一。近年来,众多的研究发现A2aR在多种肿瘤组织中表达异常[2],ADOA2aR通路可以通过抑制自然杀伤细胞(NK)和细胞毒性T淋巴细胞(CTL)等免疫效应细胞的抗肿瘤免疫应答,使肿瘤获得免疫逃逸,从而促进肿瘤生长[3]。本研究通过对A2aR在149例胃间质瘤组织及配对的85例瘤旁正常组织中(部分标本切缘距肿瘤小于2 cm,无配对的瘤旁组织)的表达情况进行分析,进而探讨其与病人临床病理特征及预后的关系。
1 资料与方法
1.1 一般资料 收集徐州医科大学附属医院2012年1月至2017年9月收治的149例经胃镜或手术病理证实的胃间质瘤病人的临床病理资料,所有病人临床病理资料完整,术前均未行放化疗或靶向治疗。其中男71例,女78例,男女比例1∶1.1;年龄24~84岁,中位年龄62岁,核分裂象≤5/50高倍视野(HPFs)者114例,>5/50 HPFs者35例;47例出现肿瘤坏死;组织学类型:梭形细胞型87例,上皮细胞型49例,混合细胞型13例;肿瘤单发128例,多发21例;根据2008年美国国立研究院(NIH)修订的GIST危险度分级标准[4],高度风险26例,中度风险43例,低度风险45例,极低度风险35例。病人或其近亲属知情同意,本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 实验方法 本实验应用免疫组织化学SP法检测,将10%甲醛溶液固定的石蜡包埋组织标本连续4 μm切片,置于60~70℃烤箱中烘烤1 h。常规二甲苯脱蜡和梯度乙醇脱水,滴加3%过氧化氢溶液室温处理10 min,PBS冲洗3次,每次5 min,将切片置入pH=6.0的柠檬酸缓冲液加热20 min行抗原修复,冷却至室温后PBS冲洗3次,滴加5%BSA封闭液,室温下作用15 min。滴加A2aR一抗(美国Abcam公司,浓度1∶150),将PBS替代一抗作为阴性对照,4℃过夜。PBS冲洗后滴加二抗,室温处理20 min后PBS冲洗,滴加过氧化物酶标记的链霉素菌抗生物蛋白,20 min后PBS冲洗,滴加DAB显色剂,显色适当后苏木素复染30 s,水洗返蓝,梯度乙醇脱水,二甲苯透明,中性树胶封片。判读标准:随机选取5个高倍镜视野进行观察,显示A2aR定位于细胞膜和/或细胞质,采用半定量积分法,按染色强度分级为:0分(阴性),1分(弱阳性),2分(中度阳性),3分(强阳性);按阳性细胞所占百分比分级为:1分(0~25%),2分(26%~50%),3分(51%~75%),4分(76%~100%)。两者相乘,结果≤6分为低表达,>6分为高表达。
1.3 统计学方法 应用SPSS 20.0软件对数据进行统计分析,计量资料用s表示,计数资料使用例(%)描述,χ2检验,绘制生存曲线采用Kaplan-Meier法,单因素分析各变量与预后的关系采用Log-rank检验,多因素预后分析采用Cox风险回归模型,采用逐步回归法筛选变量,纳入标准是0.05,剔除标准是0.10。P<0.05为差异有统计学意义。
2 结果
2.1 A2aR在胃间质瘤组织及瘤旁正常组织中的表达 A2aR以胞质和/或胞膜出现棕黄色颗粒为阳性染色,免疫组织化学染色结果显示A2aR在胃间质瘤组织及瘤旁正常组织中均有不同程度的表达。胃间质瘤组织中高表达组51.0%(76/149),低表达组49.0%(73/149);85例配对的瘤旁正常组织中高表达组31.8%(27/85),低表达组68.2%(58/85)。间质瘤组织中A2aR的表达较瘤旁正常组织明显上调,差异有统计学意义(P=0.004)。
2.2 A2aR在胃间质瘤149例中的表达与病人临床病理特征的关系 胃间质瘤组织中A2aR的表达与肿瘤的核分裂象(P=0.002)、危险度分级(P=0.010)以及肿瘤是否坏死(P=0.013)相关,而与其他的临床病理因素无关(P>0.05)。详见表1。
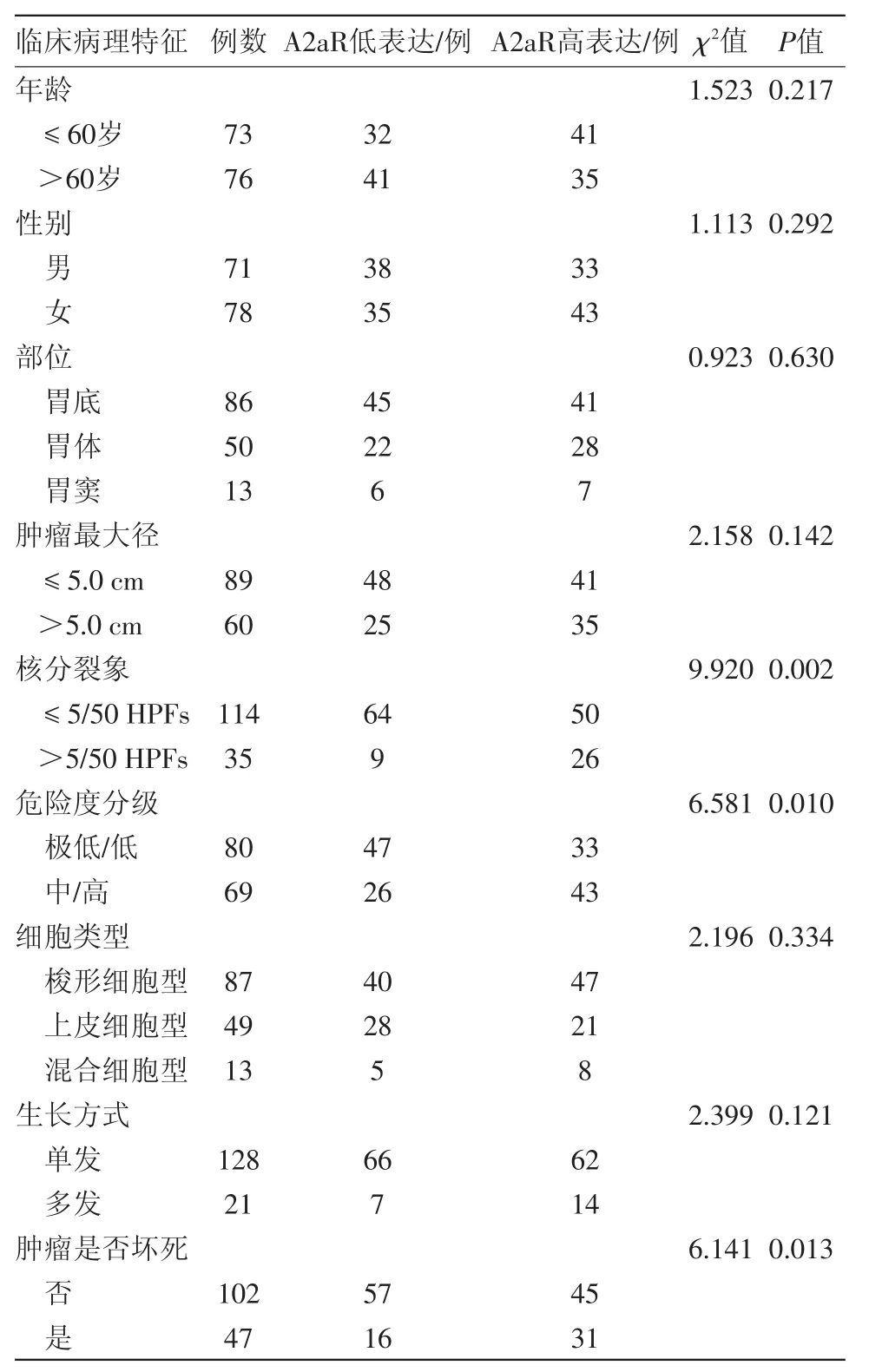
表1 胃间质瘤149例中A2aR的表达与临床病理特征的关系
2.3 胃间质瘤病人预后的单因素分析 本组病人随访资料均完整,随访时间7~76月,中位随访时间32月,共30例病人在随访期间因疾病进展而死亡。如表2所示:单因素生存分析结果表明核分裂象(P=0.046),肿瘤大小(P<0.001),危险度分级(P<0.001),肿瘤是否坏死(P=0.005)以及A2aR表达水平(P=0.002)均为影响胃间质瘤病人预后的重要因素。

表2 胃间质瘤149例影响预后的单因素分析
2.4 胃间质瘤病人预后的多因素分析 将单因素分析中具有统计学意义的因素纳入COX多因素分析中,结果显示危险度分级(P=0.001),肿瘤是否坏死(P=0.021),以及A2aR表达(P=0.039)是影响病人预后的独立危险因素,见表3。
3 讨论
目前,手术完整切除是治疗胃间质瘤的首要方法,但是术后的高复发率一直是困扰我们的难题,甲磺酸伊马替尼是一种酪氨酸激酶抑制剂,对中高危肿瘤进行术后靶向药物辅助治疗显著改善了病人的预后[5]。但是,对靶向药物的耐药已经成为一个难以解决的问题,其中10.0%~15.0%的病人是原发性耐药,而60.0%~76.6%的病人在治疗期间会产生继发性耐药[6-7]。
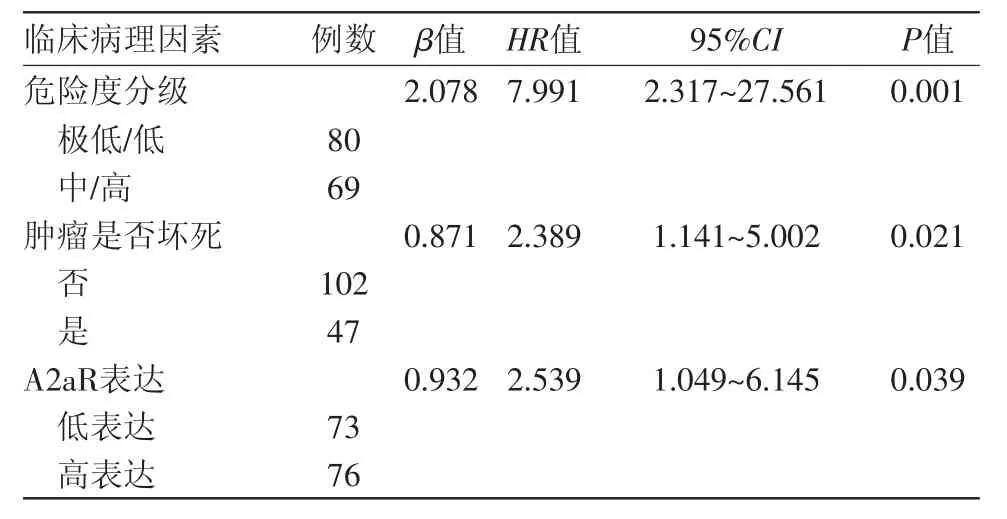
表3 胃间质瘤149例影响预后的COX多因素分析
A2aR是腺苷(Adenosine,ADO)的四个受体之一,其余三个包括A1R、A2bR和A3R,均属于G蛋白偶联受体超家族[8]。已有研究表明,A2aR在多种肿瘤中发挥作用。Mediavilla等[9]通过免疫印迹分析和免疫组织化学染色发现A2aR在非小细胞肺癌的肿瘤细胞上阳性表达,并进一步研究证实,应用A2aR拮抗剂既可以在体外下调肿瘤细胞的增殖,又可以抑制小鼠体内移植瘤的生长。Kalhan等[10]研究表明,A2aR在胰腺和肠神经内分泌肿瘤中过表达,A2aR激动剂(CGS21680)可以促进肿瘤细胞增殖,而A2aR选择性拮抗剂(SCH442416)则可削弱这种作用。Etique等[11]还发现,选择性激动剂CGS21680激活A2aR能够刺激MCF-7乳腺癌细胞的增殖。然而,腺苷及其受体是否参与了胃肠道间质瘤的起病及进展目前尚无相关研究报道。
本课题对A2aR是否与胃间质瘤的发生发展相关展开了初步研究,结果显示,A2aR主要表达于细胞的胞质和胞膜,胃间质瘤细胞中A2aR的高表达率为51.0%(76/149),高于癌旁正常组织的31.8%(27/85),差异有统计学意义(P=0.004),并且A2aR表达与肿瘤的核分裂象(P=0.002)、危险度分级(P=0.010)以及肿瘤是否坏死(P=0.013)密切相关,提示A2aR可能参与了胃间质瘤的发生发展。
既往研究表明,A2aR的配体ADO是ATP在体内的代谢产物,参与细胞内能量代谢和核酸合成等生理过程,是细胞间重要的信号转导因子[12-13]。然而,由于在肿瘤组织中的缺氧微环境下,缺氧诱导因子α(HIF-α)诱导细胞外核苷酸酶(CD39,CD73)过度表达,可以促进ATP分解为ADO,导致肿瘤微环境中ADO的显着增加[14]。ADO与A2aR结合将会激活腺苷酸环化酶(AC)从而促进cAMP的产生,cAMP作为第二信使通过细胞缝隙连接进入效应细胞,激活细胞内cAMP-蛋白激酶-A(PKA)-淋巴细胞特异性酪氨酸激酶(Lck)/肉瘤基因蛋白激酶(Src激酶)信号通路,抑制免疫效应细胞如NK细胞、CD8+T细胞、DC细胞、巨噬细胞的抗肿瘤免疫应答,从而促进肿瘤的生长[15]。Subramanian 等[16]研究发现,A2aR激动剂可以通过干预ADO-A2aR途径来下调效应T细胞、NK细胞、抗原呈递细胞和中性粒细胞的激活。在此基础上,我们猜想,在胃间质瘤的肿瘤微环境中,由于肿瘤组织坏死,造成局部缺氧状态,ADO产生增加,导致A2aR的表达在肿瘤细胞中适应性上调,ADO与A2aR进一步结合,抑制免疫效应细胞对肿瘤细胞的杀伤,从而促进肿瘤的发展。但是A2aR发挥生物学功能的具体作用机制仍需进一步的研究来证实。
影响胃间质瘤预后的因素较多,各研究得出的结论并不完全一致,目前常用的标准是2008年美国国立研究院(NIH)修订的GIST危险度分级,但是部分研究认为其并不能完全反映病人的预后情况[17-18]。一项多中心胃间质瘤诊治分析研究显示,有6.9%的极低危病人以及14.2%的低危病人术后因疾病进展而死亡[19]。Aso等[20]2013年报告了一例直径15 mm的胃间质瘤,在原发病灶手术切除后1年出现肝转移。因此,寻找能够更加准确预测病人预后的分子标志物十分重要。在本研究中,单因素预后分析显示,A2aR表达水平是影响病人预后的重要因素(P=0.002),A2aR高表达病人的预后较差,多因素预后分析进一步证实,A2aR表达是影响预后的独立危险因素(P=0.039),提示其有可能成为胃间质瘤预后的指标。
综上所述,A2aR高表达可能促进胃间质瘤的发生发展,并提示病人的不良预后,A2aR可能是预测胃间质瘤预后的一个新的标志物,并且有望成为其治疗的潜在靶点。
