代谢组学在量子点毒性研究中的应用进展及前景
2020-01-09管贵珍伊有琴赵也达瓦德吉吴添舒
管贵珍,伊有琴,赵也,达瓦德吉,吴添舒
东南大学公共卫生学院环境医学工程教育部重点实验室,江苏省生物材料与器件重点实验室,南京 210009
量子点是零维的纳米级别的半导体材料,通过控制对该材料施加的电场或光压的强度,它们会发出不同颜色的光。因其具有限制电子和电子空穴(electron hole)的特性,使电子在三维空间的运动受到限制,因此,又有“人造原子”和“超原子”之称。代谢组学是近年来飞速兴起的一门学科,主要目的是对生物的代谢小分子产物进行定性或定量的研究,由于其具有信息库简单、易于分析和反映状态精准等优势,因此,存在很高的发展价值。笔者查阅了量子点和代谢组学的相关文献,找出其中与量子点毒性研究有关的内容,重点阐述了代谢组学在量子点毒性研究中的应用进展及发展前景,为以后相关的研究方向和研究内容提供有价值的参考。
1 代谢组学方法(Methods of metabolomics)
代谢组学是一种利用分析化学来研究一个代谢组中小分子代谢相关物质及其变化规律,并对这些物质进行定性或定量的测量,将其变化反映在图谱上,通过图谱研究内外因变化对代谢的影响的科学,多用于组织、血液和尿液等的测量。相比于传统的研究个体身体形态、身体素质、单个元素或化学指标对量子点的响应等研究方法,通过图谱研究生命变化的代谢组学更加精确、更加科学。例如,在肝脏疾病的研究中,代谢组学能够不局限于机体受到外界影响后产生的变化细节,更关注机体在一系列变化后在代谢产物上的整体变化[1]。
代谢组学分为靶标代谢组学和非靶标代谢组学。靶标代谢组学即利用特定的化学物质和手段,测定样本中特定物质的变化规律,了解该特定物质在代谢过程中的详细变化。而非靶标代谢组学是全面地、详细地测量样本中所有物质的变化规律,并通过物质的变化得到样本整体代谢过程中详细的信息。目前可使用的方法具体包括气相色谱-质谱分析(gas chromatography-mass spectrometer, GC-MS)、液相色谱-质谱分析(liquid chromatography-mass spectrometry, LC-MS)和核磁共振谱学分析(nuclear magnetic resonance, NMR)等[2]。这些研究方法各有利弊,均在纳米毒理学研究中有所应用。通常研究者们倾向于联合运用2种以上的代谢组学方法,以保证最终结果的准确性。
2 代谢组学应用于量子点毒性研究的进展(Advance on the application of metabolomics in toxicity study of quantum dots)
2.1 用于量子点在生物体内吸收、分布、代谢和排泄(ADME)过程的研究
作为一种纳米材料,目前的研究表明,量子点可通过吸入、皮肤接触、经口染毒以及静脉或腹腔注射等方式进入体内。在研究中其毒性的暴露方式仍主要是注射给药[3]。职业场所的工作人员、科研工作者和临床病人等都有可能通过环境传播、工作场所暴露以及疾病诊疗给予等途径接触到量子点等纳米材料[4]。当量子点进入生物体后,通过体液流动渗透进入体液循环,再通过内循环进入组织液、淋巴等。随着体液流动,可到达或蓄积在肝脏、脾脏和肺部等器官或组织中,引起毒性作用[5]。此外,还可与血清蛋白或其他特异性蛋白结合参与血液循环;或经肾代谢随尿液或粪便排出体外,部分通过皮肤排出体外[1]。在排泄时也会对肾脏造成一定程度的损害。
而随着研究的不断深入,代谢组学亦成为量子点研究的一种新方向、新趋势,为更加准确地阐明量子点在生物体内吸收、分布、代谢和排泄过程提供了新思路。例如:Fan等[6]研究发现,CdTe/CdS655-MPA QD通过尾静脉注射暴露进入小鼠体内后,电感耦合等离子体-原子发射光谱法(ICP-AES)分析表明,有30%~40%的量子点分布在肝脏,26%~38%分布在脾脏,12%~20%分布在肾脏,7%~15%分布在肺部。李惠玲等[7]采用高效液相色谱-电感耦合等离子体质谱(SEC-HPLC-ICP-MS)监测碲化镉量子点(CdTe QDs)在体内和体外的生物稳定性,发现在染毒小鼠肝脏中CdTe QDs降解迅速,并产生Cd2+,说明量子点染毒后主要靶器官是肝脏。孙湖泊等[8]使用ICP-MS检测血浆中Cd和Te的含量,发现随着时间的延长Cd主要蓄积在肝和肾,Te主要蓄积在脾。Ma-Hock等[9]利用ICP-MS分析器官和粪便样品的镉离子含量,发现镉离子基本存在于肺部和排泄物中。
2.2 用于检测量子点毒性的特异性生物标志物
代谢组学在关于肝脏毒物、肾脏毒物方面的应用比较多见,也有涉及神经毒性和遗传毒性等的研究,其生物标志物对于研究往往有着重要的意义。例如,在肾毒性研究中,通过对尿液的检测,可以检测出部分物质的代谢在不同的情况下和其他物质都有所区别,这部分物质对于肾脏毒性的反应较为灵敏,通过研究它们之间的关系有助于相关症状的研究;关于肝脏毒物,已知部分药物容易引起肝中毒,因此面临退出市场的窘境,甚至已有药物退出市场,了解肝中毒的代谢生物标志物可以确立新的检验水准,缓解这部分药物退出市场的窘境;神经毒性的研究中,一些在传统研究中未被重视的物质可能成为某些症状的特异性标志物,进而产生重大意义。在遗传方面,可能通过DNA的损伤应答和DNA修复,导致该基因的表达被遗传毒性物质诱导,成为遗传毒性的标志物。
代谢组学应用到量子点毒性研究中,发现了许多在不同组织中对不同症状具有特异性的生物标志物。例如,吴纯启等[10]确认了新型生物标志物Micro RNA 122在检测何首乌肝毒性中的应用价值;在HK-2细胞和RPTEC/TERT1细胞模型中,KIM-1、osteopontin和clusterin等新型生物标志物的预测效能明显高于传统的细胞毒性指标和传统酶学生物标志物[11]。在病理生理研究方面,与传统的研究血液、脑脊液中单一代谢物相比,代谢组学描述了细胞、组织和器官等整体的代谢过程,这些信息可以更灵敏地反映特异性标志物。例如,Zhou等[12]用基于NMR的代谢组学技术和OPLS-DA模型,分析来自肺结核病患者和健康志愿者的血样,筛选出了乙酰乙酸、丙酮等17种潜在生物标志物。Zeng等[13]用77个血清样本进行肝细胞癌代谢组学研究,再用106个血清样本进行验证,建立了诊断肝细胞癌的“血清生物标志物模型”,该模型包括色氨酸、谷氨酸盐和羟基丁酸。
关于生物标志物在评价毒性或预测毒性方面的优异性,在确定特异性标志物时可以进行进一步研究,探寻其与毒性反应更加详细精密的关系,也可以寻找多种对应关系或者缩小研究范围。例如,血清F蛋白、苹果酸脱氢酶与等传统肝毒性生物标志物相比,这些新的标志物具有较高的灵敏度及特异性。但这些新标志物尚未得到广泛认可,还需进一步研究[14]。在肾脏毒性研究方面,通过对特异性物质的检测与调查可以进一步了解该物质与毒性反应的关系,从而制定相应措施;在神经毒性方面,不同的实验可能找到不同症状的特异性标志物;在遗传毒性方面,可以将特异性生物标志物缩小到基因范围。如cTn不仅在动物实验中可预测心脏毒性,而且在临床中可评价药物诱导的心脏毒性作用[15]。
2.3 用于量子点毒效应参与的信号通路的研究
一定量的量子点暴露可通过抑制或激活相关生物分子行为使代谢紊乱,从而引起毒性效应。吴添舒[14]的研究表明,CdTe量子点具有一定的神经细胞毒性作用。对大鼠的研究表明,CdTe量子点暴露可以通过抑制PI3K-Akt信号通路和MAPK信号通路的关键生物分子蛋白AKT和ERK1/2的磷酸化,同时直接或间接下调核蛋白c-FOS表达,损伤突触可塑性,抑制长时程增强(LTP)形成,影响大鼠的学习记忆活动。继而发现CdTe量子点暴露可以通过激活MyD88/TLR2/NFκB信号通路和NLRP3炎症小体,导致小胶质细胞分泌促炎性因子IL-ιβ增加,诱发炎症反应。关于代谢组学应用于量子点毒性研究的结果总结于表1。
3 代谢组学与传统量子点毒性研究方法的比较(Comparison between metabolomics and traditional toxicological methods for quantum dot)
3.1 传统的体外研究方法和结果
量子点体外毒性研究涉及3个方面,包括细胞、DNA和蛋白质,在量子点生物医学的研究中,通常采用多个指标的综合研究以便更为深入全面地探究真相。
CCK-8法是一种检测细胞毒性的重要手段,CCK-8试剂盒基于WST-8原理用以测定细胞存活率。袁润等[24]通过CCK-8法检测不同浓度ZnS外壳包裹的Cd/ZnS量子点对膀胱癌EJ细胞和前列腺PC-3细胞的影响,发现随着量子点浓度的升高细胞存活率随之下降。郑至嘉[25]利用CCK-8法检测出不同浓度硒化镉/硫化锌组中肝细胞活性均明显下降,下降程度和量子点浓度以及作用时间呈正相关。活性氧(ROS)是细胞在呼吸和代谢过程中产生的一系列物质。研究表明,ROS含量升高会引起氧化应激反应,进而诱导细胞凋亡。流式细胞术测定ROS含量,结果显示氧化应激水平增加明显。细胞调亡实验采用AnnexinV-FITCF/PI试剂盒检测活细胞、早期调亡、晚期调亡和死亡细胞的含量,AnnexinV作为磷脂结合蛋白,可与磷脂酰丝氨酸(phosphatidylserine, PS)发生特异结合。FITC探针与调亡细胞结合后,能够在蓝色激发光条件下,产生绿色的荧光,从而可区分出死亡细胞与活细胞[26]。马宇飞等[27]用WST、ROS活性氧和Annexin凋亡实验方法检测出小粒径石墨烯量子点生物安全性和生物相容性较好,能够迅速从体内代谢。
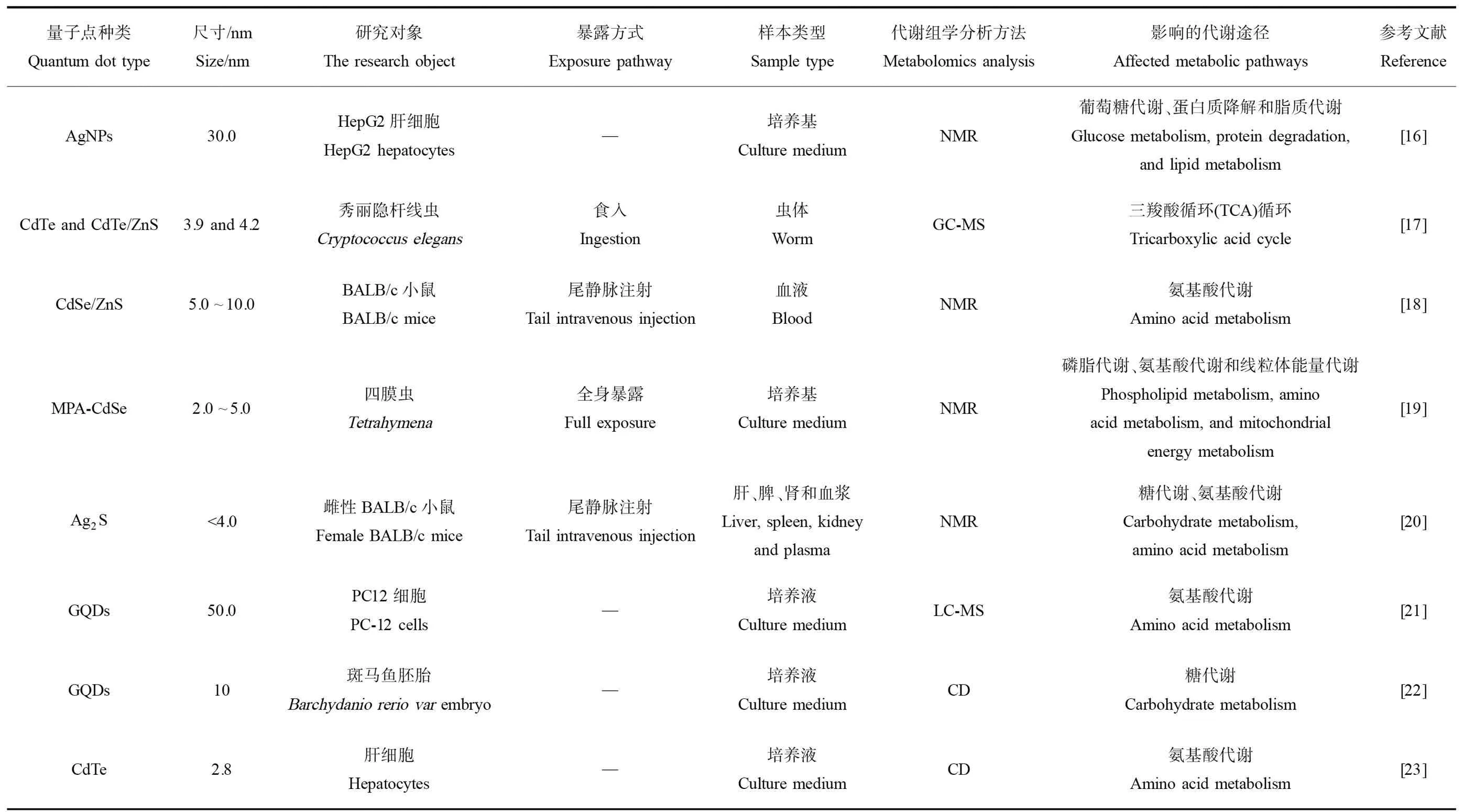
表1 量子点对机体代谢途径的影响汇总Table 1 The summary of metabolic pathways influenced by quantum dots exposure
注:MPA表示巯基丙酸,GQDs表示石墨烯量子点,NMR表示核磁共振,GC-MS表示气相色谱-质谱,LC-MS表示液相色谱-质谱,CD表示圆二色性光谱法。
Note: MPA stands for mercaptopropionic acid; GODs stands for graphene quantum dot; NMR stands for nuclear magnetic resonance; GC-MS stands for gas chromatography-mass spectrometry; LC-MS stands for liquid chromatography-mass spectrometry; CD stands for circular dichroism spectrometry.
分子水平上的检测方法有荧光吸收光谱法、紫外-可见吸收光谱法、圆二色性(CD)光谱法、等温滴定量热法、时间分辨光谱法、共振光散射技术和酶活性测定等。其中,荧光吸收光谱法具备灵敏度高和准确度好等优点,广泛应用于物质定性定量测定;紫外-可见吸收光谱法具有灵敏度高和选择性好的优点,是研究蛋白质与小分子相互作用规律的一种重要手段。在不同的实验目的和实验条件下,有针对性地选取上述方法。邓邦莲等[28]的研究中,荧光分光光度计测定出在激发光375 nm时,碳量子点荧光强度最强,并且荧光强度与其浓度正相关。Park等[29]用分子荧光成像技术提高了结肠镜检的检测限度,分子荧光探针和甲酚紫-谷氨酸衍生物对癌症具有互补诊断的作用。
3.2 传统的体内研究方法和结果
量子点体内毒性的评价及检测方法主要有血清生化指标检查、血液检查和组织器官的病理检查。血清生化指标的变化可反映量子点对肝肾功能的影响。血液中细胞数量的变化则可反映量子点在血液中与细胞的相互作用情况以及量子点引起的炎症反应。检测组织器官的病理改变可直观地评价量子点对组织器官的损伤作用。肝功能指标主要包括血清谷草转氨酶、谷丙转氨酶、碱性磷酸酶、总胆红素、直接胆红素、白蛋白和球蛋白等;肾功能指标主要有尿素氮、尿酸和肌酐等;常见的血液指标有红细胞计数、平均红细胞血红蛋白浓度、血小板数和白细胞数、淋巴细胞计数及中性粒细胞比例等[3]。邢瑞[30]研究了SiQDs对家蚕造血功能的影响,SiQDs能进入颗粒细胞、小细胞和拟绛色细胞3种循环血淋巴中的血细胞中,高剂量SiQDs组循环血细胞数量减少。SiQDs暴露会引起ROS含量变化,造成造血器官生长缓慢或生长不良。
3.3 代谢组学应用于量子点毒理学研究的优势
代谢组学的研究处于生物信息流的中游,介于基因、蛋白质与细胞、组织之间,在生物信息的传递中起到承上启下的作用。小分子的产生和代谢是基因表达的下游产物,生物体液的代谢产物分析能够更直接、更准确地反映生物体的病理生理状态。利用代谢组学手段能够获得关于生物体或细胞响应毒物或环境胁迫时受到扰动的小分子和代谢通路总体变化的有价值信息[31]。Zhao等[32]通过叶面喷洒的暴露方式,将莴苣在1 050~2 100 mg·L-1的Cu(OH)2纳米农药暴露了一个月后,通过气相飞行时间质谱(GC-TOF-MS)测定代谢物含量变化,并将数据进行PLS-DA分析后,发现nano-Cu(OH)2在莴苣叶片的代谢物水平上发生了扰动作用,包括三羧酸(TCA)循环和一些氨基酸相关的代谢途径,同时,抗氧化物含量与空白相比明显降低,表明发生了明显的氧化胁迫和抗氧化响应。
4 量子点毒性研究中的代谢组学与其他组学的联合运用(The combination of metabolomics and other omics in toxicity study of quantum dots)
4.1 组学介绍
组学即从整体角度研究人类组织细胞结构、基因、蛋白及分子间相互的作用,其涵盖了基因、蛋白、代谢、转录、RNA和脂类等多个组学内容[33]。基因组学为阐明整个基因组的结构、结构与功能之间的关系以及基因之间相互作用的科学,以生物体内基因组的全部基因为研究对象,从整体水平上探索全基因组在生命活动中的作用及其内在规律和内外环境影响机制的学科。蛋白质组学则是从整体水平上认识蛋白质的存在及活动方式的学科[34]。转录组学是在RNA水平上研究生物体中各基因转录情况及其调控规律,用以阐明生物表型与功能的一门科学。表观遗传学是对那些在不改变基因序列的前提下,所导致的基因表达水平改变的研究,即在另一维度上探究DNA和组蛋白的表观修饰对基因表达的影响[35]。代谢组学是对某一生物体组分或细胞在一特定生理时期或条件下的所有代谢产物同时进行定性和定量分析,以寻找出目标差异代谢物[33]。
4.2 代谢组学与其他组学相比的优势
与其他组学技术相比,代谢组学在量子点毒性研究中占有一定的优势。首先,小分子代谢物的数量远小于基因、转录和蛋白质的数量,因此更容易检测。焦国正[36]利用质谱分析技术研究石墨烯对HepG2细胞的影响,发现在石墨烯刺激HepG2细胞24、48和72 h后共获得了12个可以作为石墨烯干预HepG2细胞的潜在代谢标志物;其中,5个标志物(M2、M6、M7、M10和M11)强度随着石墨烯浓度的增加逐渐变低,其余7个标志物(M1、M3、M4、M5、M8、M9和M12)强度随着石墨烯浓度的增加而增强。
第二,代谢组学可以定性和定量地描述基因组、转录组和蛋白质组变异的净结果,代谢组的变化可以被认为是器官ISM表型的最佳指标。Zhu等[37]将ICP-MS和激光解析电离质谱(LDI-MS)联用,研究了量子点在Hela细胞中的含量,表征了不同种类的CdSe量子点在细胞中失去表面配体的程度。该研究采用ICP-MS测定进入细胞中的量子点总量,LDI-MS测定配体完整的量子点总量;失去表面配体的量子点总量则由二者差减得到。他们对比了5种量子点失去配体的比例,发现粒径较小的含双齿配体的量子点丢失的配体比例更少,在细胞中具有更好的稳定性。该研究表明,尺寸和配体的结构都会影响量子点的生物稳定性,这对量子点的生物成像应用具有重要的参考价值。Bo等[38]采用代谢组学的方法研究了TiO2纳米粒子的毒性,发现TiO2纳米粒子干扰了L929细胞丙氨酸、甘氨酸等12种氨基酸的代谢,这些代谢诱导氧化应激的产生,损伤了能量代谢并抑制了DNA和RNA的合成,从而对L929细胞造成了损伤。任朝秀[39]在痕量氧化石墨烯(GO)对斑马鱼神经功能障碍的诱导及其子代效应的研究中,利用代谢组学分析发现,子代斑马鱼氨基酸、脂肪酸和糖代谢被GO干扰,这一干扰与其神经功能障碍密切相关。Li等[40]采用代谢组学的方法研究了银纳米粒子对水蚤代谢应答表型的变化,发现氨基酸磷脂等相关标志物影响了代谢表型的变化,并阐述了其可能扰动的代谢通路。
第三,从代谢组学获得的信息更为通用,作为一种特定的代谢产物,不同于基因、转录物或蛋白质,对拥有它的每一个生物体来说都是相同的[41]。欧阳少虎[42]在研究3种碳纳米材料对小球藻的毒性效应及其机理时,发现代谢物中的烷烃、赖氨酸、十八碳二烯酸和缬氨酸与细胞体内活性氧产生相关,这些代谢物可能被视为活性氧新的生物标志物。因此,代谢组学为探索3种碳纳米材料对小球藻细胞的生物反应提供了一种全新的视角。Huang等[43]研究了二氧化硅对肺纤维细胞的代谢影响特征,发现硅纳米粒子主要干预了细胞氨基酸和酯类的代谢。Nazari等[44]研究了羧基包裹的铋纳米粒子对幽门螺杆菌的杀伤力,通过代谢组学的分析发现,铋纳米粒子干预了醋酸盐、谷氨酸盐、缬氨酸和尿嘧啶等代谢产物,扰动了三羧酸循环、氨基酸和核酸等的代谢通路。Li等[45]采用代谢组学的方法研究了MnO纳米粒子对SD大鼠的毒性,发现MnO扰动了大鼠的能量、脂质和氨基酸等的代谢,表明这些代谢异常打破了鼠的正常生理平衡。最后,与其他组学技术相比,代谢组学单次花费的时间和成本较低[46]。综上所述,代谢组学的特征使其成为研究不同分子水平下纳米颗粒-生物相互作用的理想选择。
4.3 量子点毒性研究中的代谢组学与其他组学的联合运用
近年来,随着新技术的不断涌现,多组学整合已经成为组学发展的新趋势,其结果更可靠,数据更丰富(图1)。传统的研究仅基于单一的数据类型来进行,因此,可以解释的生物系统和疾病的复杂性非常有限。而代谢组学与其他组学,如转录组学、基因组学和蛋白组学等联合运用,有助于解决系统级的基本生物学问题。通过转录组学分析,可以获得基因表达的RNA水平的相关信息,可以探索基因表达与机体生理、病理等状态下的生命现象之间的内在联系。蛋白组学分析可以从整体角度分析细胞和组织内部不断动态变化的蛋白质组成成分及表达水平等,了解蛋白质之间的相互作用,旨在阐明全部蛋白质的表达及功能模式。而代谢组学是转录组学和蛋白质组学的下游,代谢组分的变化是机体对遗传、环境或是疾病影响的最终应答反应。生物学反应往往不是单一因素引起的,而是基因、mRNAs、蛋白质和代谢物等多种因素共同作用的结果。因此,整合不同平台的组学数据成为必要的工作。
曾卓颖[47]运用蛋白质组学、代谢组学等分析方法探讨纳米二氧化硅染毒对HaCaT细胞膜蛋白表达水平的影响,首先使用膜蛋白提取试剂盒提取HaCaT细胞的膜蛋白,后采用纳升液相色谱-基质辅助激光解析飞行时间质谱联用技术(nano-LC-MALDI-TOF-MS)鉴定HaCaT细胞膜蛋白,确定该方法测定膜蛋白的有效性。随后,用不同浓度的15 nm的二氧化硅对HaCaT细胞进行染毒处理,观察细胞活力水平和细胞形态,确定蛋白质组学实验的染毒浓度。使用膜蛋白提取试剂盒提取染毒组和对照组的膜蛋白,用荧光差异双向凝胶电泳(2D-DIGE)分析纳米二氧化硅暴露前后膜蛋白质组成的变化情况。最后,运用生物信息学分析鉴定差异表达的膜蛋白的亚细胞定位和蛋白功能。该研究发展了一种有效可行的提取HaCaT细胞膜蛋白的方法,可用于膜蛋白质组学研究;使用荧光差异双向凝胶电泳(2D-DIGE)-基质辅助激光解析飞行时间质谱分析(MALDI-TOF-MS)联用技术成功地鉴定出差异表达膜蛋白。由此可以推测,基于质谱(MS)的蛋白质组学分析方法可以更好地识别出所需蛋白。
柳志刚[48]运用核磁共振、荧光定量PCR检测等技术来研究不同表面修饰的金纳米棒对A549及16HBE细胞代谢的影响。首先运用核磁共振、气相色谱-质谱技术检测相关代谢产物,然后为了验证一些关键代谢物的变化,特别是与氧化应激、生物膜转化和己糖胺途径相关的代谢通路,并使用荧光定量PCR检测了控制这些代谢反应的基因转录水平。研究结果表明,GCLC、GSS和GSR基因在金棒处理的A549细胞中出现上调,这3个基因编码谷胱甘肽(GSH)合成代谢途径中的酶,这说明,细胞为应对金纳米棒产生的氧化应激,提高了GSH这种抗氧化物质的含量。同时,CHKA基因在金纳米棒处理后出现变化,CHKA基因编码CDP-胆碱代谢通路的第一个酶——胆碱激酶。该酶催化胆碱生成磷酸胆碱,它的变化表明金纳米棒可能影响胆碱生物膜代谢。另外,控制己糖胺途径限速酶即谷氨酞胺果糖-6-磷酸转移酶的基因GFPTI在16HBE细胞中出现下调,这与金纳米棒处理后氨基己糖途径的终产物水平降低相一致包括UDP半乳糖胺、UDP葡萄糖醛酸和UDP-葡萄糖。并且,OGT基因水平的下调,也与己糖胺通路的下调一致。由此可见,代谢组学与转录组学的联合运用,可以验证关键代谢产物的变化,即利用转录组学来验证代谢组学的结果。
虽然,目前多组学整合研究已经成为一种组学发展的新趋势,但其在量子点毒性研究中的运用仍面临着较大挑战,相关研究也十分稀缺。当前的量子点毒性研究基本都是基于单一的组学或者是其他组学的联合运用,比如蛋白质组学与基因组学的联合运用。因此,如何将代谢组学与其他组学联合运用于量子点的毒性研究是未来努力探索的方向。
5 总结与展望(Conclusion and perspective)
作为量子点毒性研究中的一种新的组学技术,与传统的研究个体身体形态、身体素质、单个元素或化学指标对量子点的响应等研究方法相比,通过图谱研究生命变化的代谢组学更加精确、更加科学。代谢组学的特异性生物标志物在评价毒性或预测毒性方面所表现出的优异性,为量子点毒性研究提供了新的思路和技术,也提高了毒理学研究的准确度。但即使如此,代谢组学仍然还有许多基础工作有待完善。
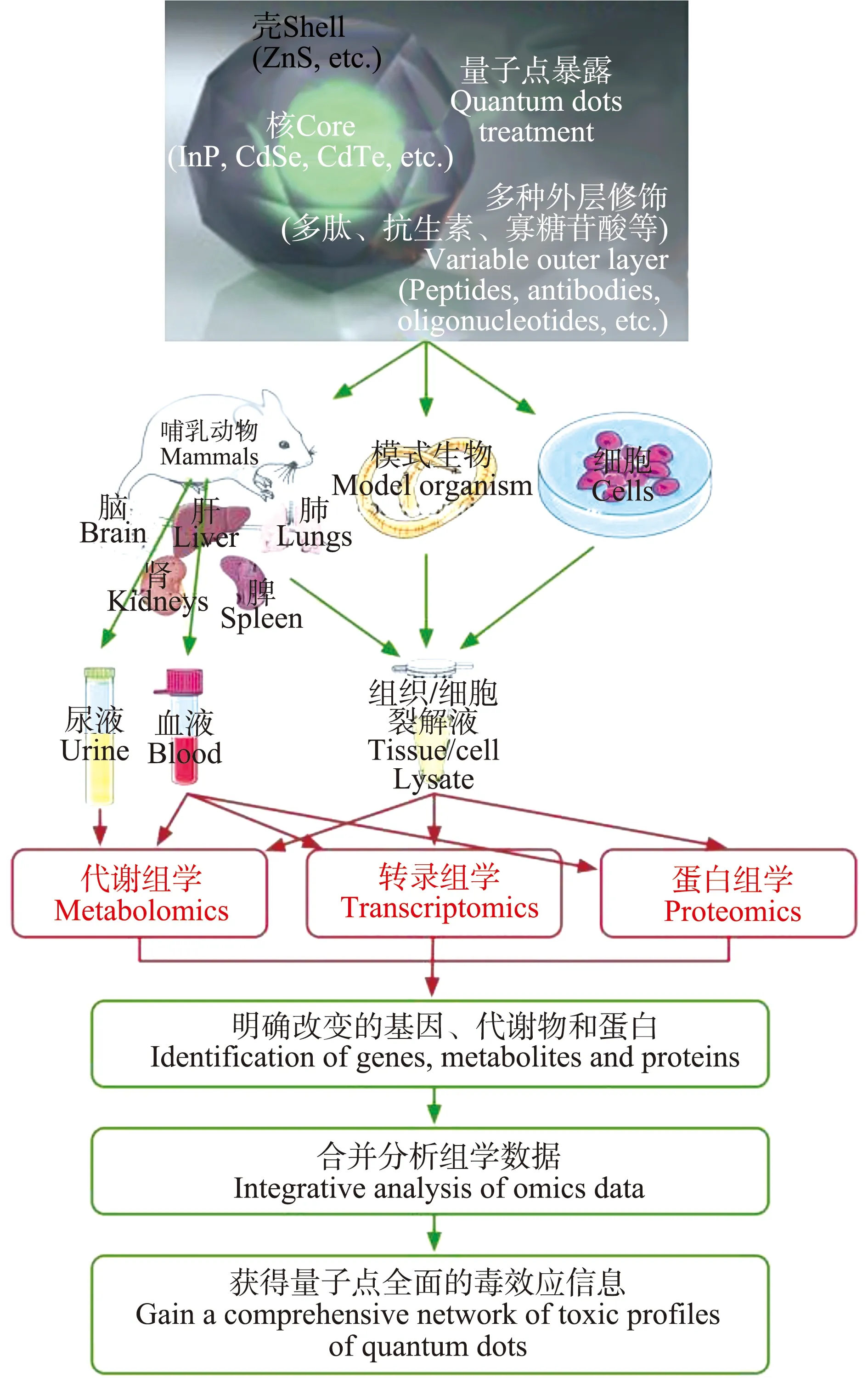
图1 多组学联合分析在量子点毒性研究中的应用Fig. 1 The application of multi-omics combination analysis on the toxicity study of quantum dots
对于量子点毒性研究,代谢组学是一个潜在的途径,用于识别各种生物体的新型解毒机制。此外,它还可以用来识别其他组学技术所忽略的代谢途径的变化。细胞中的蛋白质和mRNA水平的变化不一定转化为代谢途径的变化,在代谢不稳定的状态下不能检测到上述两者的相关变化。代谢组学可提供其他技术不可获得的信息。另外,代谢组学还可提供下游分析的目标途径。然而,尽管代谢组学作为一个独立的领域正在发展,而且已经取得了很大的进展,但仍然存在着重大的挑战。从技术上讲,代谢组学是苛刻的。这主要是由于代谢组中存在丰富的化学多样性以及快速的代谢产物周转,这也导致其重复性较差。尽管如此,代谢组学仍然具有巨大的潜力,可以为量子点毒性研究和其他领域提供新的重要信息。通过良好的实验设计、有效的分析方法和与其他组学方法的整合,代谢组学可提供更加丰富的信息。
