氨气的制备与性质实验改进
2020-01-09安徽省六安市第二中学河西校区237000
安徽省六安市第二中学河西校区(237000) 孙 瑞
安徽省铜陵市第一中学(244000) 郑 伟
“氨气的制备和性质实验”是人教版高中化学必修一第4章第4节中的内容。教材中氨气的制备与性质实验是分开进行演示实验的,结合教学实际,笔者认为教材实验存在以下几点不足:
(1)氨气制备时使用酒精灯加热,能耗大,存在安全隐患;
(2)氨气在收集的过程中容易泄露,污染环境;
(3)氨气和氯化氢反应是在敞开体系中直接进行的,反应现象微弱,且NH3与HCl都会污染环境;
(4)做喷泉实验要提前收集多瓶干燥氨气,氨气易扩散,有可能导致喷泉实验效果不好,甚至造成实验失败。基于此,需要对氨气的制备和性质实验装置进行改进,以便于学生全面系统掌握氨气的性质。
1 实验目标
为了更安全高效的进行课堂教学,使学生自主掌握NH3的制备原理和性质,发展学生的化学核心素养,特制定该实验的策略目标。
1.1 宏观辨识和微观探析
通过观察、辨识表现氨气性质的宏观现象,能从微观层面解释宏观方面的实验现象,能运用化学符号表征氨气的一系列变化。
1.2 证据推理与模型认知
收集证实氨气性质的各种证据,然后分析推理加以证实或证伪,建立观点、结论和证据之间的关系,并能解释氨气现象与性质之间的关系。
1.3 实验探究与创新意识
通过对氨气的宏观现象进行思考、讨论后能提出有探究价值的问题,并能和同学交流实验探究的成果,课下继续探究或提出改进实验的想法。
1.4 科学精神与社会责任
在实验过程中养成安全意识和严谨求实的科学态度,注重环保意识,能运用已有知识和方法探究实验过程对环境带来的影响。
2 实验原理
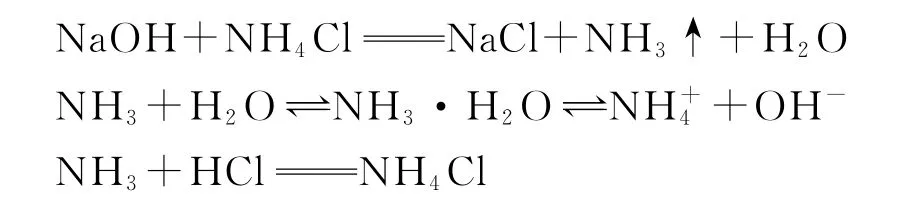
3 实验装置及用品
3.1 实验装置
实验装置图如图1所示。
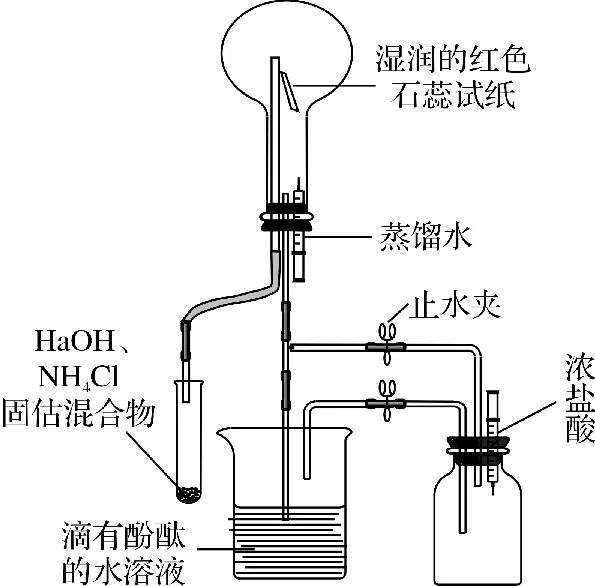
图1 实验装置
3.2 实验器材及药品
NaOH 固体、NH4Cl固体、浓盐酸、酚酞试液、蒸馏水、250 mL 圆底烧瓶、500 mL 烧杯、广口瓶、塑料滴管、玻璃导管、双孔塞、止水夹、三通阀、注射器、乳胶管、红色石蕊试纸、铁架台附铁夹、托盘天平。
4 实验步骤
4.1 氨气的制备改进
按图1组装好实验仪器 (注射器预先分别吸入一定量的蒸馏水和浓盐酸),先检査装置气密性是否良好,然后再向烧杯中加入几滴酚酞试液。最后将塑料滴管取下,分别取NaOH 细颗粒固体2g、NH4Cl固体2.3g,按顺序加入塑料滴管中。添加完毕后按图1将塑料滴管连接在装置上。轻轻摇动塑料滴管使反应物充分混合接触,很快可以观察到盛有水的烧杯中有大量气泡产生,湿润的红色石蕊试纸变成蓝色,一段时间后滴有酚酞的水溶液由无色变成红色。
4.2 白烟现象
等烧杯中气泡减少时,关闭止水夹1和止水夹2,将浓盐酸注入广口瓶中,可观察到广口瓶内产生大量白烟,瓶底或瓶壁有白色固体物质生成,如图2所示。

图2 白烟现象
4.3 喷泉实验
将注射器里的蒸馏水注入圆底烧瓶,因为NH3极易溶于水,烧瓶内压强迅速减小,可观察到烧杯中的水向圆底烧瓶中倒吸,形成红色喷泉,如图3所示。

图3 喷泉实验
4.4 装置的反复使用
实验结束,将塑料滴管从装置中取下,空气会进入烧瓶,烧瓶中的水会自动回流到烧杯中,无需拆卸仪器,可反复多次实验。
4.5 烧杯中溶液pH 的变化
随着烧杯中的水溶解氨气的增多,氨水的浓度逐渐增大,pH 值也逐渐增大,在实验设计中我们采用手持技术,利用pH 传感器可以直观展示反应过程中溶液pH 值的变化,如图4所示。

图4 溶液pH 的变化
5 实验分析
5.1 实验注意事项
(1)装置的气密性要好。
(2)把握好注入浓盐酸和蒸馏水的最佳时间。
(3)pH 传感器用前一定要校正。
5.2 学生实验探究
(1)滴有酚酞的水溶液为什么会变成红色呢?
(2)氨气遇到哪些酸可以产生白烟呢?
(3)引发喷泉现象的原理是什么?
(4)如何检验氨气?
6 改进实验的创新点
(1)节约药品,在室温下即可制取足量的氨气,无任何危险。
(2)操作时间短,适合于教师课堂演示教学和学生分组实验。
(3)操作简便,白烟现象明显持久,且可以观察到有白色固体生成;喷泉效果非常明显、几乎充满整个烧瓶,无需事先收集干燥氨气。
(4)整个实验装置构成一个封闭体系,实验中NH3和HCl无法逸出,安全环保,符合绿色化学理念。
(5)整个装置组装简易、巧妙地将多个实验融为一体,有效提升实验的观察效果,激发学生探究化学实验的兴趣,发展学生的化学核心素养。
(6)无需拆卸仪器,可反复多次实验。
