汞胁迫对齿肋赤藓生物结皮细胞超微结构的影响
2020-01-08刘卫国霍举颂黄廷温玛丽亚努尔兰张雨
刘卫国,霍举颂,黄廷温,玛丽亚·努尔兰,张雨
1. 新疆大学资源与环境科学学院,乌鲁木齐 830046 2. 绿洲生态教育部重点实验室,乌鲁木齐 830046 3. 南京农业大学资源与环境科学学院,南京 210095
重金属污染是当前危害严重及影响范围最广的环境问题之一。我国重金属污染的耕地面积近2 000万hm2,约占总耕地面积的20%[1]。土壤中的重金属会对植物叶肉细胞超微结构产生毒害效应,抑制细胞核分裂,导致细胞膜的渗透机制紊乱失调,致细胞膜破损和抗氧化酶系统损伤等[2-6]。而植物在含有重金属的土壤环境中生长,可以进化出抵御金属离子毒害能力和耐胁迫的生态型特征[7-10]。目前的研究多采用模拟控制的胁迫条件,揭示重金属对维管束植物的胁迫[1,11-13],而对非维管束植物(苔藓生物结皮)的胁迫研究报道较少。仅开展了干旱和盐胁迫对齿肋赤藓(Syntrichiacaninervis)细胞器超微结构影响的研究[14-15],而重金属胁迫对苔藓生物结皮的研究未见报道。金属汞通过煤炭燃烧、工业生产以及农药喷洒等过程扩散,常转化为可被生物吸收的脂溶性甲基汞毒性物质[16],汞毒害效应广泛存在于生态系统中[17-18]。汞对不同植物的胁迫,从生理、基因和细胞结构等方面进行了研究,目前有关汞对齿肋赤藓叶片细胞超微结构的影响分析尚需深入研究。
生物土壤结皮是细菌、真菌、藻类、地衣和苔藓等与土壤砂砾粘结的复合体,可有效改善土壤的物理、化学和生物学特性的一类复合生物体[19-20]。齿肋赤藓结皮是非维管束植物,在新疆古尔班通古特沙漠南缘广泛分布,已受到工业产生的重金属污染,威胁到齿肋赤藓等生物结皮的生存,使脆弱的生态环境面临更严峻的挑战。鉴于重金属对维管束植物的胁迫伤害效应,假设汞会对齿勒赤藓生物结皮造成影响,但其细胞生物学效应如何表达,与维管束植物的细胞响应机制是否一致,这需要利用试验进行验证。室内模拟不同汞浓度,利用扫描电子显微镜技术,观察齿肋赤藓叶肉细胞的超微结构变化,揭示齿肋赤藓生物结皮叶片在细胞学上的抗性规律,为干旱区非维管植物适应重金属环境补充理论基础,也为抗性物种的培养提供一定的借鉴,为荒漠生态系统的固沙及生物多样性保护提供参考意义。
1 材料与方法(Materials and methods)
1.1 供试材料
古尔班通古特沙漠南缘(44°11’N~46°20’N, 84°31’E~90°00’E),年均温6~10 ℃,极端高温高于40 ℃,≥10 ℃年积温可达3 000~3 500 ℃,年蒸发量超过2 000 mm,但是年平均降水量不超过150 mm,降水主要集中在早春到初夏时节,其中4—7月的降水量占全年的47.6%。南缘地表发育有良好的生物结皮,主要分布有沼地微鞘藻(Microcoleuspaludosus)、具鞘微鞘藻(Microcoleusvaginatus)和鞘丝异球藻(Xenococcuslyngbyge)等藻类结皮,还有胶衣属(Collematenex)、红鳞网衣(Psoradecipiens)和丽黄地衣(Xanthoriaelegans)等地衣结皮,以及以齿胁赤藓(Syntrichiacanivervis)为主的苔藓结皮。当地植物群落以小半乔木梭梭(Haloxylonammolondren)、白梭梭(Haloxylonpersicum)和沙拐枣(Calligonummongolicum)为优势建群种,尖喙牻牛儿苗(Erodiumoxyrrhynchum)、囊果苔草(Carexphysodes)和角果黎(Ceratocarpusarenarius)等草本植物大量分布[14,19]。由于毗邻工业园及城镇,农药施用和洗涤等活动致含汞污染物释放,重金属潜在污染的土壤面积、生物种类及数量呈增加趋势,使脆弱的生态环境面临更严峻的挑战。
2016年3月底于样地内选取未受干扰、生长一致且良好的齿肋赤藓生物结皮为对象。取回置于培养箱,在温度为(20 ± 0.5) ℃下培养以备实验。挑选高约0.6~0.8 cm的单个植株,每100株为一个样本置于培养皿中,依据当地齿肋赤藓生物结皮的生长特性及预实验结果,设定出本实验的胁迫浓度为0、10、20、30、40、50和60 mmol·L-1,每组处理3个重复,培养至7 d。每次将样本移入已消毒的培养皿,再进行汞溶液处理。观察样本的长势及变化,从每个样本中随机选取3株个体用于电镜样品的制备。
1.2 样品制备与观察
切去齿肋赤藓生物结皮的底部,保留顶部0.4 cm用于电镜样品制备。将样品投入中4%的戊二醛固定液,置于4 ℃冰箱中保存3~4 d。随后用pH 7.4的磷酸缓冲液(PBS)进行冲洗,每隔一定时间用PBS多次冲洗,总时间为2 h。之后用1%的锇酸溶液固定1.5 h,用PBS多次冲洗0.5 h后,再用浓度梯度为30%、50%、60%、70%、80%、90%、95%和100%的乙醇逐级脱水处理,每个梯度脱水处理不低于20 min。脱水处理后,依次用丙酮/乙醇(体积比为1∶1)、丙酮/乙醇(体积比为4∶1)和纯丙酮浸泡30 min。用体积比为1∶1的丙酮/环氧树脂固定1 h后,再用体积比为1∶4的丙酮/环氧树脂固定3 h,最后用纯环氧树脂固定,室内环境下保存过夜。将样品进行包埋处理,在烘箱中逐级升温至最高温度60 ℃,使环氧树脂凝固。使用LKB-8800型超薄切片机切片(瑞典LKB),用醋酸铀-柠檬酸铅进行多重染色,而后利用JEM-1200EX透射电子显微镜(日本电子JEOL)对样品扫描。
2 结果(Results)
2.1 对齿肋赤藓生物结皮活性特征影响
齿肋赤藓生物结皮经0、10、20、30、40、50和60 mmol·L-1汞溶液处理7 d。由重金属汞胁迫下齿肋赤藓生物结皮存活率可知(图1),随着浓度增加,齿肋赤藓由绿色或黄绿色变为黑褐色的死亡态。汞浓度0~20、30、40~50和60 mmol·L-1间存在显著差异(P<0.01)。汞溶液对齿肋赤藓活性产生抑制效应的浓度为20 mmol·L-1。前4天内,不同浓度处理间齿肋赤藓活性没有差异,从第4或第5天开始出现齿肋赤藓死亡现象,随时间的延续,样本的死亡率显著上升,第7天的存活率至较低水平。汞浓度为0~20 mmol·L-1时,齿肋赤藓7 d培养后存活率达到95%以上;汞浓度达到30 mmol·L-1时,齿肋赤藓于第6天出现死亡现象,7 d培养后存活率达到88%;而其他浓度的齿肋赤藓活性第5天出现死亡现象,且7 d培养后存活率均低于40%。综上可知,汞浓度是影响齿肋赤藓生物结皮活性最主要的因素,同时浓度及时间产生共同影响。
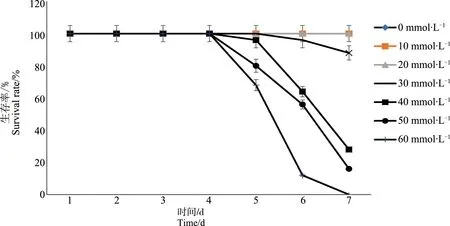
图1 重金属Hg胁迫下齿肋赤藓生物结皮存活率随时间的变化Fig. 1 The survival rate of Syntrichia caninervis under the Hg stress
2.2 对齿肋赤藓生物结皮细胞器超微结构的毒害效应
2.2.1 对齿肋赤藓生物结皮细胞壁的影响
不同浓度汞对齿肋赤藓生物结皮叶肉的细胞壁影响如图2所示。齿肋赤藓生物结皮在0~10 mmol·L-1浓度下,细胞壁结构完整,相邻细胞壁有明显的界限,细胞膜和原生质层清晰可见;汞浓度为20 mmol·L-1时,细胞壁开始发生质壁分离现象,出现一定的褶皱现象,但依然观察到完整的细胞壁及原生质体;当汞浓度达到30 mmol·L-1时,细胞壁逐渐变得模糊,出现轻微质壁分离现象,伴有一定的扭曲;汞浓度≥40 mmol·L-1时,质壁分离较明显,细胞壁两侧的液泡出现空泡化现象,细胞壁由清晰变得模糊再到颜色加深变黑。随汞浓度的持续增加,最终导致细胞壁两侧细胞质的空泡化。
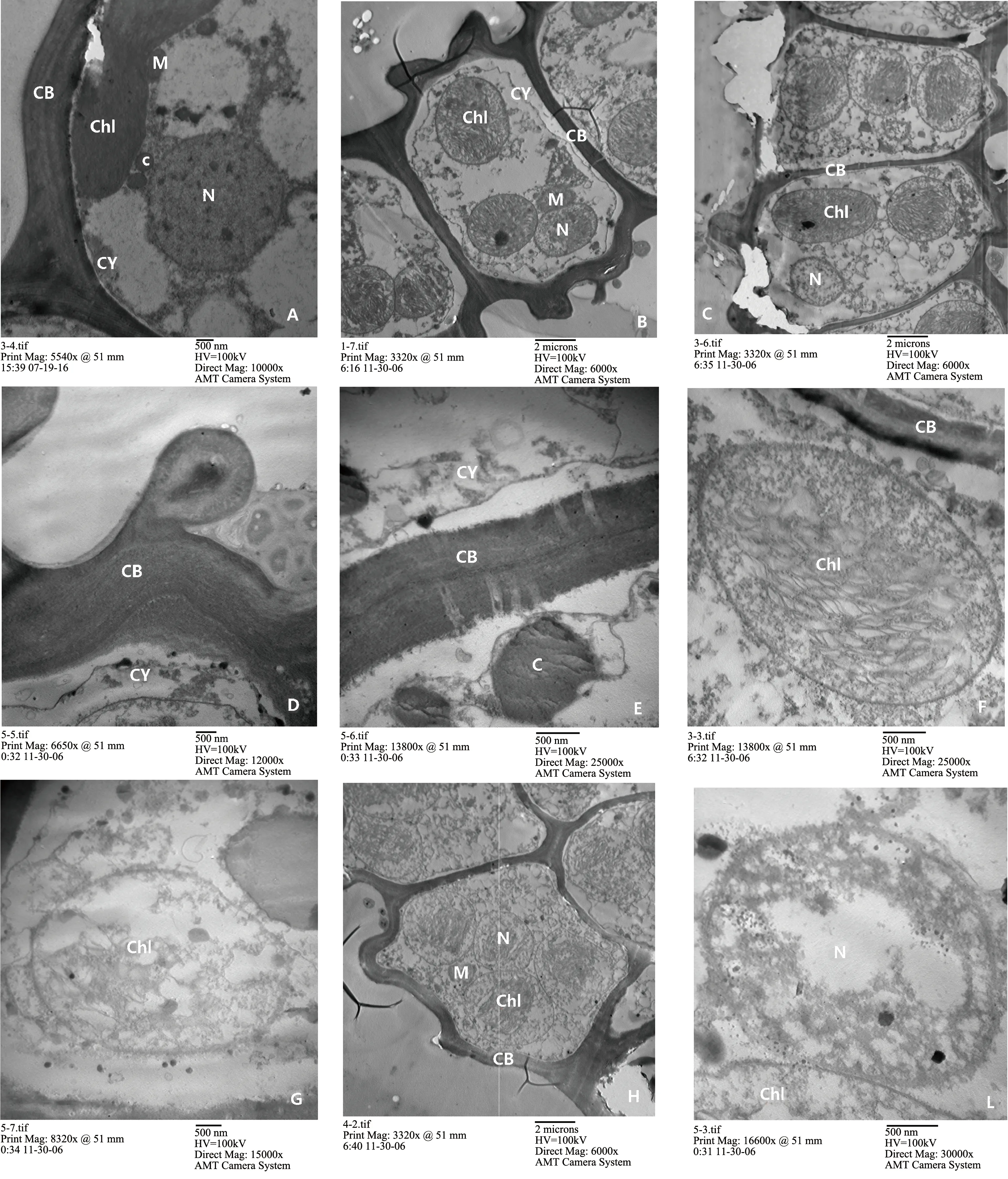
图2 不同Hg浓度下齿肋赤藓生物结皮细胞壁、叶绿体和细胞核的变化注: A. 0和10 mmol·L-1汞浓度下,细胞器超微结构正常,未发生变化;B. 20 mmol·L-1汞浓度下,细胞器出现轻微损伤;C. 30 mmol·L-1汞浓度下,细胞器已出现一定程度的毒害损伤;D. 40 mmol·L-1汞浓度下,细胞质壁分离现象加剧;E. 50和60 mmol·L-1汞浓度下,质壁分离现象明显,细胞器模糊;F. 40 mmol·L-1汞浓度下,叶绿体损伤程度加剧,空泡化现象加剧;G. 50和60 mmol·L-1汞浓度下,叶绿体空泡化严重甚至出现叶绿体解体现象;H. 40 mmol·L-1汞浓度下,细胞核损伤程度加剧,空泡化现象加剧;L. 50和60 mmol·L-1汞浓度下,细胞核严重空泡化甚至完全解体,细胞质出现外溢的现象。M表示线粒体,CB表示细胞壁,Chl表示叶绿体,c表示圆形颗粒,N表示细胞核,CY表示细胞膜。Fig. 2 Changes of the cell wall, chloroplasts and nuclei of Syntrichia caninervis at different concentrations of HgNote: Fig.A. 0 and 10 mmol·L-1 Hg, the normal physiological state of cell structures; Fig.B. 20 mmol·L-1 Hg, the slight changes of cell structures than the normal; Fig.C. 30 mmol·L-1 Hg, the observed damage of cell structures than the normal; Fig.D. 40 mmol·L-1 Hg, cytoplasmic wall separation was intensified; Fig.E. 50 and 60 mmol·L-1 Hg, cytoplasmic wall separation was more significant, and the cell structure was fuzzy; Fig. F. 40 mmol·L-1 Hg, the degree of chloroplast damage was aggravated, and the vacuolization was aggravated; Fig.G. 50 and 60 mmol·L-1 Hg, the vacuolization of chloroplast was serious and even the disintegration of chloroplasts occurred; Fig.H. 40 mmol·L-1 Hg, the degree of nuclei damage was aggravated, and the vacuolization was aggravated; Fig.L. 50 and 60 mmol·L-1 Hg, the vacuolization of the nuclei was serious or the nuclei was even completely disintegrated, resulting in cytoplasm overflow. M stands for mitochondrial; CB stands for cytoderm; Chl stands for chloroplast; c stands for round granas; N stands for the nucleus; CY stands for cell membrane.
2.2.2 对齿肋赤藓生物结皮叶绿体的影响
不同浓度汞对齿肋赤藓生物结皮叶肉细胞叶绿体的影响如图2所示。在0 mmol·L-1汞浓度下,细胞叶绿体形态清晰,呈狭长的梭状,叶绿体膜结构完整,基质均匀,类囊体片层结构有规律地排列,内部附少量的淀粉粒;在10 mmol·L-1浓度时,细胞叶绿体结构仍趋完整,未发生变化,清楚观察到完整的基粒及基质片层结构,叶绿体仅轻微肿胀;汞浓度达到20 mmol·L-1,叶绿体持续肿胀,淀粉颗粒消失,基粒与基质片层也相应减少,基质片层轻微降解及扭曲模糊,双层膜结构轻微损伤;在30 mmol·L-1浓度下,叶绿体肿胀明显,叶绿体明显空泡化,基粒与基质片层模糊,叶绿体周围细胞器解体;40 mmol·L-1浓度时,叶绿体空泡化加剧、严重肿胀,叶绿体膜出现褶皱变形及内外模糊严重;当汞浓度≥50 mmol·L-1,叶绿体空泡化严重至解体,被膜结构模糊而消失,叶绿体内物质出现外溢,类囊体、基质和基粒片层结构消失。
2.2.3 对齿肋赤藓生物结皮细胞核的影响
不同汞浓度对齿肋赤藓生物结皮叶肉细胞核的影响如图2所示。在0 mmol·L-1汞浓度下,可清晰观察到细胞核结构及核膜;10 mmol·L-1汞浓度下,细胞核整体仅微小变化,仍为完整的细胞核;当汞浓度为20 mmol·L-1时,细胞核萎缩,核膜开始出现模糊现象;30 mmol·L-1浓度时,细胞核严重模糊,有一定解体现象出现;40 mmol·L-1浓度下,细胞内各细胞器呈模糊化,大部分细胞器出现空泡化;当汞浓度≥50 mmol·L-1时,细胞核严重空泡化甚至完全解体,细胞质出现外溢现象。
3 讨论(Discussion)
植物长期生长在重金属环境中,重金属离子进入细胞,影响细胞组织代谢活动的多个细胞器,干扰细胞正常的物质合成,造成直接的毒害效应[21]。实验结果表明,受20 mmol·L-1汞胁迫时,齿肋赤藓生物结皮的叶肉细胞器清晰可见,结构完整,未见明显损伤,表明齿肋赤藓生物结皮有弱耐汞性。随着汞浓度和胁迫时间的增加,齿肋赤藓生物结皮细胞器受破坏程度增加,这与维管束植物叶片受重金属毒害效应的结果相似,且与非维管束植物受其他胁迫(干旱和盐)时叶肉细胞器的变化相似。
齿肋赤藓生物结皮叶肉细胞器是与外界物质交换、运输的重要组织,外界胁迫会导致细胞器(细胞壁、叶绿体和细胞核)损伤。细胞壁是重金属离子进入细胞内的第一道屏障,能够沉淀、抵御重金属离子进入细胞或富集在细胞壁外部,直接削弱重金属影响细胞的代谢活动[22-23]。进入叶肉细胞内的重金属离子,对光合作用场所——叶绿体产生影响,类囊体可维系膜电荷稳定,传递光能和维持光合系统正常功能。受毒害的类囊体会降低及扰乱植物对光量子的吸收传递和转化,削弱光合作用[24]。嗜锇颗粒是评价植物叶肉细胞受损害的指标之一,叶绿体内嗜锇颗粒的增多,表征细胞合成较多的脂类物质,对膜结构完整性及正常代谢活动起到保护作用[25],这也是对胁迫响应的反馈。将齿肋赤藓生物结皮叶肉细胞超微结构变化和存活率的结果综合分析,发现齿肋赤藓生物结皮叶肉细胞在低浓度(≤20 mmol·L-1)时未受伤害,可能是齿肋赤藓生物结皮有较厚的细胞壁,将重金属部分离子阻隔在细胞壁外,或富集在细胞壁上,降低重金属离子进入细胞质的量,减弱细胞器的损伤。随着浓度增加,细胞壁被损坏,失去保护作用,叶绿体明显肿胀,空泡化严重,叶绿体膜出现褶皱变形,基粒与基质片层模糊,嗜锇颗粒增多变大,细胞核解体及核仁消失,最终整个细胞器完全破损。这与前人对植物叶肉细胞器超微结构的观测是一致的[6,26]。
在低汞浓度(≤20 mmol·L-1)下,齿肋赤藓生物结皮叶肉细胞无显著性变化,汞浓度为30 mmol·L-1时,叶肉细胞器逐渐受胁迫伤害,且存活率与低浓度时比较有显著性差异,可以推测20 mmol·L-1是齿肋赤藓生物结皮受汞胁迫的阈值。当汞浓度较低时,叶肉细胞器会限制重金属离子进入细胞,或将其富集在细胞壁外,这与Gao等[6]得出的细胞壁的阻隔作用可维护细胞器结构的完整性的结论一致。倪才英[26]发现铜胁迫下海州香薷(E.splendens)和紫云英(A.sinicus)的细胞壁出现裂隙模糊等损伤,这与本研究中观察到的现象相似。但是齿肋赤藓生物结皮是非维管束植物,不同类型的植物损伤机理是否一致,仍需进一步深入研究。当汞浓度≥50 mmol·L-1时,富集在细胞壁中重金属离子浓度超过阈值,致使质壁分离现象明显,叶绿体膨胀严重,膜结构完全破裂,类囊体、基粒及基质片层结构完全消失,细胞核解体及核仁消失,这与前人的研究结果一致[27-30]。这由于突破了细胞壁对重金属离子阻隔及富集的有限作用,重金属离子直接伤害叶肉细胞器,使组织代谢功能消失而致其死亡。已有研究表明,重金属抑制了叶绿素合成相关酶的活性,引起细胞过氧化,造成膜结构损伤[31-32]。本实验观察到的叶绿体内嗜锇颗粒增多,也是细胞过氧化的现象,因没有涉及细胞酶活性的考察,所以只能通过膜结构的损伤来进行对比,结果仍具有一定的相似性。另有研究表明,重金属胁迫会影响叶绿素的合成[33],降低类囊体膜上电子传递和希尔反应活性,抑制光合作用[34-35]。本实验观察到类囊体膜的损伤和随后消失,是其内部生理代谢活性转变的过程,具体机制的确定还需借助其他技术手段进一步研究。叶肉细胞内叶绿体在重金属胁迫下,由细胞边缘位置向细胞中央移动,这可能是细胞的内含物或其他细胞器受到伤害,产生形态变形或位置于细胞内发生偏移,还可能因为细胞内渗透压大小不均衡使叶绿体发生了位移[32,36-43],这还有待进一步确定。
完整的细胞器结构是维系细胞功能的保障,重金属对植物细胞超微结构的伤害不仅是破坏某个或几个细胞器,而是对细胞内膜结构及非膜结构系统的复合伤害。植物的毒害效应是诊断重金属污染的重要依据[39]。不少学者提出,重金属浓度不同对植物细胞造成的毒害效应有所差异[40],本研究结果也显示,重金属对细胞超微结构的毒害效应与离子浓度密切关联。细胞器通过减少重金属离子的跨质膜运输,降低原生质体中重金属离子浓度,维持细胞的正常生理代谢[41],当遭受高浓度重金属胁迫时,细胞质膜容纳重金属离子的功能损坏,细胞膜受损[42],膜结构和流动性改变[43]。植物通过长期的适应和演化,可进化出抵抗重金属毒害的机制,形成解毒过量的痕量元素的精细体系[44]。
齿肋赤藓生物结皮是所研究荒漠系统中重要的优势群落,本研究从叶肉细胞超微结构层面揭示了齿肋赤藓对重金属汞的细胞生物学抗性机制,确定了20 mmol·L-1的耐受性阈值;随着汞浓度和培养时间的增加,齿肋赤藓生物结皮的存活率可反映叶肉细胞器的毒害程度;不同浓度的汞对齿肋赤藓生物结皮叶肉细胞器的毒害效应、致死率具有差异性。同时,还需从生理生态等视角分析齿肋赤藓生物结皮对汞的耐受性原理和机制。
致谢:本研究受新疆大学绿洲与生态重点实验室、国家自然科学基金项目(31260112)和新疆联合基金项目(2017D01C058)资助。
