脱水红霉素对蛋白核小球藻的生态毒性效应研究
2020-01-08朱津辉郑泽欣李吉平张政李威
朱津辉,郑泽欣,李吉平,张政,李威
南京林业大学南方现代林业协同创新中心,生物与环境学院,南京 210037
近年来,抗生素的环境暴露、迁移转化及生态风险引起了人们的广泛关注[1-4]。我国是抗生素的生产和使用大国。2013年,我国抗生素的总使用量为16.2万t,其中大环内酯类抗生素的用量为4.2万t,占总抗生素使用量的1/4[5]。大环内酯类抗生素的大量使用导致其连续不断地进入环境中,其已在污水处理厂出水、地表水甚至于饮用水中检出[6-10]。其中,红霉素、罗红霉素和克拉霉素是最常检出的抗生素,红霉素和克拉霉素已被欧盟列为优先监测污染物[11]。
以往研究已对红霉素的生态毒性进行了较为充分的探索[12-17]。如González-Pleiter等[12]研究发现,红霉素对羊角月牙藻(Pseudokirckneriellasubcapitata)的半数抑制浓度(EC50)为(0.35 ± 0.03) mg·L-1。刘滨扬等[13]发现,0.18 mg·L-1的红霉素即可使羊角月牙藻光合作用综合性能指数下降69.7%。刘臻[14]发现,红霉素对热带爪蟾的14 d的半数致死浓度(LC50)为253 mg·L-1。Meinertz等[15]研究发现,硫氰酸红霉素对大型蚤的最大无作用浓度为248 μg·L-1。红霉素在酸性条件下不稳定,口服后易被胃酸破坏,生成脱水红霉素,在环境中检测到的红霉素多为脱水红霉素[18-19],如周志洪等[19]发现,脱水红霉素在珠江广州段水体中的检出频率可达到100%,其在枯水期和丰水期的平均浓度分别为213 ng·L-1和65.8 ng·L-1,具有较高的生态风险。但是,目前关于脱水红霉素的生态毒性效应尚不明确。
绿藻是水生生态系统的初级生产力,其初级生产量和种类多样性直接影响着水生生态系统的健康状况。同时,藻类对污染物的耐受性较低,比水体中的甲壳类动物以及鱼类更为敏感,往往高出几个数量级[20]。蛋白核小球藻(Chlorellapyrenoidosa)属于绿藻门,小球藻属,是游离单细胞藻,直径3~5 μm,球形或椭圆形,繁殖快,便于培养和试验,藻液分布均匀不易沉降,与污染物的接触更充分,是国内外常用的污染物毒性测试的受试生物之一[21]。
综上所述,本论文拟以脱水红霉素为研究对象,以蛋白核小球藻为受试生物,通过研究脱水红霉素对蛋白核小球藻的生长、叶绿素含量和抗氧化酶活性的影响,探讨脱水红霉素的生态毒性效应,为其生态风险评估提供依据。
1 材料与方法(Materials and methods)
1.1 实验材料
蛋白核小球藻(编号FACHB-11)购于中国科学院武汉水生生物研究所。
红霉素(C37H67NO13,分子量733.9,纯度>98.0%)购于百灵威科技有限公司。脱水红霉素(C37H65NO12,分子量715.9)的配制方法[22]为:称取1.835 g的红霉素,溶于用硫酸调节pH为3的超纯水中,12 h后用氢氧化钠调节pH至7,定容至50 mL,配制得到50 mmol·L-1的脱水红霉素母液。硼酸、柠檬酸、硫酸镁(七水)、氯化钙(二水)、磷酸氢二钾和柠檬酸铁铵购于国药集团化学试剂有限公司;四水合氯化锰、硝酸钠购于南京化学试剂股份有限公司;无水硫酸钠、乙二胺四乙酸二钠和无水碳酸钠购于西陇化工股份有限公司。五水合硫酸铜购自广州光华科技股份有限公司;钼酸钠(二水合物)购于上海麦克林生化科技有限公司。实验中用到的化学药品均为分析纯。
1.2 实验方法
1.2.1 蛋白核小球藻的预培养
在无菌条件下将藻种接种至GB11培养基中,放置于光照培养箱中培养至对数生长期,并进一步扩大培养。培养条件为:温度(25±1) ℃,光照强度3 000 lux,光暗比为12 h∶12 h。每天至少震荡3次(15 min·次-1)。预培养3代,镜检细胞正常,待藻细胞进入对数生长期进行实验。
1.2.2 脱水红霉素对蛋白核小球藻的急性毒性试验
脱水红霉素对蛋白核小球藻的急性毒性试验参照《化学品藻类生长抑制试验》(GB/T 21805—2008)[23]进行。根据预实验结果,确定正式实验中脱水红霉素浓度梯度为0、0.14、0.2、0.29、0.42、0.60和0.87 mmol·L-1。采用灭菌后的BG11培养基,在250 mL的锥形瓶中配制相应浓度的脱水红霉素溶液,加入处于对数生长期的蛋白核小球藻母液10 mL,蛋白核小球藻的初始细胞浓度约为0.8×106cells·mL-1,培养液总体积为100 mL。每个浓度设3个平行。同时由于配制脱水红霉素母液过程中会引入硫酸钠,为了了解硫酸钠盐对蛋白核小球藻的影响,根据配制脱水红霉素时加入的硫酸钠的量,设置低盐和高盐2个对照组,其硫酸钠的浓度分别为9.92和43.15 mmol·L-1,相当于0.2 mmol·L-1和0.87 mmol·L-1脱水红霉素处理组中添加的盐分,培养条件同上。实验开始后分别于24、48、72和96 h取样测定藻细胞浓度。
藻细胞浓度采用镜检和分光光度法相结合的方法进行测定,通过显微镜用血球计数板进行藻类计数,并在波长680 nm下测定藻类的吸光值,建立蛋白核小球藻细胞密度(y)和吸光度(x)之间线性关系方程为y=(15.055x+0.5417)×106,相关系数r2为0.991。
1.2.3 脱水红霉素对蛋白核小球藻的生理生化指标的影响
叶绿素a含量的测定:根据欧阳少虎[24]的测定方法并适当改进,取暴露96 h后的藻液30 mL放入50 mL离心管中,10 000 r·min-1离心15 min,弃去上清液。加入20 mL 95%无水乙醇,在涡旋混匀器上充分混匀。4 ℃冰箱中黑暗处理24 h,以充分提取蛋白核小球藻的叶绿素。24 h后,冷冻高速离心(10 000 r·min-1、4 ℃)15 min,取上清液测定其在波长665 nm和649 nm下的吸光度,代入公式(1)计算叶绿素a的浓度。
全国职业院校导游技能大赛已经连续举办了8年,赛项的设置越来越科学合理,真正地展示了职业院校学生的导游职业技能和综合素养。通过对参赛方案的解读和对第三届全国导游大赛视频的研读,总结出了几点现场导游词的创作技巧。
Ca=(13.7OD665-5.76OD649)/4
(1)
提取粗酶液:取暴露96 h后的藻液30 mL放入50 mL离心管中,4 ℃、6 000 r·min-1下离心20 min,弃去上清液,加入预冷的0.1 mol·L-1pH为7.0~7.4的磷酸盐缓冲液20 mL,在超声细胞破碎仪中破碎细胞30 min。破碎完成转移至干净离心管,在4 ℃、6 000 r·min-1条件下离心20 min,取上清液用于测量酶活性。
蛋白质含量、超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性和丙二醛(MDA)含量按照南京建成生物工程公司试剂盒说明书测定。
1.3 脱水红霉素浓度的测定
暴露96 h后,取10 mL藻液,6 000 r·min-1离心20 min后,取上清液测定脱水红霉素的剩余浓度。脱水红霉素的剩余浓度采用高效液相色谱-质谱联用仪(HPLC-LTQ-orbitrap XL MS,赛默飞,德国)来测定。液相条件为:色谱柱Agilent Poroshell 120 EC-C18柱(100 mm×2.1 mm, 2.7 μm);流动相A为体积比为1∶1的甲醇/乙腈溶液,流动相B为10 mmol·L-1的乙酸铵溶液(加入0.05%的乙酸),梯度洗脱程序为0 min时45% A,14 min时80% A,17 min时80% A,17.2 min时45% A,20 min时45% A,流速0.2 mL·min-1,进样量5 μL。质谱条件为:电喷雾离子源,正离子模式,一级和二级模式扫描。离子源温度350 ℃,毛细管温度325 ℃,鞘气流速40 arb,辅助气流速10 arb,喷雾电压3.5 kV,毛细管电压9 V,透镜电压100 V。一级全扫质量扫描范围为m/z100~1 000,分辨率30 000;二级质谱采用数据依赖性扫描,在一级扫描基础上选取其前三强进行诱导碰撞解离(CID)获取其二级质谱数据。根据脱水红霉素母离子(m/z=716.4569)和子离子(m/z=558.3651)对来定性和定量。
1.4 数据统计与分析
采用SPSS19.0和Origin2018对实验数据进行统计分析及作图。运用概率单位回归分析法,计算蛋白核小球藻的24、48、72和96 h的比生长率半数抑制浓度(ErC50)和生长量半数抑制率(EyC50)。采用单因素方差分析法(one-way ANOVA)的Levene检验,对数据进行方差齐性假设检验,以0.05为显著性水平的临界值。数据满足齐性要求采用LSD检验,数据不满足齐性要求则采用Dunnett’s T3检验组间的差异显著性。
2 结果(Results)
2.1 脱水红霉素对蛋白核小球藻生长的影响
硫酸盐组(Na2SO4)和不同浓度的脱水红霉素对蛋白核小球藻的生长量和比生长率的抑制率如图1所示。由图1可知,硫酸盐组对蛋白核小球藻的生长无明显影响,低盐组和高盐组在不同的暴露条件下都未表现出显著性差异。脱水红霉素对蛋白核小球藻生长量和比生长率的抑制率随脱水红霉素浓度的增加和暴露时间的延长而增加,表现出明显的时间-效应关系和剂量-效应关系。如0.14 mmol·L-1的脱水红霉素处理48 h和96 h后,蛋白核小球藻的生长量抑制率分别为15.0%和51.3%;0.60 mmol·L-1的脱水红霉素处理48 h和96 h后,蛋白核小球藻的生长量抑制率分别为70.1%和88.8%。脱水红霉素处理组与硫酸盐组相比,除了0.14 mmol·L-1处理组暴露24 h外,其他都具有显著性差异。不同浓度的脱水红霉素处理组,除了部分相邻浓度组别不具有显著性差异,大部分处理组都具有显著性差异(图1)。
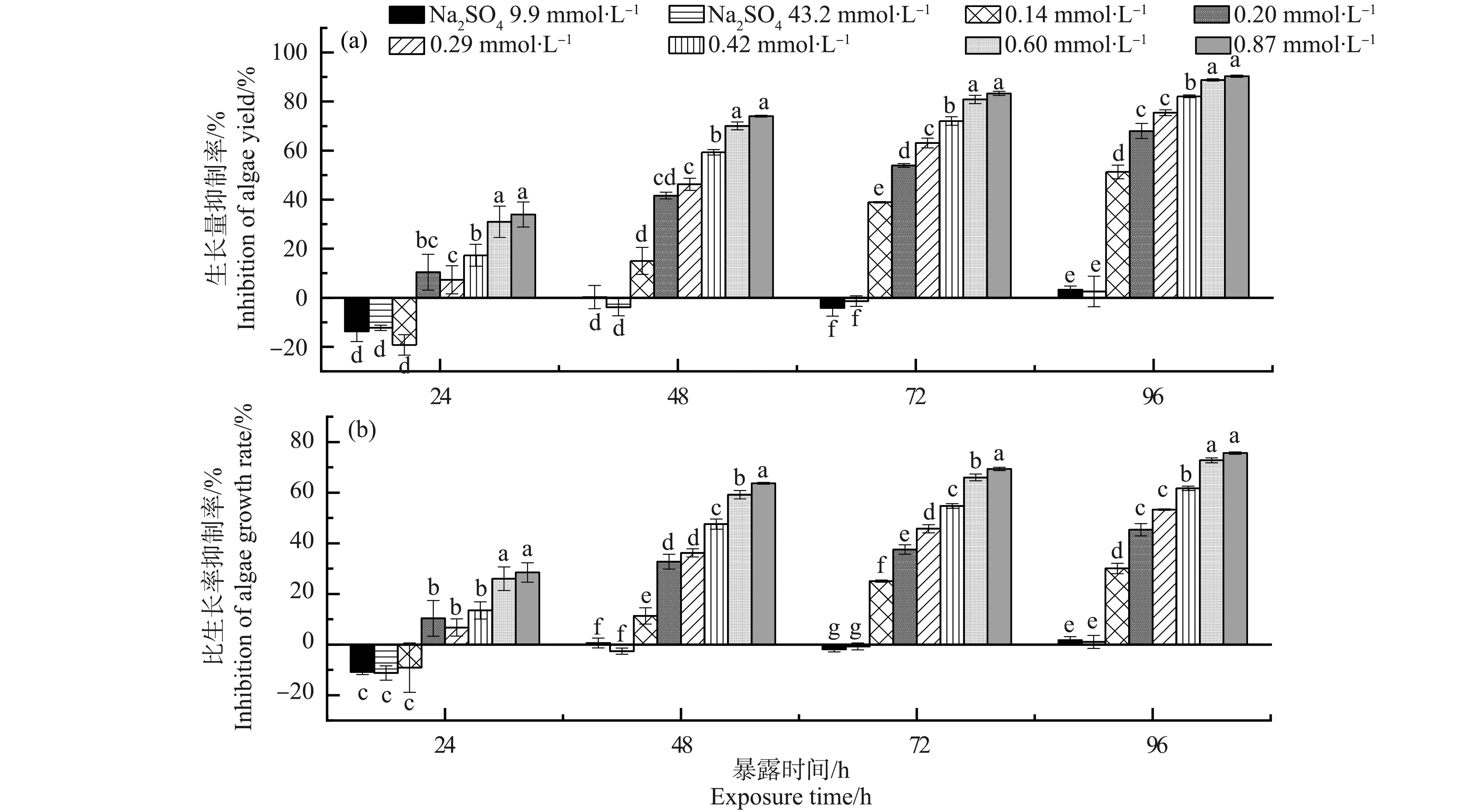
图1 脱水红霉素对蛋白核小球藻的生长量抑制率和比生长率抑制率Fig. 1 Inhibition of dehydroerythromycin on the yield and growth rate of Chlorella pyrenlidosa
根据概率单位法回归分析,计算出不同暴露时间下,脱水红霉素对蛋白核小球藻的ErC50和EyC50如表1所示。脱水红霉素对蛋白核小球藻的ErC50和EyC50均随暴露时间的增加而减少,在24 h时,ErC50和EyC50分别为2.107和1.444 mmol·L-1,当暴露时间延长到96 h时,ErC50和EyC50分别降低为0.267和0.117 mmol·L-1,这说明脱水红霉素的暴露时间越长,对蛋白核小球藻的毒性越大。值得注意的是,在不同暴露时间条件下,脱水红霉素对蛋白核小球藻的EyC50都小于ErC50,说明蛋白核小球藻的生长量抑制率是更敏感的指标。
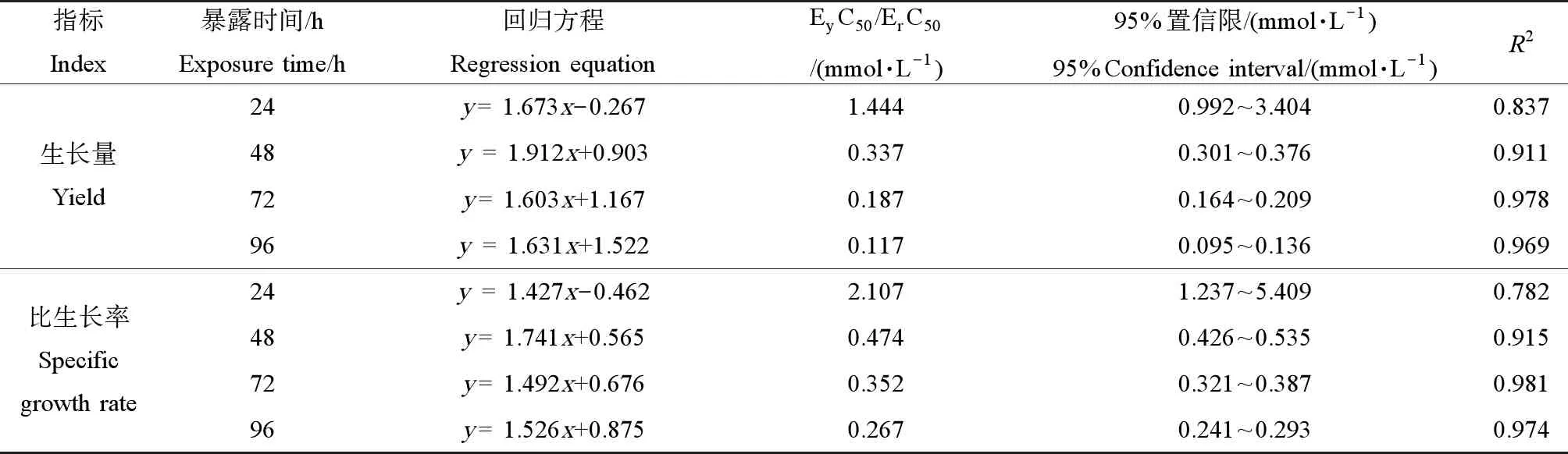
表1 脱水红霉素对蛋白核小球藻的生长率和生长量的半数抑制浓度(ErC50和EyC50)Table 1 Median effective concentration (ErC50 and EyC50) of dehydroerythromycin on the specific growth rate and yield of Chlorella pyrenlidosa
注:x为脱水红霉素的浓度对数,y为抑制率概率单位,R2表示回归方程的可决系数;EyC50和ErC50分别表示生长量半数抑制浓度和比生长率半数抑制浓度。
Note:xrepresents the log value of concentration of dehydroerythromycin, andyrepresents the probit of inhibition rate;R2represents the coefficient of determination of the regression equation; EyC50/ErC50represents median effective concentration of dehydroerythromycin on the yield and specific growth rate ofC.pyrenlidosa, respectively.
2.2 脱水红霉素对蛋白核小球藻生理生化指标的影响
2.2.1 叶绿素a含量
不同浓度脱水红霉素暴露96 h后,蛋白核小球藻的叶绿素a含量变化如图2所示。低盐组和高盐组都造成了蛋白核小球藻叶绿素a含量的降低,分别为对照组的69%和65%。但低盐组和高盐组与对照组都无显著性差异。不同浓度的脱水红霉素均抑制了蛋白核小球藻叶绿素a的合成。在脱水红霉素浓度为0.14和0.87 mmol·L-1暴露96 h后,蛋白核小球藻的叶绿素a含量分别为对照组的38%和11%,为低盐组的55%和16%,为高盐组的59%和17%。不同浓度的脱水红霉素处理组与对照组间均存在显著性差异。除0.14 mmol·L-1和0.2 mmol·L-1处理组与低盐组无显著性差异外,不同浓度的脱水红霉素处理组与硫酸盐组都具有显著性差异。
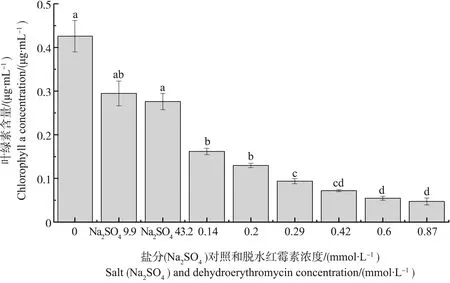
图2 脱水红霉素暴露96 h对蛋白核小球藻叶绿素a含量的影响Fig. 2 Effect of dehydroerythromycin on the chlorophyll a content of Chlorella pyrenlidosa after exposure for 96 h
2.2.2 抗氧化酶活性
脱水红霉素对蛋白核小球藻SOD和CAT酶活性的影响如图3所示。由图3(a)可知,盐分导致蛋白核小球藻的SOD酶活性略微降低,低盐组的SOD酶活性为空白对照组的89%,且两者之间无显著性差异;高盐组的SOD酶活性为空白对照组的80%,其与空白对照组有显著性差异。脱水红霉素的存在均导致SOD酶活性增强,可达到空白对照组的1.18~1.34倍,不同浓度脱水红霉素组SOD酶活性与空白对照组和硫酸盐组相比均具有显著性差异。
如图3(b)所示,硫酸盐组和脱水红霉素处理组都导致了蛋白核小球藻CAT酶活性的增加。低盐组和高盐组中,蛋白核小球藻的CAT酶活性可达到空白对照组的2.81倍和2.03倍,与空白对照组具有显著性差异。蛋白核小球藻的CAT酶活性随脱水红霉素浓度增加而增加,在脱水红霉素浓度为0.14和0.87 mmol·L-1时,蛋白核小球藻的CAT活性分别为对照组的1.79倍和3.89倍。在脱水红霉素浓度为0.2~0.6 mmol·L-1时,蛋白核小球藻的CAT活性与低盐组无显著性差异。脱水红霉素浓度为0.14 mmol·L-1时,蛋白核小球藻的CAT活性与高盐组无显著性差异,其余脱水红霉素处理组与高盐组具有显著性差异。
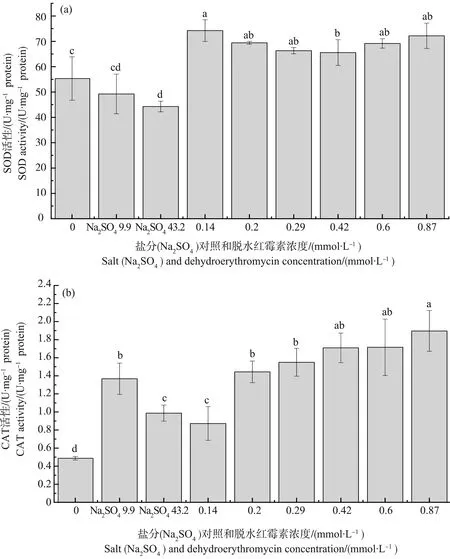
图3 脱水红霉素暴露96 h对蛋白核小球藻的超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性的影响Fig. 3 Effect of dehydroerythromycin on the superoxide dismutase (SOD) and catalase (CAT) activities of Chlorella pyrenlidosa after exposure for 96 h
2.2.3 MDA含量
脱水红霉素对蛋白核小球藻MDA含量的影响如图4所示。硫酸盐组和脱水红霉素组都导致了MDA含量的增加。低盐组和高盐组的MDA含量是空白对照组的1.70倍和1.80倍,且与对照组具有显著性差异。蛋白核小球藻的MDA含量随脱水红霉素浓度增加先增大后降低,在脱水红霉素浓度为0.6 mmol·L-1时,蛋白核小球藻的MDA含量可达到对照组的3.11倍,当脱水红霉素浓度升高到0.87 mmol·L-1时,蛋白核小球藻的MDA含量降低,为对照组的2.58倍。脱水红霉素处理组与空白对照组都有显著性差异,浓度为0.14 mmol·L-1的脱水红霉素处理组与硫酸盐组无显著性差异,而其他浓度的脱水红霉素处理组与硫酸盐组均具有显著性差异。
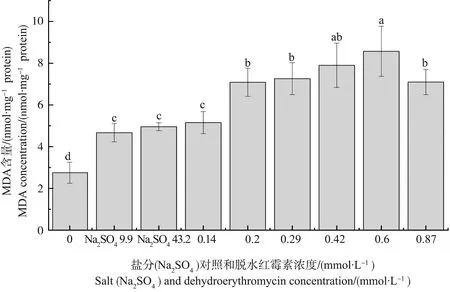
图4 脱水红霉素暴露96 h对蛋白核小球藻的丙二醛(MDA)含量的影响Fig. 4 Effect of dehydroerythromycin on the malonaldehyde (MDA) content of Chlorella pyrenlidosa after exposure for 96 h
2.3 藻液中脱水红霉素浓度变化
不同浓度的脱水红霉素暴露96 h后,藻液中脱水红霉素的剩余浓度占其初始浓度的百分比如图5所示。总体上,藻液中脱水红霉素的剩余浓度与其初始浓度之比随着脱水红霉素初始浓度的增加而降低,说明脱水红霉素的去除量随脱水红霉素初始浓度的增加而增加。在脱水红霉素浓度为0.14 mmol·L-1时,藻液中脱水红霉素的剩余量为0.135 mmol·L-1,剩余的脱水红霉素浓度为其初始浓度的96.2%;当脱水红霉素的初始浓度增加到0.87 mmol·L-1时,藻液中脱水红霉素的剩余浓度为0.493 mmol·L-1,剩余的脱水红霉素浓度为其初始浓度的56.6%。
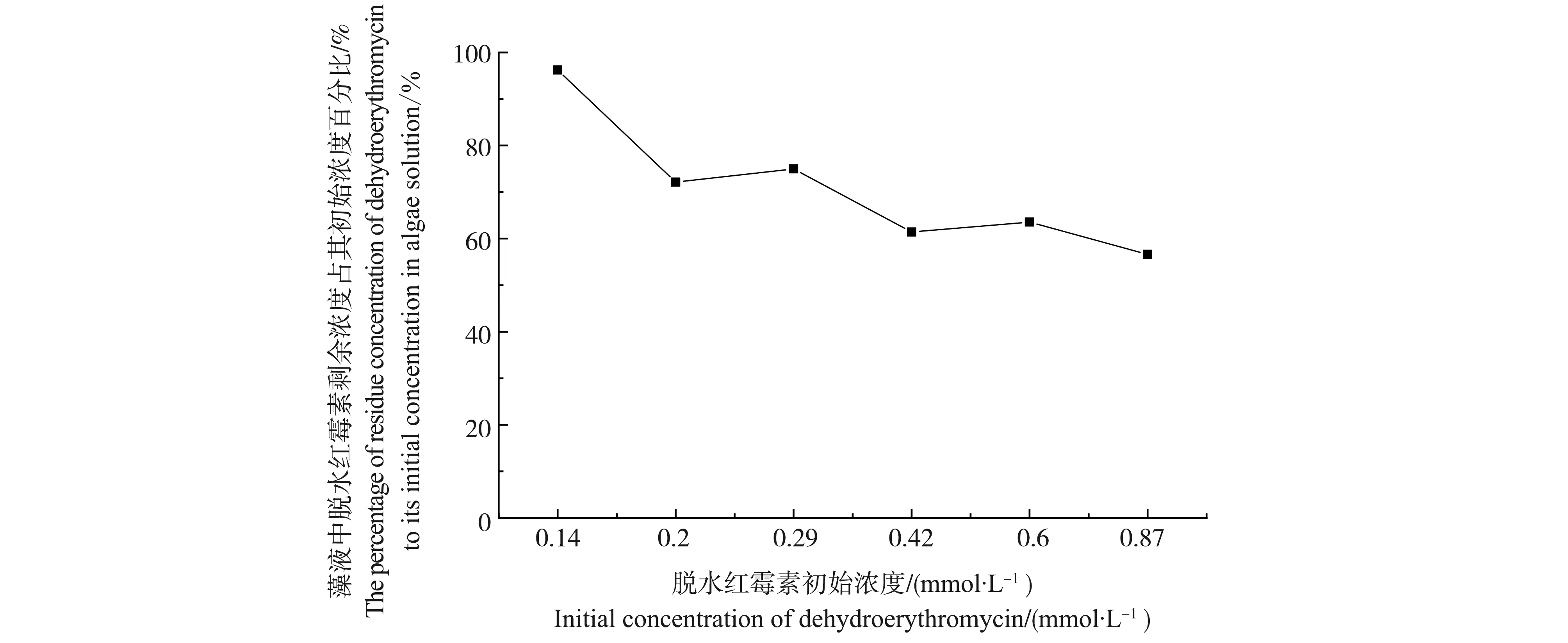
图5 暴露96 h后,藻液中脱水红霉素的剩余浓度与其初始浓度的关系Fig. 5 The relationship between the residual concentration of dehydroerythromyin and its initial concentration in algae solution after exposure time of 96 h
3 讨论(Discussion)
红霉素的生态毒性效应得到了较为充分的研究,普遍认为红霉素的生态毒性较高,在环境浓度水平下就可能引起可观察到的不利效应。González-Pleiter等[12]研究发现,红霉素对羊角月牙藻(Pseudokirckneriellasubcapitata)的EC50为(0.35±0.03) mg·L-1,对项圈藻(Anabaena)的EC50为(0.022±0.003) mg·L-1。Eguchi等[16]研究发现,红霉素对羊角月牙藻(Selenastrumcapricornutum)的EC50值为0.0366 mg·L-1,对普通小球藻(Chlorellavulgaris)的EC50为33.8 mg·L-1。El-Bassat等[17]研究发现,红霉素对普通小球藻(Chlorellavulgaris)的24 h半数致死浓度(LC50)值为12 mg·L-1,对尾草履虫(Parameciumcaudatum)的48 h-LC50值是16 mg·L-1。本研究中,脱水红霉素对蛋白核小球藻生长量和比生长率的96 h-EC50值分别为0.267和0.117 mmol·L-1,即83.76 mg·L-1和191.15 mg·L-1,明显高于红霉素对绿藻的毒性数据,说明脱水红霉素的生态毒性低于红霉素。水和废水检测方法[25]中规定,藻类生长抑制试验对毒物毒性的分级标准为:96 h-EC50<1 mg·L-1时为极高毒,在1~10 mg·L-1之间为高毒,在10~100 mg·L-1之间为中毒,>100 mg·L-1时为低毒,脱水红霉素对于蛋白核小球藻属于中-低毒物质。
叶绿素是各种浮游藻类中广泛存在的天然色素,是客观反映植物利用光照能力的一类重要指标,往往可以作为判断植物光合生理能力、反映环境胁迫状况的依据[26]。因此,叶绿素含量的变化趋势可以反映蛋白核小球藻在各发育阶段的生长状态。暴露于脱水红霉素96 h后,蛋白核小球藻细胞的叶绿素含量显著降低,且随着脱水红霉素浓度的增加而降低,表现出明显的剂量-效应关系,这与红霉素对羊角月牙藻叶绿素的影响是一致的[27]。研究表明,红霉素作为蛋白质合成抑制剂,可以有效抑制原核生物基因的表达,而叶绿体在基因表达等方面与原核生物具有很高的相似性,因此,红霉素可能对叶绿体基因表达有抑制作用[27-29]。而脱水红霉素具有与红霉素相似的结构,其对叶绿素a的影响可能也是因为抑制了叶绿体基因的表达,阻碍了叶绿素的合成造成的。
MDA是膜脂中的脂肪酸的一种过氧化产物,也是脂质过氧化的重要指标,常用来反映环境污染胁迫对藻细胞带来的过氧化损害[39-40]。研究表明,暴露于螺旋霉素和四环素等有机污染物时,可导致植物细胞中MDA含量显著升高[41-42]。本研究中,脱水红霉素暴露也导致了MDA含量的升高,这说明脱水红霉素诱导的SOD和CAT酶活性升高并不足以清除细胞体内的氧化自由基,脱水红霉素对藻细胞产生氧化胁迫,并导致过氧化产物MDA的积累,影响了细胞膜的完整性,导致细胞功能的不可逆损伤[27],并进而影响到藻的生长和生理生化功能。
值得注意的是,尽管盐分的存在未影响蛋白核小球藻的生长,但是却对其生理生化响应产生了一定的影响。硫酸盐组导致叶绿素a含量略微降低,与空白组之间无显著性差异。这可能是因为硫酸钠能抑制叶绿体中PSⅡ活动中的电子移转移,导致PSⅡ中的量子产率也相应的受到抑制,影响了叶绿素的合成[43]。硫酸盐组导致了SOD酶活性略微降低,CAT酶活性和MDA含量升高,这说明过量的硫酸钠盐分也会对绿藻产生氧化胁迫[44]。
暴露96 h后,藻液中脱水红霉素的去除率随其初始浓度增加而增高,在脱水红霉素浓度为0.87 mmol·L-1时,脱水红霉素的去除率可达到43%。由于脱水红霉素难以水解和生物降解[45],其在藻液中的消除可能主要是由于蛋白核小球藻的表面吸附、吸收以及代谢作用,但这3种途径对脱水红霉素去除率的贡献,以及脱水红霉素在细胞体内的积累、代谢过程及其毒作用机理还待于进一步的研究。
