花后高温胁迫下外施多胺对不同耐热性小麦产量性状及旗叶生理的影响
2020-01-08靖建国李有芳贾姝萍向雪纯李卫华
靖建国,李有芳,贾姝萍,向雪纯,李卫华
(石河子大学农学院/新疆生产建设兵团绿洲生态重点实验室,新疆石河子 838202)
温度是影响小麦产量和品质的重要环境因子。小麦生育后期的高温胁迫会引起许多生理变化,如叶片细胞结构与功能受到破坏、叶绿素含量下降、光合能力减弱及叶片早衰等,最终导致籽粒灌浆速率降低,缩短灌浆期,造成减产[1-4]。随着全气候变暖,小麦产区出现高温天气的频率在过去几十年一直呈上升趋势,且在未来会不断提高[5]。因此,采用有效的调控措施缓解高温胁迫对小麦籽粒灌浆的抑制作用,对小麦的高产稳产具有重要意义。
多胺是一类广泛存在于生物体内的具有生物活性的低分子量脂肪族含氮碱,被认为是生长调节物质或激素的第二信使[6-7],不仅能促进小麦籽粒灌浆[8],而且在植物抗逆方面发挥着重要作用[9-10]。研究表明,小麦种子成熟脱水过程中,游离Spd和Spm水平明显上升[11],抗旱性强的小麦品种中较高的Spm和Spd含量能够拮抗逆境对小麦生长的抑制作用[7]。但有关多胺是否参与高温胁迫下小麦灌浆过程中旗叶净光合速率(Pn)、叶绿素荧光特性、冠层温度、叶绿素含量、旗叶表面温度以及产量性状调控的报道极少。本研究以两个耐热性不同的新疆春小麦品种新春6号和新春31号为试验材料,探讨外施多胺对小麦花后高温胁迫的减缓效应,以期为春小麦抗高温生产提供理论依据和技术指导。
1 材料与方法
1.1 供试材料
本试验供试春小麦为耐热品种新春6号和热敏感品种新春31号[12],两者开花期一致,生育期相同。两品种均于2018年3月2日播种,7月3日收获。供试精胺和亚精胺纯度分别≥98%、 ≥97%(sigma公司)。
1.2 试验地点
试验在石河子大学农学试验站进行。试验地土壤为壤土,含全氮0.76 g·kg-1、碱解氮 0.058 g·kg-1、速效磷0.025 g·kg-1、全钾149 g·kg-1、有机质12.5 g·kg-1,土壤pH为7.6。2017年9月基施磷酸二铵(N含量为16.5%,含P2O547.5%)155 kg·hm-2;2018年在小麦三叶期、拔节期、抽穗期和灌浆前中期(花后14 d左右)随灌水分别追施尿素70、150、80和80 kg·hm-2。高温处理期间未出现自然降雨。
1.3 试验设计与方法
试验设置4个处理:对照(棚外自然条件),记为CK;人工模拟高温,记为HT;人工模拟高温+外施精胺(1mmol·L-1),记为HT+Spm;人工模拟高温+外施亚精胺(1 mmol·L-1),记为HT+Spd。小区面积为1 m2,播种密度为300 粒·m-2,行距为0.2 m,每个处理重复3次,采用完全随机排列。参照江文文等[10]的高温胁迫方法,稍作改进,增温棚用0.1 mm高透光聚乙烯塑料薄膜制成,面积与总试验面积相同,高约1.5 m,与小麦冠层之间的距离50 cm左右。于花后8~12 d,每天10:00-18:00盖棚模拟高温环境。棚四周保持通风顺畅。外源多胺喷施从高温处理前一天开始,连续处理5 d,处理时间为每天傍晚8点,喷施于旗叶和穗上,每次喷施量为20 mL(对照喷等量清水)。温度记录仪(RC-4HA/C,江苏精创电气股份有限公司)挂在棚内外距小麦冠层约30 cm处,自动记录温度(图1)。由图1可见,高温处理期间棚内平均温度为 34.92 ℃,显著高于棚外温度(30.52 ℃)。除温度和外施多胺外,其他管理措施同当地大田小麦生产。
在开花期选择同一日开花的穗子挂牌标记。旗叶生理指标每隔5 d测定一次,其中花后7 d为高温处理前,花后13 d、19 d、25 d和31 d为高温处理后。
1.4 测试项目与方法
1.4.1 净光合速率(Pn)的测定
用便携式光合测定系统Li-6400(Li-Cor. Inc.,USA),于11:00-13:00天气晴朗时采用闭路方法测定小麦旗叶Pn。测定时内部温度调节器控制叶室温度为30 ℃,参比室CO2流速为500 μmol·s-2,光照强度1 700 μmol·m-2·s-1。每个小区测定9片旗叶,取平均值。
1.4.2 叶绿素含量的测定
用SPAD 502仪测定旗叶叶绿素相对含量,每个小区测定10片旗叶,每个叶片分叶尖、叶中和叶基测量3次,取平均值。
1.4.3 叶绿素荧光动力学参数及叶温测定
采用便携式调制荧光仪PAM-2100进行田间活体测定。选取受光方向相同且生长一致的旗叶,测定叶表面温度及叶绿素荧光动力学参数,每个小区测定5片旗叶,参照李秀等[13]的方法计算相关参数。
1.4.4 冠层温度的测定
花后24 d,采用作物冠层温度测量仪TOP-500测定冠层温度,每个处理3次 重复。
1.4.5 旗叶相对含水量的测定
采用张志良等[14]的方法对旗叶含水量进行测定。将旗叶冲洗干净,用滤纸吸干表面水分后称其质量,得鲜重;将测完的叶片标记后放入105 ℃烘箱中杀青20 min,之后于80 ℃下烘干至恒重,称其质量,得干重;相对含水量=(鲜重-干重)/鲜重×100%。每个小区测定10片旗叶。
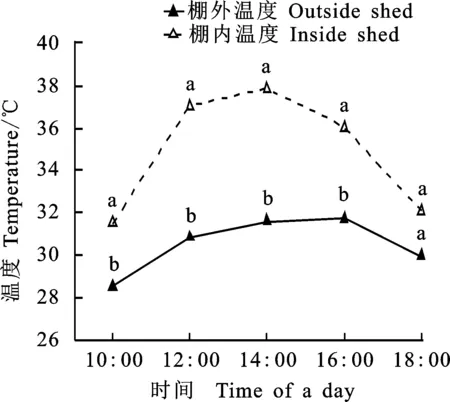
不同小写字母表示棚内外差异显著。
Different letters mean significant difference between outside and inside at 0.05 level.
图1 处理期间大棚内外平均温度日变化
Fig.1Diurnal variation of average temperatureinside and outside the shed during treatments
1.4.6 产量及其构成测定
成熟时各小区随机选取10株小麦,测定穗粒数(grain number per spike,GNP)、结实小穗数(seeding spikelet number per spike,SeSN)、不育小穗数(sterile spikelet number per spike,StSN)和单穗重(grain weight per spike,GWP),并计算不同处理理论产量(theoretical yield,TY);使用GAC-2100AGRI型谷物水分测定仪测定籽粒容重(test weight,TW);随机选取1 000粒籽粒测定千粒重(thousand-grain weight,TGW),3次重复;理论产量=公顷穗数×穗粒数×千粒重×10-6×85%,由于春小麦分蘖成穗率较低,而且试验处理在开花后进行,对穗数影响较小,因此公顷穗数统一用基本苗数来代替。
1.5 数据分析
处理数据和作图用Microsoft Excel 2010和Origin 2018软件,数据方差分析和显著性检验用SPSS 22.0软件。
2 结果与分析
2.1 多胺对高温胁迫下小麦产量性状的影响
由表1可知,与CK相比,HT处理导致两个品种的穗粒数、千粒重、容重、结实小穗数、单穗重和理论产量均显著降低,其中耐热品种新春6号降幅分别为18%、13%、2%、6%、25%和29%,热敏感品种新春31号分别为26%、15%、3%、15%、32%和37%。同时高温导致两个品种不育小穗数分别升高210%和212%,说明高温胁迫对小麦产量性状产生明显影响,且影响程度存在品种间差异,对新春31号的影响大于新春6号,HT处理的减产效应主要归因于穗粒数和千粒重的降低。与HT处理相比,HT+Spm和HT+Spd处理均使两个品种的穗粒数、千粒重、结实小穗数、单穗重和理论产量显著升高,其中HT+Spm处理下新春6号的增幅分别为17%、7%、5%、19%和25%,新春31号增幅分别为24%、10%、15%、35%和36%,而HT+Spd处理下新春6号的增幅分别为5%、5%、3%、5%和11%,新春31号增幅分别为17%、12%、12%、32%和31%;同时,HT+Spm和HT+Spd处理显著降低了不育小穗数,新春6号的降幅分别为57%和25%,新春31号降幅分别为27%和37%。这说明高温胁迫下喷施外源Spm和Spd可显著缓解高温对小麦产量形成的不利影响,Spm的缓解效果优于Spd,且对热敏感品种的缓解效果更好。
2.2 多胺对高温胁迫下净光合速率(Pn)的影响
两个品种的旗叶Pn随灌浆进程基本呈下降趋势(图2)。与CK相比,HT处理使两个品种旗叶Pn在花后13 d、19 d和25 d均显著降低,其中花后13 d的降幅最大,新春6号和新春31号分别下降38%和53%,说明小麦旗叶Pn对高温胁迫的响应存在品种间差异。与HT处理相比,HT+Spm处理后两个品种的旗叶Pn在花后 13 d、19 d、25 d和31 d均显著升高,升幅分别在花后19 d和25 d最高,分别为22%和109%; HT+Spd处理后两个品种的旗叶Pn在花后 13 d、19 d、和31 d均显著升高,升幅均在花后 13 d最高,分别为72%和179%。
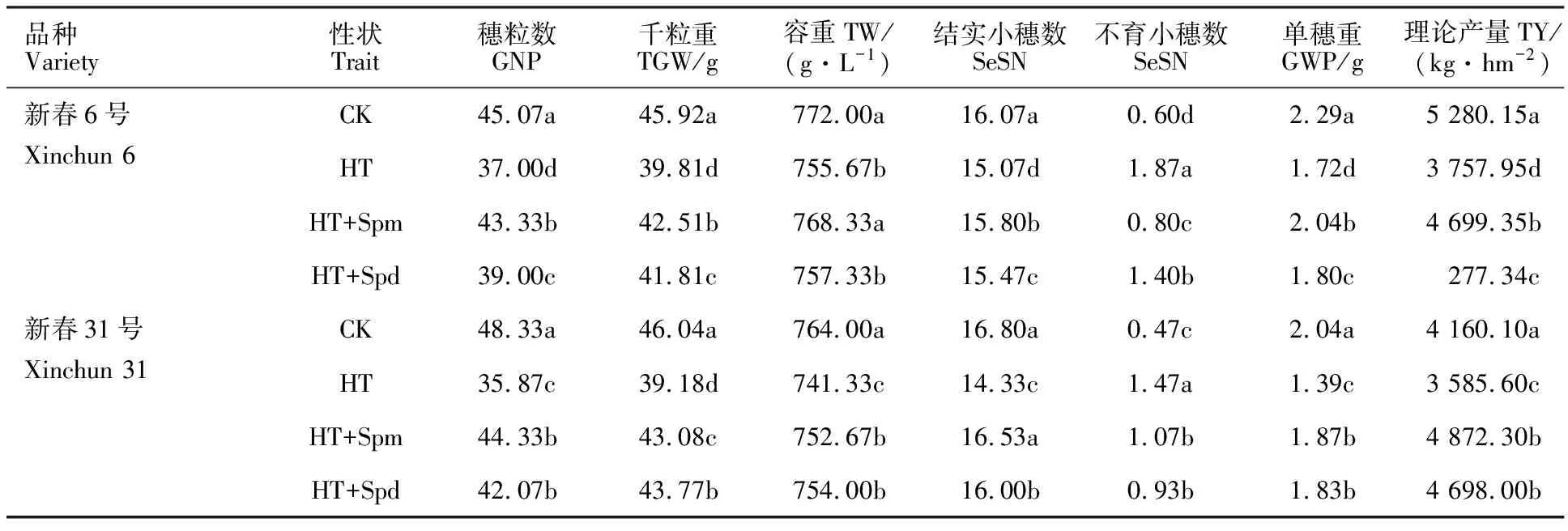
表1 多胺对高温胁迫下小麦产量性状的影响Table 1 Effect of polyamines on yield traits of wheat under high temperature stress
数据后不同字母表示处理间有显著差异(P<0.05)。下表同。
Different values followed by different letters in the same columns are significantly different among the treatments at 0.05 level.The same in the other tables.
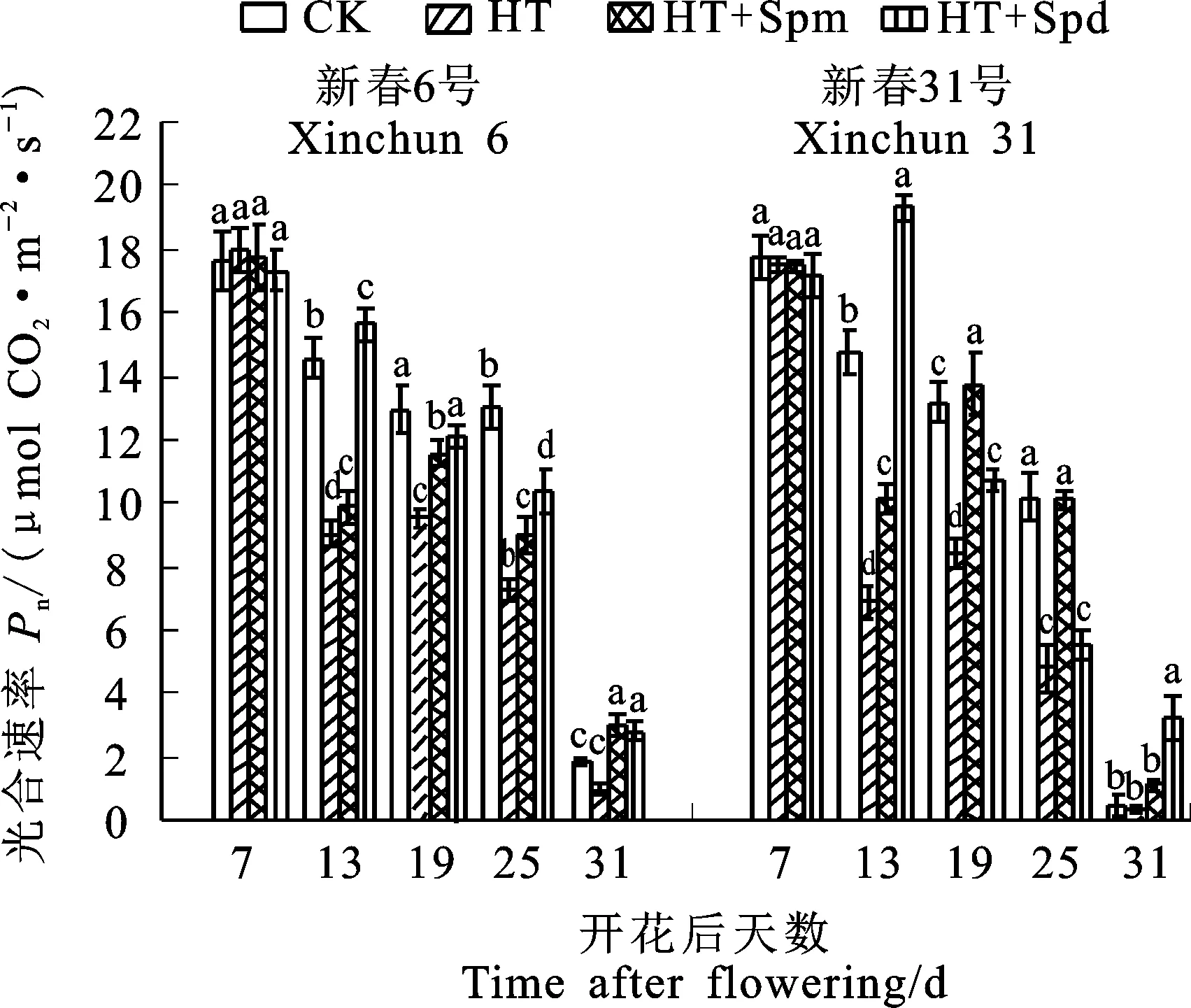
图柱上的字母不同表示处理间差异显著。下图同。
Different letters above the columns are significantly different among the treatments at 0.05 level. The same in figures 3-6.
图2高温胁迫下多胺处理后不同时期小麦旗叶净光合速率的变化
Fig.2Changes of net photosynthetic rate in wheat flagleaves at different stages after polyaminetreatment under high temperature stress
2.3 多胺对高温胁迫下小麦旗叶相对含水量和叶绿素含量的影响
2.3.1 多胺对高温胁迫下小麦旗叶相对含水量(WC)的影响
小麦旗叶WC随灌浆进程基本呈下降趋势,前期下降缓慢,后期急剧降低(图3A)。高温处理前(花后7 d)两个品种的旗叶WC在四个处理之间差异不显著,说明待处理的植株水分状况基本一致。HT处理后(花后13 d)新春6号的旗叶WC与CK相比显著降低,新春31号的旗叶WC虽然有所降低,但差异不显著,说明耐热品种新春6号在高温胁迫过程中旗叶水分蒸腾较多,即能快速响应高温胁迫。HT+Spm处理后两个品种的旗叶WC在花后13 d、19 d和25 d均显著高于HT处理,而HT+Spd处理后两个品种的旗叶WC仅在花后13 d显著提高,说明喷施外源Spm后高温胁迫下小麦旗叶保水作用较持久。
2.3.2 多胺对高温胁迫下小麦旗叶SPAD值的影响
新春6号和新春31号的旗叶SPAD值随着生育进程基本呈下降趋势(图3B)。高温胁迫前(花后7 d),两个品种的旗叶SPAD值在四个处理之间差异不显著。花后13 d,两个品种的SPAD值以HT+Spd处理最高,与HT+Spm处理和CK差异均显著,与HT处理差异不显著,HT处理高于HT+Spm处理和CK。花后19 d,两个品种的SPAD值均以CK最高,HT+Spd处理次之,HT处理最低。花后31 d,两个品种的SPAD值均以HT+Spm处理最高,HT+Spd处理次之,且二处理与其余处理差异均显著。这说明喷施外源多胺可缓解高温胁迫对小麦旗叶衰老的促进效应,且外源Spm缓解效果较好。
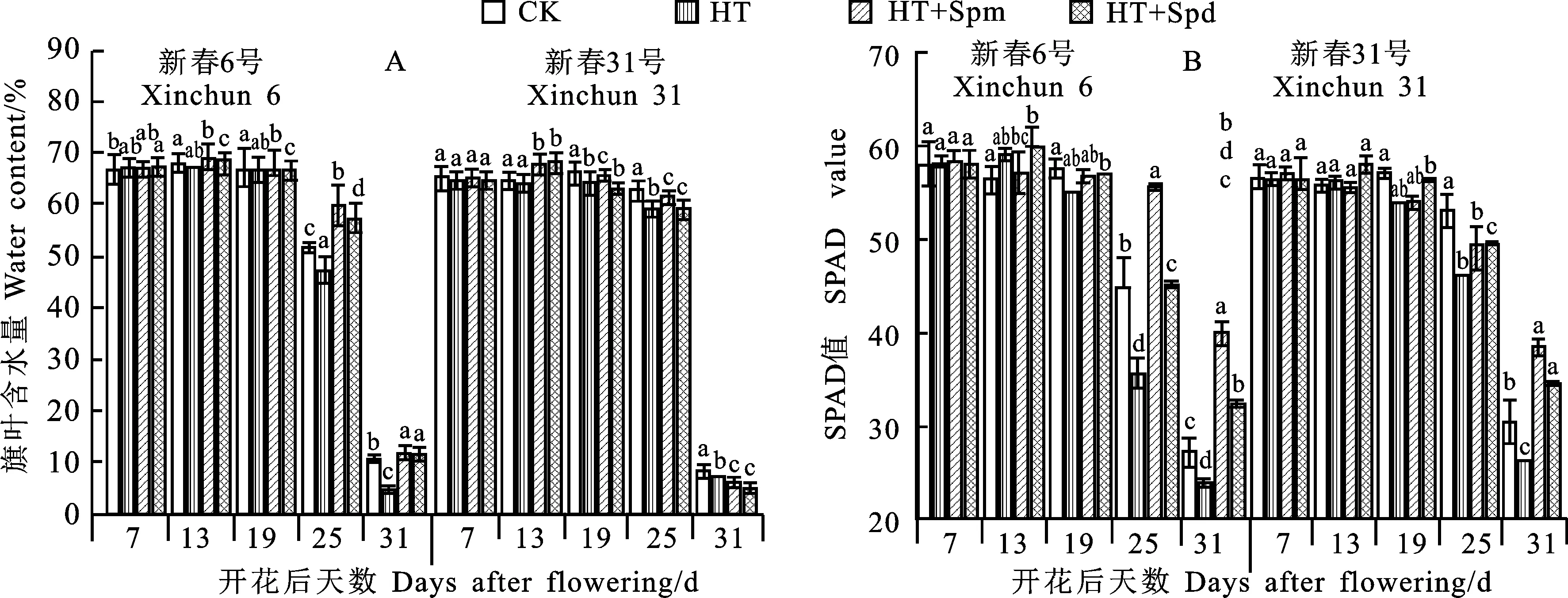
图3 高温胁迫下多胺处理后不同时期小麦旗叶含水量和叶绿素含量的变化
2.4 多胺对高温胁迫下小麦旗叶叶绿素荧光参数的影响
2.4.1 多胺对高温胁迫下小麦旗叶非光化学猝灭系数(NPQ)的影响
新春6号和新春31号旗叶NPQ随着生育进程基本呈上升趋势(图4A)。高温胁迫前(花后7 d),新春6号和新春31号的NPQ在四个处理之间差异不显著。与CK相比,HT处理下两个品种旗叶的NPQ在花后13 d和19 d显著降低,而花后25 d和31 d显著升高,说明高温胁迫前期两个品种光化学反应过程中热耗散增多。与HT处理相比,花后13 d,HT+Spm处理使两个品种的NPQ显著升高,HT+Spd处理无显著变化;花后25 d和31 d,HT+Spm和HT+Spd处理均显著降低,且HT+Spm处理降幅较大,说明高温胁迫下喷施外源多胺在胁迫初期可有效提高NPQ,消耗过剩的激发能,从而保护光化学反应中心,缓解高温对小麦旗叶的伤害,且外源Spm缓解效果较优。
2.4.2 多胺对高温胁迫下小麦旗叶激发能分配不平衡性(β/α-1)的影响
新春6号和新春31号的旗叶β/α-1在灌浆前期上升缓慢,后期急剧上升(图4B)。HT处理导致两个品种旗叶β/α-1全生育期显著高于CK,外源喷施Spm和Spd可以可显著抑制其上升。值得一提的是花后25 d和31 d,两个品种旗叶的β/α-1均以HT处理最高,CK次之,HT+Spm处理最低,处理之间差异达到显著水平(花后25 d新春6号CK和HT+Spd处理除外)。这说明高温胁迫造成两个光系统之间激发能分配不平衡,喷施外源Spm和Spd可缓解高温胁迫对小麦旗叶的伤害,Spm在生育后期缓解效果优于Spd。
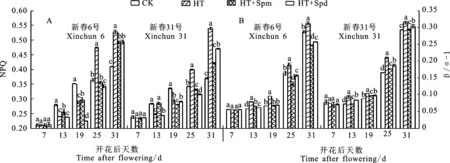
图4 高温胁迫下多胺处理后不同时期小麦旗叶叶绿素荧光参数的变化
2.5 多胺对高温胁迫下小麦冠层温度和旗叶表面温度的影响
小麦旗叶的表面温度随灌浆进程呈上升趋势(图5和图6)。与CK相比,HT处理显著提高花后24 d的冠层温度。与HT处理相比,HT+ Spm处理显著降低两个品种的冠层温度,而HT+Spd处理虽然降低了新春31号的冠层温度,但差异不显著;HT+Spd处理使新春6号和新春31号花后13 d的旗叶表面温度分别降低12%和13%,HT+Spm处理分别降低4%和8%,但HT+Spm处理下两个品种花后19 d和31 d的旗叶表面温度显著低于HT+Spd处理。这表明高温处理下喷施外源多胺可降低春小麦冠层温度和旗叶表面温度,其中Spd的效果优于Spm。
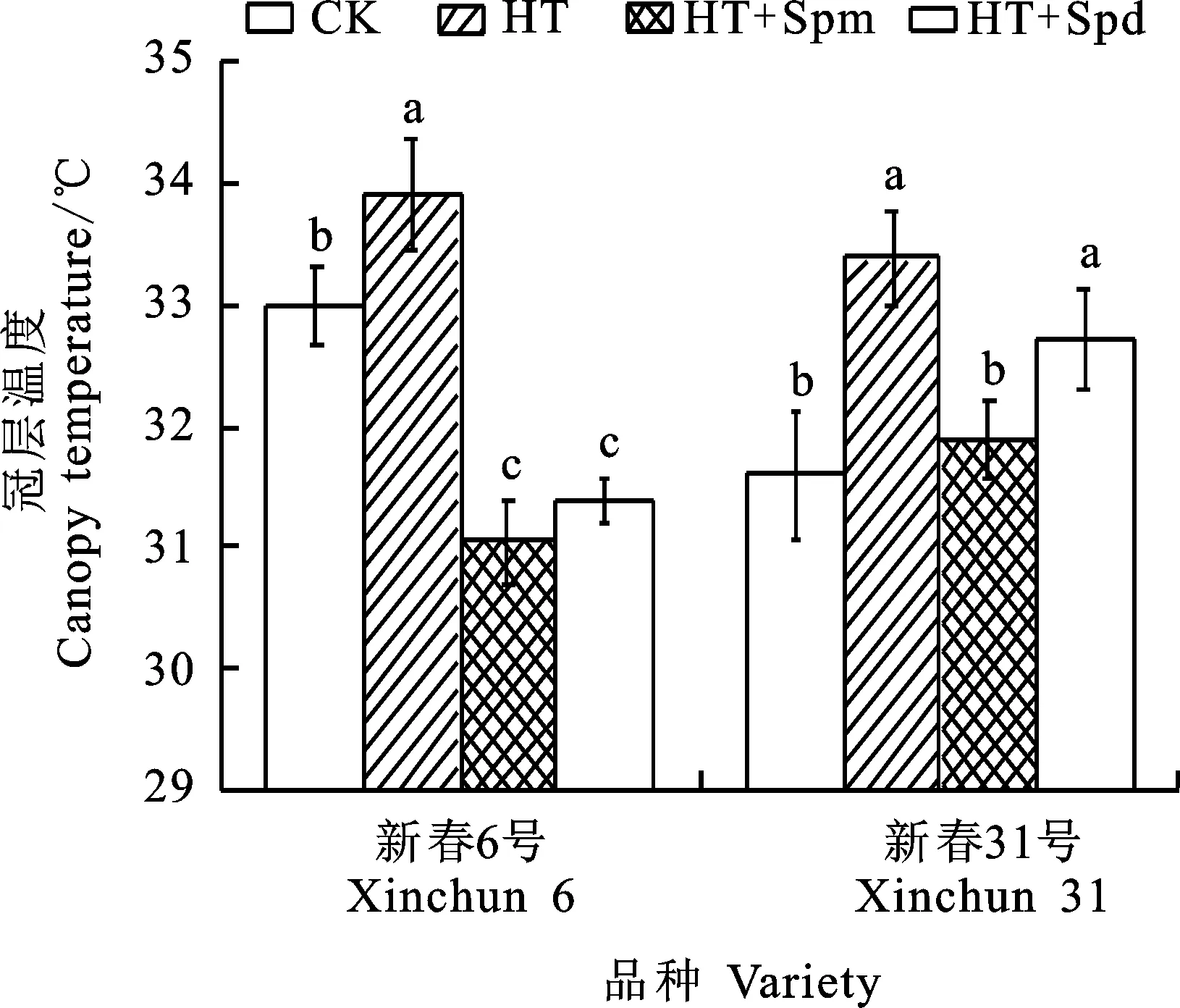
图5 高温胁迫下多胺处理后冠层温度变化
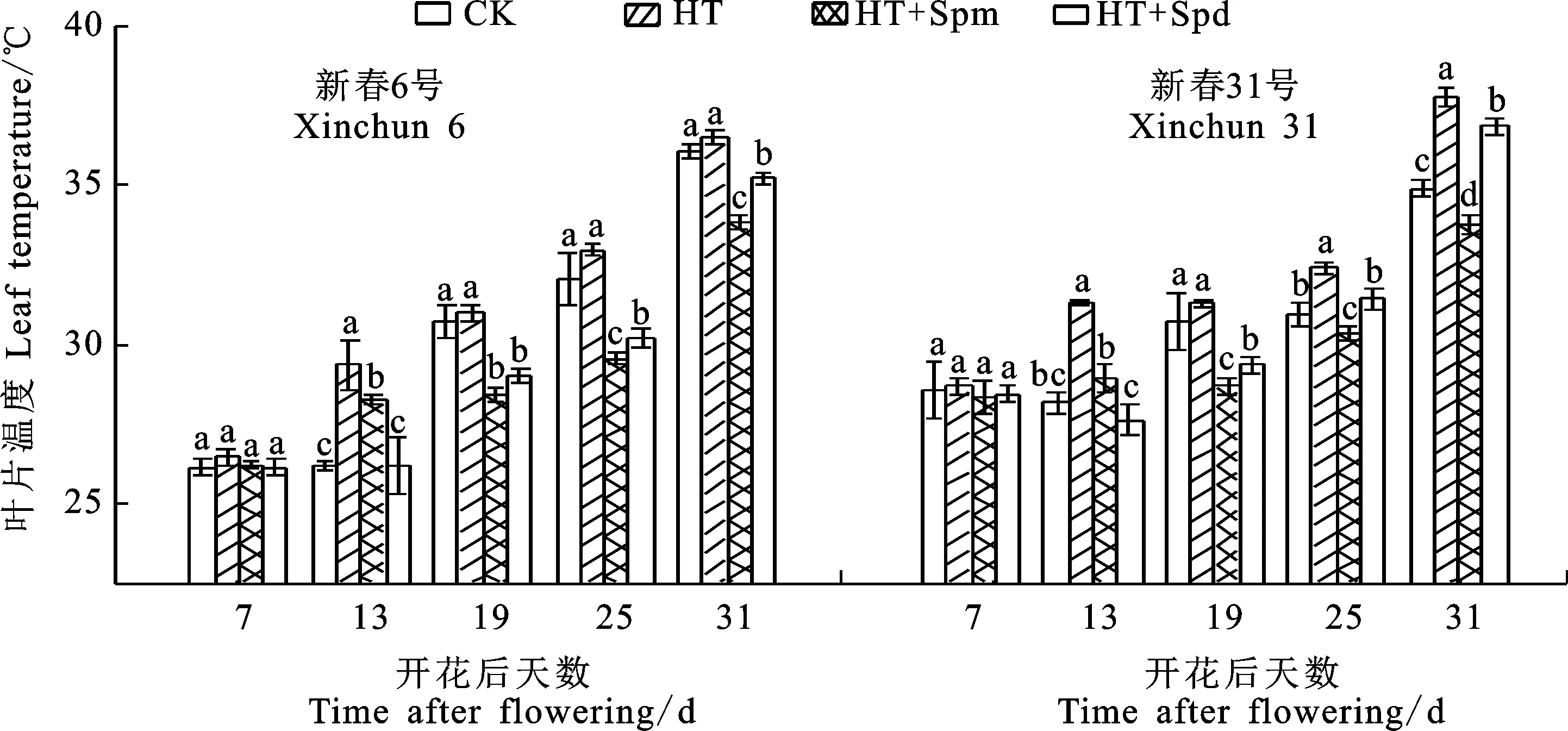
图6 高温胁迫下多胺处理后不同时期小麦旗叶温度变化
3 讨 论
3.1 外源多胺对高温胁迫下小麦产量性状的 影响
高温胁迫对小麦籽粒产量及品质的影响在国内外已被开展了多年的研究。一些研究表明,灌浆期高温胁迫致使冬小麦产量降低[15-16],在不同灌浆阶段高温胁迫的效应不同[17]。本研究中,花后8~13 d,HT处理使两个小麦品种的千粒重、容重、穗粒数、结实小穗数、穗粒重和理论产量均显著降低,不育小穗数显著升高,这与前人研究结果一致[18-19]。高温使两个品种的穗粒数显著降低18%和26%,千粒重显著下降13%和15%,说明花后高温导产量降低的主要原因是降低了穗粒数和千粒重。多胺被认为参与了禾谷类籽粒灌浆的调控[20]。正常玉米籽粒的多胺浓度明显高于败育玉米籽粒,多胺浓度与胚乳核数呈正相关[21]。Yang等发现,较高水平的Spd和Spm会促进水稻籽粒灌浆,增加水稻的粒重[22]。本研究结果表明,高温胁迫下喷施外源Spm和Spd使两个小麦品种的千粒重、穗粒数、结实小穗数、穗粒重和理论产量与HT处理相比显著升高,不育小穗数率显著降低,且就最终理论产量来看,外源Spm对两个品种灌浆期高温伤害的缓解优于外源Spd。
3.2 外源多胺对高温胁迫下小麦产量性状的调控与旗叶光合等生理指标的关系
光合作用是植物对高温最敏感的生理过程之一,在其他胁迫效应出现前,可以完全被抑制[23]。高温胁迫下,光合作用的关键酶Rubisco失活,RuBP羧化酶活性降低[24],从而影响同化二氧化碳的能力,使Pn显著下降[25]。本研究中,不同小麦品种光合特性对高温的反应差异明显,这与前人在高温弱光下和高温下的观测结果一致[26-27]。高温处理后(花后13 d),新春6号的旗叶Pn与CK相比下降38%,新春31号下降53%,这与李召峰对高温胁迫后新春6号与新春31号变化分析的结果一致[12];高温处理下两个品种的Pn在花后13 d下降后又升高(花后19 d),这可能与植物的自我调节有关。有研究表明,外源多胺可快速进入完整的叶绿体(对逆境胁迫最敏感的细胞器之一),参与逆境条件下光合元件的保护;外源添加Put和Spm可有效提高叶绿体内抗氧化酶活性,清除ROS,恢复叶绿体构型[28-29]。本研究中,高温胁迫下,花后13 d,喷施Spd使两个品种旗叶Pn与HT处理相比分别升高72%和179%,喷施Spm使新春31号旗叶Pn显著升高47%,这可能与外源Spm和Spd能缓解高温胁迫下小麦旗叶叶绿素分解和激发能分配的失衡,提高胁迫初期旗叶NPQ,消耗过剩的激发能,从而保护光化学反应中心有关。
在正常情况下,植物的叶片温度通过蒸腾失水来维持相对的稳定,一旦受到逆境胁迫的影响,叶片温度会发生变化,叶温的改变通常会改变叶片表面热量和叶片含水量状况,而冠层温度测量仪可以快速精确地检测植物叶片因气孔开度变化而导致的微小温度差异,并且能把这种通过传统手段很难量化的指标以可视化的图像呈现出来,可以被用来监测诊断植株的受胁迫情况[30-31]。本研究表明,高温胁迫后两个品种旗叶表面温度和冠层温度均升高,旗叶WC降低,这可能是植物在面临逆境时做出的应激调整;花后13 d新春6号叶片表面温度高于新春31,新春6号旗叶WC在HT处理下显著降低,而新春31号降低不显著,此时两个品种旗叶Pn分别下降38%和53%,这都可能是高温造成新春31号减产幅度较大的主要原因之一。高温胁迫下喷施外源多胺对两个品种冠层温度、旗叶表面温度和WC的不利变化均能起到一定缓解作用。本试验观察到,花后13 d,HT+Spd处理使两个品种旗叶表面温度与HT处理相比分别降低12%和13%,HT+Spm处理使表面温度分别降低4%和8%,而花后19 d和31 d,HT+Spm处理下两个品种的旗叶表面温度均显著低于HT+Spd处理,HT+Spm处理使两个品种旗叶WC在花后13 d、19 d和25 d均显著高于同时期的HT处理,而外源Spd仅在花后13 d使两个品种旗叶WC显著提高,这表明高温处理下外源Spm缓解高温伤害的效果更持久,这可能是由于两个品种内源多胺含量差异造成的,有待未来研究进一步分析。另外,高温胁迫下喷施Spm和Spd处理的小麦旗叶Pn在某些时间显著高于CK,这可能与新疆小麦灌浆期的温度本身就高于小麦灌浆最佳温度有关,未来需要进一步完善试验计划,增加对照下喷施Spm和Spd处理,以及扩大小区面积。综上所述,本研究认为,外源Spm和Spd均能缓解高温胁迫对小麦造成的伤害,缓解由高温造成的产量损失,且外源Spm缓解效果比外源Spd更持久,其调控作用与叶片净光合速率、叶绿素荧光参数、叶绿素含量、含水量及气孔开闭密切相关。
