花生种子长宽比性状遗传分析和相关SSR标记筛选
2020-01-08张胜忠苗华荣赵立波崔凤高张智猛孙令强胡晓辉
张胜忠,苗华荣,赵立波,崔凤高,张智猛,孙令强,胡晓辉*,陈 静*
(1.山东省花生研究所,山东 青岛 266100;2.青岛市农业广播电视学校,山东 青岛 266071)3.青岛市农业机械服务中心,山东 青岛 266071)
花生(ArachishypogaeaL.)是我国主要油料和经济作物,常年种植面积约500万hm2,总产1500万t左右,花生高产、稳产对保障我国植物油脂和植物蛋白的安全供给具有重要意义。花生粒型,包括粒长、粒宽以及长宽比,直接决定粒重,进而影响花生产量[1]。花生种子长宽比直接决定花生籽仁形状,是影响花生外观和加工品质的重要因素[2]。因此,加强花生粒型(特别是种子长宽比)遗传机理的研究,对于通过遗传调控培育符合粒型目标的花生新品种具有重要意义。
栽培种花生是异源四倍体,起源于两个野生种杂交,遗传基础较为狭窄[3-6],有关花生粒型性状遗传分析和相关分子标记研究相对滞后。近年来,随着分子标记技术的发展,花生种子长宽比遗传机制研究取得了一定进展。粒型性状相关性分析表明,种子长宽比与种子长度呈正相关、与种子宽度相关性不显著[7]。李振动等利用徐州68-4和远杂9102杂交构建的195个RIL家系,利用SSR标记构建遗传图谱,定位到9个控制种子长宽比的QTL位点,其中1个QTL在两个环境中均可检测到,遗传贡献率为10.75%~23.70%[8]。Chen等利用‘富川大花生’和‘ICG6375’杂交构建的RIL群体,基于SSR标记定位到9个控制种子长宽比的QTL,遗传贡献率为5.5%~11.8%[9]。Wang等利用‘ZH6’和‘sd-H1’杂交构建RIL群体,基于高密度遗传图谱检测到3个种子长宽比相关QTL[7]。
总体而言,花生籽仁长宽比性状遗传机制的研究仍然很不完善,定位到QTL数目依然较少,分子标记辅助育种工作难以有效开展。本课题组前期利用高产抗逆大花生品种‘花育36号’和高油小花生品系‘高油613’,完成了重组自交系群体(RIL)的构建。本研究通过对该RIL群体种子长宽比进行遗传分析和相关SSR标记挖掘,为后续相关QTL/基因的定位和克隆奠定了重要基础。
1 材料和方法
1.1 试验材料
本研究以‘花育36号’ב高油613’构建的重组自交系群体RIL为试验材料。该群体包含181个家系。母本‘花育36号’为山东省花生研究所育成的高产优质抗逆大花生品种,粒型较长,通过了山东省农作物品种审定委员会审定、国家鉴定和非重要农作物品种登记,获得了植物新品种保护权;父本‘高油613’为山东省花生研究所育成的高油品系,粒型短圆。2017-2018年将RIL群体和亲本分别种植于海南省三亚市南滨农场和山东省莱西市花生研究所试验站,成熟收获后晾干备用。
1.2 试验方法
1.2.1 田间种植
将RIL群体(F2:6-7)和亲本于2个环境下种植。环境1(E1):2017年11月种植于海南省三亚市南滨农场,2018年3月份收获;环境2(E2):2018年5月种植在山东省莱西市花生研究所试验站,同年9月份收获。种植方式为起垄双行单粒播种,行距40 cm,株距16.7 cm,每个家系种植10株,进行覆膜。种植成熟收获后,晾晒至种子含水量低于10%。田间水肥管理等同于常规大田,及时进行病虫害防治。
1.2.2 植物基因组DNA提取
幼苗期采集花生亲本和RIL家系嫩叶,贮存于-70℃冰箱中。分别将各样品于液氮中研磨,利用植物基因组DNA提取试剂盒(天根)提取DNA,利用0.8%琼脂糖凝胶电泳分析DNA质量、ND-1000分光光度计检测DNA浓度。
1.2.3 SSR分析
SSR引物选自前人已发表的引物序列[10-14],由南京金斯瑞有限公司合成。共筛选到11对多态性SSR引物,引物序列见表5。将多态性引物序列,与栽培种花生参考基因组(https://www.peanutbase.org/)进行BLASTn比对,确定引物的物理位置。利用多态性SSR引物对亲本和RIL家系进行SSR标记基因型分析,母本基因型记作‘0’,父本基因型,记作‘2’。PCR反应体系(10μL):DNA模板1μL,2×Taq PCR Master Mix 5μL,ddH2O 3μL,SSR引物1μL。SSR反应程序:94℃预变性3 min;94℃变性1min,55℃退火1min,72℃延伸90 s,34个循环;72℃延伸10 min。4℃保存。扩增产物在8%非变性PAGE凝胶上分离,硝酸银染色后在医用灯箱上进行带型统计。
1.2.4 花生种子长宽比测定
每个家系和亲本随机挑选20粒成熟种子,利用万深SC-G种子自动考种分析(万深SC-A1型),测定种子长度、种子宽度,利用Excel软件计算长宽比,取平均值。种子长宽比(Ratio of seed length to seed width, SL/SW)=种子长度/种子宽度
1.2.5 数据分析
利用Excel软件对RIL种子长宽比进行次数分布统计,计算相关遗传参数,包括群体平均数、方差、最大值、最小值、变异系数、偏度、峰度等。根据数量性状主基因+多基因混合遗传模型的联合分离分析方法[15-18],对花生种子含油量进行遗传分析,根据最大熵信息准则(Akaike' s information criterion, AIC)最小、适合性检验,包括均匀性检验(U12、U22、U32)、Smimov检验(nW2)和Kolmogorov检验(Dn)、亲本与杂种后代的表现选择最优遗传模型。获得最优遗传模型后,按最小二乘法计算出成分分布参数,由成份分布参数估计遗传参数。利用χ2测验对SSR进行分离比适合性检验。利用IBM SPSS Statistics 19.0软件对标记基因型和种子长宽比表型进行相关性分析。
2 结果与分析
2.1 亲本和RIL群体种子长宽比表型分析
由图1所示,亲本种子形态存在显著差异,母本‘花育36号’的种子长宽比为1.85±0.08,父本‘高油613’的种子长宽比为1.37±0.06(图1A,B)。调查RIL群体在2个环境下种子长宽比性状,结果表明RIL群体存在广泛的变异和超亲现象(表1,图2)。在环境E1(2017,三亚)下,RIL群体种子长宽比变异幅度为1.20~2.19,群体平均值为1.69,偏向高值亲本,变异系数为0.13。在环境E2(2018,莱西)下,RIL群体种子长宽比变异幅度为1.25~2.38,群体平均值为1.82,偏向高值亲本,变异系数为0.14。RIL群体种子长宽比次数分布图表现为连续分布,符合数量性状分布规律,适合进一步开展相关遗传分析。

图1 亲本种子长宽比分析

表1 RIL群体种子长宽比性状变异
注:E1:2017,三亚;E2:2018,莱西。下同。
Note: E1: 2017, Sanya; E2: 2018, Laixi.Same as below.
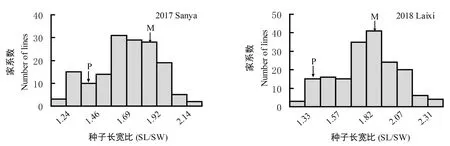
图2 2个环境下RIL家系种子长宽比次数分布

表2 联合分析的遗传模型和相应的AIC值

表3 遗传模型的适合性检验
注:U12、U22、U32:均匀性检验;nW2:Smimov检验;Dn:Kolmogorov检验。
Note:U12,U22,U32, Equality test;nW2, Smimov test;Dn, Kolmogorov test.
2.2 遗传模型分析和相关遗传参数估计
利用主基因+多基因混合遗传模型的多世代联合分析方法[15-18],对2个环境下P1、P2、RIL群体的种子长宽比进行遗传分析。通过程序计算得到1对主基因(A)、2对主基因(B)、多基因(C)、1对主基因+多基因(D)、2对主基因+多基因(E)、3对主基因(F)、3对主基因+多基因(G)、4对主基因+多基因(H)、4对主基因+多基因(I)共9类65个遗传模型的极大对数似然函数值和AIC值。根据AIC值最小原则选择较适宜的4个备选遗传模型。在E1环境下,模型A_1、C_1、C_0、B_1_8为备选遗传模型;在E2环境下,模型A_1、C_1、C_0、B_1_8为备选遗传模型(表2)。
由表3所示,对2个环境下种子长宽比性状的备选模型进行适合性检测。在环境E1(2017,三亚),备选模型A_1有14个统计量达到显著水平,模型C_1、C_0均有12个统计量达到显著水平,模型B_1_8有8个统计量达到显著水平,因此B_1_8为最适模型,即2对存在重叠作用的独立主基因遗传模型;在环境E2(2018,莱西),备选模型A_1、C_1、C_0均有12个统计量达到显著水平,模型B_1_7有10个统计量达到显著水平,因此B_1_7为最适模型,即2对存在互补作用的独立主基因遗传模型。
选定最适遗传模型后,按最小二乘法算出成分分布参数,由成分分布参数估计主基因的遗传率(表4)。结果所示,在环境E1下,种子长宽比满足2对主基因互作效应为-0.19,主基因遗传率89.86%;在环境E2下,种子长宽比满足2对主基因互作效应为-0.22,主基因遗传率为92.04%。
2.3 种子长宽比性状相关SSR标记筛选
利用前人已报道的SSR标记对亲本‘花育36号’和‘高油613’进行多态性分析,筛选到11对多态性SSR标记,且能对181个RIL家系成功分型(表5)。将RIL家系中各SSR标记基因型(0,2)与种子长宽比进行关联分析,发现只有1个SSR(即AGGS1325)在2个环境下均与种子长宽比呈显著性负相关,即基因型为‘0’型,种子长宽比较大;‘2’型,种子长宽比较小,相关系数分别为-0.396(E1)和-0.244(E2)(图3,表7)。卡方测验表明该标记在RIL群体中分离比符合1:1,不存在偏分离现象(表6)。对RIL群体中,不同AGGS1325基因型个体,种子长宽比存在显著性差异,‘花育36号’基因型促进种子长宽比增加(图4)。以上结果表明,标记AGGS1325区段可能存在控制种子长宽比基因。
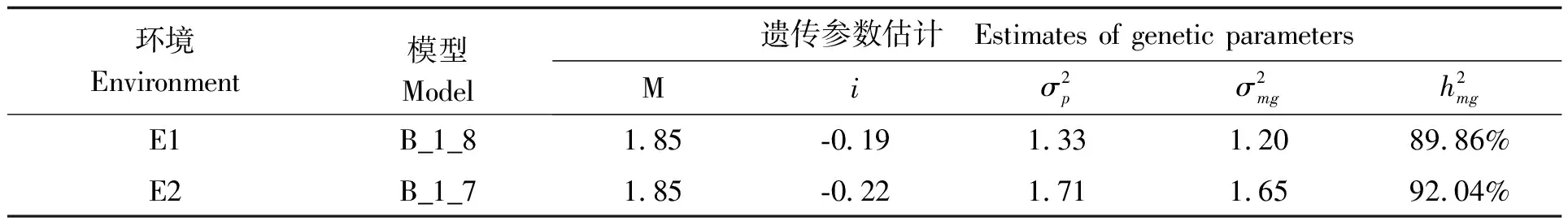
表4 种子长宽比遗传参数估计



表5 用于种子长宽比相关分析的多态性SSR标记
3 讨 论
本试验所使用的‘花育36号’种子较长,‘高油613’种子表现为短圆,在种子长宽比性状上存在显著差异;RIL家系性状表现为连续分布,且存在广泛的超亲现象,为相关性状的遗传分析和后续QTL/基因的定位奠定了材料基础。数量性状主基因+多基因混合遗传模型分析方法,在不同植物、不同性状、不同世代的遗传分析中得到广泛应用[19-22]。目前很少有对种子长宽比性状进行遗传分析报道,本研究通过主基因+多基因混合遗传模型分析,发现在2个环境下种子长宽比性状均满足2对主基因遗传,且主基因具有较高遗传率,但主基因间相互作用不同(表3,表4)。表明种子长宽比性状选择,适宜在世代早期进行。前人报道多数产量性状受多基因控制[23-25],与本研究结果不同,原因可能是所用试验材料基因型与前人不同,导致性状调控机制不同;或是本试验中多基因的遗传效应太小,无法有效检测所致。因此在育种过程中,应根据特定的试验材料,采用相应的育种方法进行遗传改良,从而达到育种目标。

图3 SSR标记AGGS1325分析亲本和RIL家系基因型

表6 AGGS1325标记分离比的χ2测验

表7 AGGS1325基因型和种子长宽比相关性分析
注:** 表示在 0.01 水平上显著相关。
Note: ** represents significant level atp<0.01.
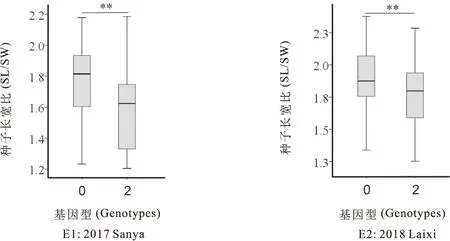
图4 AGGS1325不同基因型对应种子长宽比差异箱型图
本研究检测到位于A03染色体上的SSR标记AGGS1325与种子长宽比存在显著性相关(表7),且该标记不同基因型的RIL家系与种子长宽比存在显著差异(图4),表明该标记附近存在控制花生种子长宽比的QTL/基因,且‘高油613’在该位点的基因型对表型起增效作用。Chen等[9]利用‘富川大花生’和‘ICG6375’杂交构建的RIL群体,检测到9个控制种子长宽比的QTL,遗传贡献率为5.5%~11.8%,其中1个位于A03染色体。由于缺少共有SSR标记,目前无法确定此位点是否与本研究中相关位点一致,仍需要对相关位点进行定位分析。本研究通过对一个RIL种子长宽比性状遗传分析和相关SSR标记挖掘,不仅为后续花生相关性状的QTL/基因定位奠定了理论基础,同时为培育理想粒型花生品种提供了潜在分子标记。
