食管癌患者中牙龈卟啉单胞菌fimA基因的检出率和基因型分布
2020-01-07袁林超李智涛詹煜慧高社干
袁林超,李智涛,詹煜慧,教 杨,高社干,2
牙龈卟啉单胞菌(Porphyromonasgingivalis)是慢性牙周炎最主要的致病菌之一[1],并与许多消化道肿瘤存在相关性,如口腔癌、食管癌、胰腺癌和胃肠癌等[2]。牙龈卟啉单胞菌可产生多种致病因子,如荚膜、菌毛、牙龈蛋白酶、脂多糖、外膜蛋白等[3]。其中菌毛蛋白主要由fimA基因编码,根据基因开放阅读框架核苷酸序列的差异,fimA基因可分为6型(Ⅰ、Ⅰb、Ⅱ、Ⅲ、Ⅳ、Ⅴ)[4]。
fimA基因具有高度的异质性,不同的fimA基因型不仅编码的菌毛结构特征不同,其生物学性质和毒力特性也存在较大差异[5-6]。多数的研究表明,fimAⅡ型与Ⅰ型相比具有更强的致病性。fimAⅡ型在牙周炎患者中检出率最高,被认为是高毒力的疾病相关性菌株;而fimAⅠ型主要分布于牙周健康者中,被认为是低毒力的非疾病相关性菌株[7]。在小鼠模型中,fimAⅡ型菌毛对上皮细胞的黏附和侵袭能力最强,且Ⅱ型菌毛对上皮细胞α5β1整联蛋白的结合能力更大[8]。但也有研究表明不同fimA基因型的细菌对宿主细胞的黏附和侵袭能力并无差异[9-10]。
本研究拟通过比较牙龈卟啉单胞菌fimA基因型在食管癌患者和牙周健康人群中的分布,观察在两组人群中fimA基因检出率及不同基因型分布是否存在差异,为食管癌的诊断、治疗及预防提供依据。
1 材料与方法
1.1 主要试剂和仪器一次性DNA采集包(深圳华晨阳),DNA裂解液(亚能生物),台式高速冷冻离心机(湖南湘仪),恒温金属浴(杭州博日),2×Taq Plus Master Mix(Dye Plus)(南京诺唯赞),PCR扩增仪(北京百泰克),水平电泳仪(北京六一),凝胶成像分析系统(美国Bio-Rad),DNA测序仪(美国ABI)。
1.2 研究对象食管癌组:选取2018年9月至12月期间在河南科技大学第一附属医院胸外科和肿瘤内科住院治疗的患者74例,所有患者经病理切片确诊为食管癌;牙周健康组:选取河南科技大学在校学生135例,均身体健康,无系统性疾病,口腔卫生状况良好。所有研究对象均知情同意。
1.3 标本的采集及 DNA 的提取
1.3.1 口腔内细菌标本的采集使用一次性DNA采集包,采集前先漱口去除口腔内的食物残渣,用采样拭子在口腔脸颊内侧牙齿与牙龈交界处上、下、左、右每处刮拭5次左右,放入含1 mL保存液的采样管内,完成采样,4 ℃保存。
1.3.2 细菌基因组DNA的提取将含口腔拭子的1 mL保存液震荡混匀并转移至1.5 mL无菌EP管中;13 000 r·min-1离心10 min,弃去上清,沉淀物中加DNA裂解液50 μL,震荡混匀,至恒温金属浴中100 ℃温浴10 min,13 000 r·min-1离心10 min,取上清(内含细菌基因组DNA)2 μL作为PCR扩增模板。
1.4 PCR 扩增反应利用PCR试剂盒对fimA基因进行扩增,扩增体系为:2×Mix 12.5 μL、上游引物0.8 μL(5 μM)、下游引物0.8 μL(5 μM)、模板2 μL、双蒸水补至总体积25 μL。PCR循环参数:94 ℃预变性5 min;94 ℃变性30 s, 58 ℃退火30 s,72 ℃延伸90 s(共35个循环);72 ℃终延伸10 min。fimA基因各型引物根据其标准菌株自行设计,具体序列见表1,各型标准菌株为:Ⅰ型:ATCC33277(D17795.1);Ⅰb 型:HG1691(AB058848.1);Ⅱ 型:HW24D1(D17797.1);Ⅲ 型:6/26(D17801.1);Ⅳ 型:HG564(D17802.1);Ⅴ 型: HNA99(AB027294.1)[11]。

表1 牙龈卟啉单胞菌fimA Ⅰ~Ⅴ型和Ⅰb型引物序列
1.5 PCR扩增产物检测和序列测定将PCR产物用琼脂糖凝胶电泳进行鉴定,统计fimA基因阳性例数。将fimA基因阳性标本送上海生工生物技术有限公司进行测序,采用DNASanger测序技术,由于6种fimA基因型片段长度在1 132~1 169 bp之间,均>800 bp。采用正、反双向测序后进行拼接得到完整核苷酸序列。
1.6fimA基因分型及同源性分析将测序结果与fimA各型标准菌株DNA序列用Clustal X软件进行聚类分析,统计fimA各基因型例数。通过观察聚类分析图谱,并比较各型菌株间DNA序列,对fimA基因同源性进行分析。
1.7 统计学分析用SPSS 20.0软件进行统计学分析,计数资料用例(%)表示,组间的比较用χ2检验,检验水准P<0.05。
2 结果
2.1fimA基因扩增结果经PCR扩增fimA基因在74例食管癌患者中阳性52例(70.27%);135例牙周健康人群中阳性56例(41.48%)。食管癌患者组fimA基因检出率明显高于牙周健康组 (P<0.01),差异有统计学意义。
2.2fimA基因测序结果食管癌组fimA基因测序成功49例(3例测序失败),牙周健康组fimA基因测序成功53例(3例测序失败)。测序失败样本均为PCR扩增结果显示条带极弱标本。
2.3fimA基因分型结果经统计学分析,两组人群fimA基因各型别之间分布差异无统计学意义(P=0.59)。fimA基因型在两组人群中的分布特征为:均以fimAⅡ型占比最高,其次为Ⅰb型和Ⅲ型,Ⅰ型、Ⅳ型和Ⅴ型较低(3种基因型总和占比<15%)。食管癌组和牙周健康组聚类分析结果见图1-2。两组人群fimA各基因型分布情况见表2。
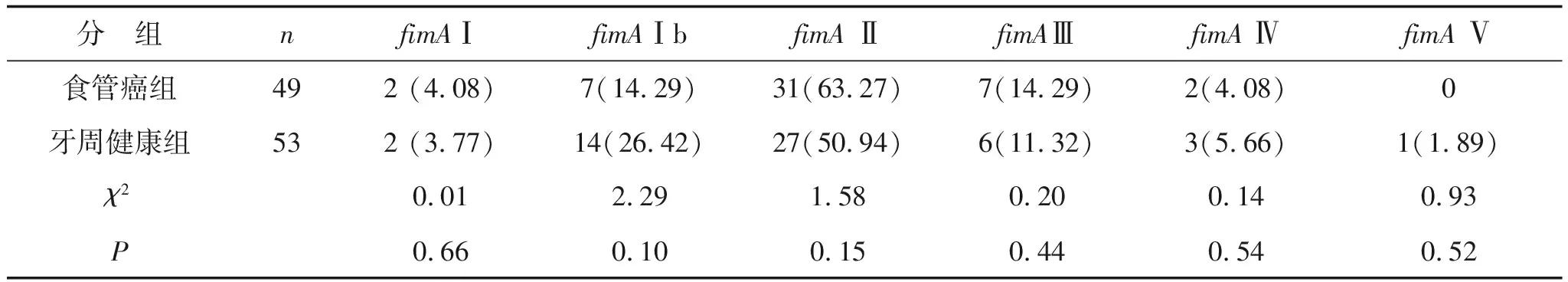
表2 食管癌组和牙周健康组fimA基因基因型分布 例(%)
注:χ2=3.74,P=0.59。
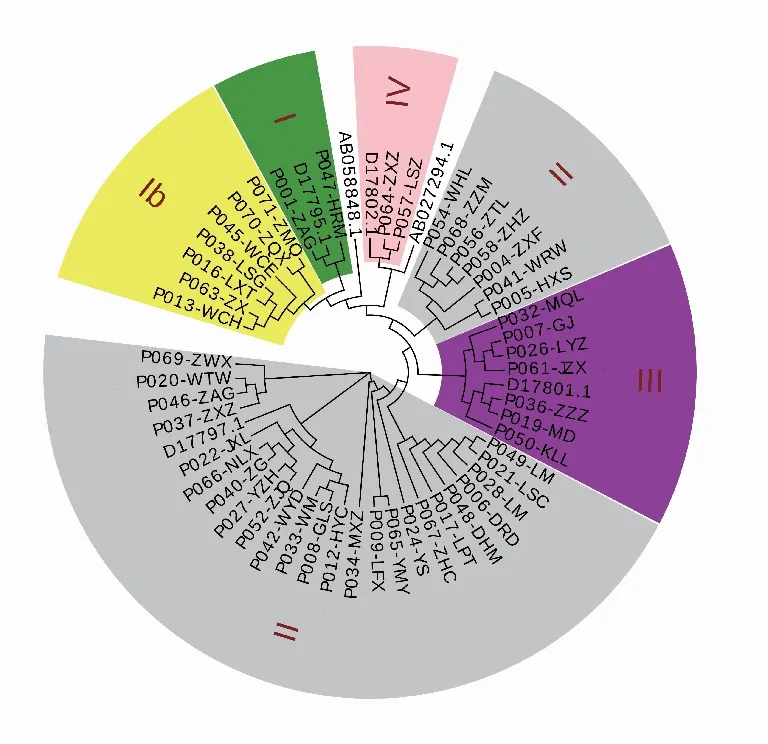
图1 食管癌组聚类分析结果
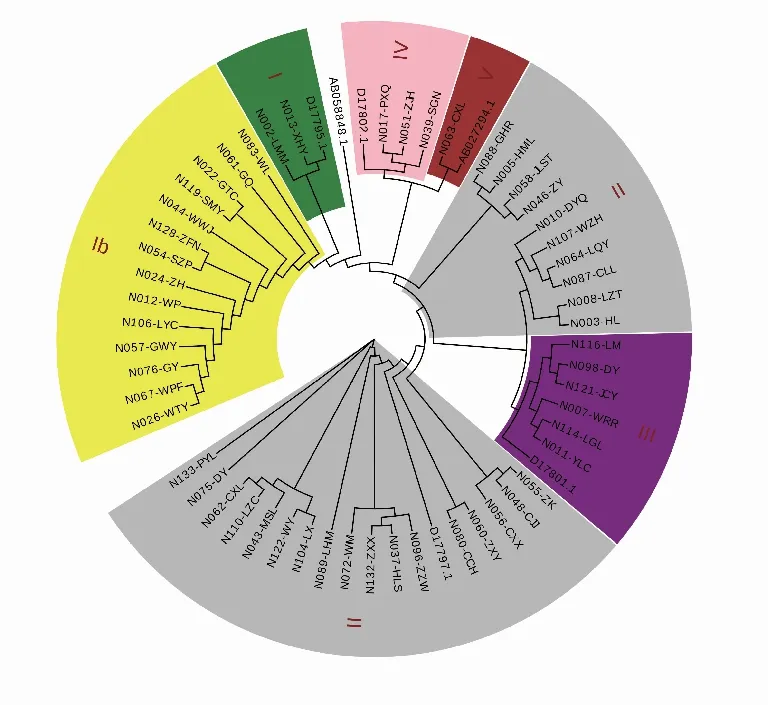
图2 牙周健康组聚类分析结果
2.4fimA基因同源性分析fimA基因同源性分布为:fimAⅠ型和Ⅰb 型两种基因型同源性较近,几乎处于同一分支;fimAⅡ型在树状图上呈现两个不同的亚组,且两组之间同源性相差较大;Ⅲ型、Ⅳ型基因型比较稳定。
3 讨论
关于牙龈卟啉单胞菌与食管癌之间的相关性,高社干等学者通过一系列相关研究表明牙龈卟啉单胞菌感染与食管鳞状细胞癌的分化、淋巴结转移和TNM分期呈正相关,与患者的预后和生存率呈负相关,并且其相关抗体能够作为诊断食管癌的生物学标志物[12-13]。牙龈卟啉单胞菌作为食管癌致病的潜在病原体之一,研究其相关致病因子与食管癌之间的关系具有重要意义。
口腔是牙龈卟啉单胞菌最主要的定植部位,与其感染相关的其他部位的细菌也大多来源于口腔。唐路等同时对颈动脉粥样硬化患者斑块中和龈下菌斑fimA各基因型进行检测,发现斑块中fimA各基因型的检出率与龈下菌斑一致[14],提示颈动脉粥样硬化斑块中的牙龈卟啉单胞菌来源可能与牙周感染相关。对于食管来说,有研究表明食管菌群与口腔菌群构成模式相似[15],且食管黏膜与口腔黏膜在组织学上相似,在解剖学上相连续,每天吞咽大量唾液可将细菌带入食管。因此检测口腔内的牙龈卟啉单胞菌感染对研究食管相关疾病具有重要价值。
分析牙龈卟啉单胞菌fimA基因及不同分型在食管癌患者和牙周健康人群之间分布是否存在差异,对研究fimA基因在食管癌致病中的作用具有重要价值。本研究结果中,口腔内fimA基因在食管癌患者中阳性率为70.27%,牙周健康人群中阳性率为41.48%,食管癌组检出率明显高于牙周健康组(P<0.05)。由于食管癌患者发病年龄较大,本研究对照人群为大学生,结果是否受年龄影响并不清楚,以后将对年龄进行匹配做进一步研究。
关于牙龈卟啉单胞菌分布与年龄的相关性,有研究显示牙龈卟啉单胞菌检出率与年龄存在正相关。也有研究结果显示牙龈卟啉单胞菌检出率在青少年、成人、老年人之间无差异[16]。fimA基因分型结果显示,不同基因型在牙周健康人群和食管癌患者之间的分布无明显差异(P=0.59),分析原因可能由于本研究检测标本例数偏少,食管癌组与牙周健康组fimAⅠb(P=0.10)和fimAⅡ(P=0.15)型之间有差异,P值接近0.05,增加标本例数可能会得到有统计学意义的显著差异。也有可能fimA基因编码的菌毛作为细菌的表面结构,其主要功能是参与对组织细胞的黏附及定植,而牙龈卟啉单胞菌还可以通过其他致病因子诱导致癌物质产生或通过改变肿瘤微环境促进肿瘤的发生[17],而fimA基因只是食管癌发生的促进因素之一。后续实验中作者将对不同fimA基因型进行克隆、表达,进一步研究其蛋白结构和抗体在食管癌患者中与牙周健康人群相比是否存在差异,探讨fimA基因在食管癌患者中的致病机理。
本研究中共有有效测序102例标本,结果均为单基因型。而与以往报道中fimA基因分型存在同一标本呈多基因型复合感染的现象不一致[18-19]。原因可能与检测方法相关,其他研究者大都采用PCR扩增,随后根据电泳图谱分型。根据Nakagawa I的报道:fimAⅠ型、Ⅰb型、Ⅱ型核苷酸序列之间高度同源,Ⅰb 型与Ⅰ型同源性为97.1%,Ⅰb 型与Ⅱ型同源性为77.5%,它们之间极易发生交叉反应[20]。本实验通过对fimA基因全长测序后进行分型,结果更可信。另外,本实验中fimAⅡ型同源性分析存在两个不同的亚组,两者之间同源性相差较大,处于聚类分析图谱的不同位置。在Nagano K的研究中fimAⅡ型也呈现两个亚组,并且Ⅲ、Ⅳ型其组内也有亚组出现,但它们之间同源性相差较小[21]。fimAⅡ型存在两个不同的亚组说明组内基因差异较大,但两个亚组之间的致病性是否也存在差异有待进一步研究。
本研究仅对牙龈卟啉单胞菌fimA基因与食管癌的相关性做了初步的分析,关于牙龈卟啉单胞菌在食管癌致病中的作用还需更深入的研究。
