肺磨玻璃结节的CT 影像特征与病理分类的对照分析研究
2020-01-07任开明赵俊刚林爱军马全美周兆丽鲁继斌
任开明,赵俊刚,林爱军,马全美,周兆丽,鲁继斌
(1.中国医科大学附属盛京医院,辽宁 沈阳 110004;2.上海健康医学院,上海 201318)
随着多层螺旋CT 的广泛应用以及人们健康体检意识的提高,肺内磨玻璃结节(Ground-glass nodule,GGN)的检出率越来越高。肺内GGN 在高分辨率CT(High-resolution computed tomography,HRCT)上表现为密度轻度增加,呈局灶性云雾状密度阴影,其内的支气管及血管纹理仍可显示[1]。依据其是否含有实质成分可分为纯GGN(Pure GGN,pGGN)和混合性GGN(Mixed GGN,mGGN)。GGN 的病理表现分为良性病变和肿瘤性病变[2]。良性病变包括炎症反应、肉芽肿、肺纤维化等。肿瘤性病变包括不典型腺瘤样增生(AAH)、原位腺癌(AIS)以及微浸润腺癌(MIA)和浸润性腺癌(IAC)。根据2011 年国际肺癌研究学会(IASLC)、美国胸科学会(ATS)和欧洲呼吸学会(ERS)联合发表的关于肺腺癌国际多学科分类的新观点[3-5]:浸润前病变即AAH 和AIS 的5 年无病生存率为100%,MIA 的5 年无病生存率接近100%,但IAC 的5 年无病生存率则明显较低。因此,通过影像学特征及时准确的识别出肿瘤性GGN 的病理阶段,能够很好的指导临床医生选择手术治疗策略,给予患者最合适的治疗方案,以获得最佳的预后和生活质量。本研究回顾性分析GGN 患者影像学特征与临床、病理表现的关系,旨在提高对GGN 不同病理阶段诊断的准确性,为临床医生提供更多有价值的信息。
1 资料与方法
1.1 病例资料
回顾性纳入2017 年1 月—2018 年12 月于中国医科大学附属盛京医院胸外科行手术切除的HRCT 表现为GGN 的患者共116 例。纳入条件:①患者的HRCT 检查呈现单发GGN 表现,且最大直径≤3.0 cm;②患者无原发肿瘤病史,扫描于术前2周内进行;③切除病灶均经术后病理证实为肺腺癌。
1.2 方法
1.2.1 GGN 的影像学评价
HRCT 检查使用Philips Brilliance ICT 256 层螺旋CT 机,扫描范围从肺尖至肋膈角下水平。扫描参数:管电压120 kV,管电流使用自动毫安数,扫描层厚1 mm,矩阵512×512。所得图像通过PACS 系统从肺窗和纵隔窗观察,由两位高年资胸部放射科医师分别对结节形态进行独立评估。结节形态包括:①大小:GGN 大小取结节最大横截面长径;②密度:选取GGN 横断位的最大层面,避开血管、支气管和实性成分,在不同处画取3 个尽可能大的感兴趣区,分别测量CT 值,取平均数;③GGN 的形态特征:分叶征、毛刺征、空泡征、胸膜牵拉征、血管集束征和空气支气管征。
1.2.2 手术和病理评价
所有患者的手术均为R0 切除(即病变切除后局部无肿瘤残留)。根据2011 年IASLC、ATS 和ERS联合发表的多学科肺腺癌分类标准,由两名肺癌亚专业病理学医师进行检查诊断。具体病理诊断标准[3]:①AAH:病灶上皮细胞轻、中度不典型增生,无间质性炎性反应和纤维增生;②AIS:病灶直径≤3.0 cm,肿瘤细胞沿肺泡壁伏壁式生长,无间质、血管或胸膜浸润;③MIA:病灶直径≤3.0 cm,有浸润,但范围≤0.5 cm;④IAC:病变直径≤3.0 cm,浸润范围>0.5 cm。
1.3 统计学方法
采用SPSS 17.0 统计软件。计量资料采用均数±标准差()表示,计量资料统计采用方差分析,计数资料统计采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 患者的一般资料分析
共纳入116 例HRCT 表现为GGN 的手术患者,统计结果见表1。其中女性90 例(占77.6%),比例明显高于男性。发病年龄<65 岁的患者比例达到73.3%,提示GGN 患者的发病年龄有年轻化的特点。其中有肿瘤家族史的患者占18.1%,提示该类型肺癌和肿瘤家族史可能有一定关系。有吸烟史的患者仅占11.2%,且主要为男性患者。最常用的肺癌肿瘤标记物CEA、NSE、CYFRA21-1 升高的比例都较低,考虑为入组的病例均为早期肺癌的原因。结节的发生部位以右肺上叶最常见,占33.6%,其次是左肺上叶,其余肺叶比例较少。本研究入组的病例中pGGN 占44%,而mGGN 比例稍高。所有患者均为IA 期以内的腺癌,病理分类分别为AAH 16 例(13.8%)(图1)、AIS 25 例(21.6%)(图2)、MIA 33 例(28.4%)(图3)、IAC 42 例(36.2%)(图4)。

表1 患者临床、病理、影像学特征统计(n=116)
2.2 影像学特征比较
116 例GGN 患者HRCT 征象的统计分析结果见表2。统计结果显示GGN 的大小在3 组之间的比较均具有显著差异(P<0.01)。毛刺征、分叶征在3 组之间的比较均具有显著差异(P<0.01)。胸膜牵拉征在浸润前组和MIA 组之间比较无显著差异,但在浸润前组、MIA 组与IAC 组间比较有显著差异(P<0.01)。血管集束征在MIA 组与IAC 组间比较无显著差异,但MIA 组、IAC 组与浸润前组间比较均有显著差异(P<0.01)。GGN 的空泡征、空气支气管征和病变密度在各组间比较的差异均无统计学意义(P>0.05)。

表2 不同病理类型GGN 的HRCT 征象比较

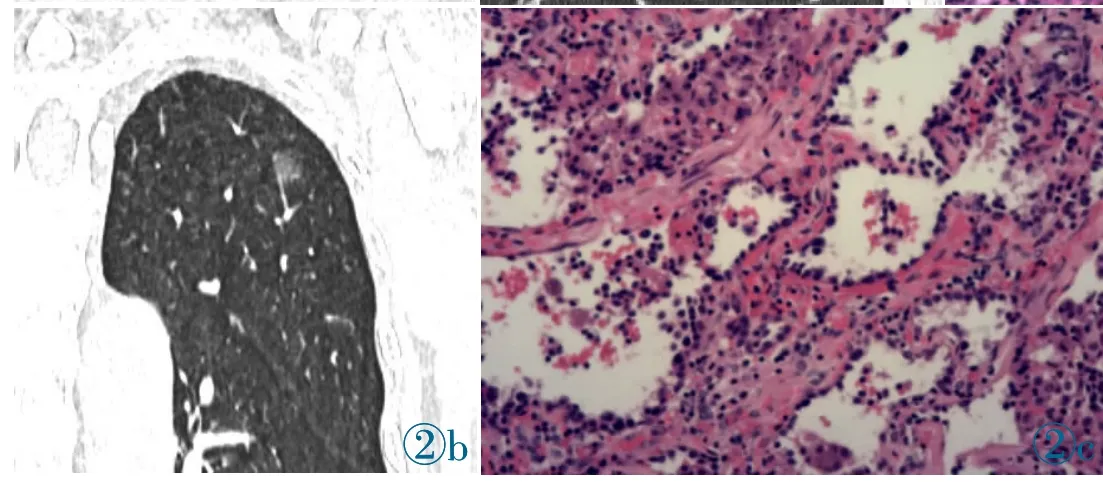
图1 左肺上叶尖后段pGGN,最大直径6 mm,平均CT 值-576 HU,结节界面稍模糊,无分叶及胸膜牵拉征,行左肺上叶尖后段切除,术后病理诊断为AAH。图2 左肺上叶尖后段pGGN,最大直径9 mm,平均CT 值-526 HU,有微血管穿行,走行正常,行左肺上叶尖后段切除,术后病理诊断为AIS。Figure 1.pGGN in the apicoposterior segment of the upper lobe tip of the left lung,with a maximum diameter of 6 mm and an average CT value of -576 HU.The nodule interface was slightly fuzzy,without lobulation and pleural stretch sign.Right upper lobe tip apicoposterior segment was resected,and postoperative pathological diagnosis was AAH.Figure 2.pGGN in the apicoposterior segment of the upper lobe tip of the left lung,with a maximum diameter of 9 mm and an average CT value of -526 HU.There were microvessels traveling through the nodules,which were normal.The apicoposterior segment of the upper lobe of the left lung was resected,and postoperative pathological diagnosis was AIS.
3 讨论
随着多层螺旋CT 的广泛应用以及人们健康体检意识的提高,肺内GGN 的检出率越来越高。GGN的病理表现可为良性病变和肿瘤性病变。其中肿瘤性病变包括AAH、AIS、MIA 和IAC,其发展过程可能是一个连续而缓慢的过程,且术前不容易区分具体的病理阶段,这给临床医生带来很大的困扰,导致可能的过度治疗或延误治疗,同时也给患者带来沉重的心理负担和经济负担[6]。尽管2017 年Fleischner协会发表了GGN 管理指南,为临床医生提供了GGN 的处理建议[7],但在随访的过程中仍然需要影像科医生和临床医生根据CT 影像对GGN 的病理阶段做出准确的判断,对于初次发现的GGN 更是面临同样的问题。因此,通过影像学特征及时准确的识别出肿瘤性GGN 的病理阶段能够很好的指导临床医生选择手术治疗策略,给予患者最合适的治疗方案,以获得最佳的预后和生活质量。


图3 右肺上叶mGGN,最大直径15mm,平均CT 值-510 HU,可见胸膜牵拉征和血管集束征,行右肺上叶切除,术后病理诊断为MIA。图4 左肺上叶mGGN,最大直径25 mm,平均CT值-421 HU,可见毛刺、分叶以及空气支气管征和血管集束征,行左肺上叶切除,术后病理诊断为IAC。Figure 3.mGGN in the upper lobe of the right lung,with a maximum diameter of 15 mm and an average CT value of -510 HU,with pleural stretch and vascular cluster signs visible.Right upper lobe resection was resected,and postoperative pathological diagnosis was MIA.Figure 4.mGGN in the upper lobe of the left lung,with a maximum diameter of 25 mm and an average CT value of -421 HU.Burrs and lobes,as well as air bronchogram and vascular cluster were observed.Left superior lobe resection was performed,and postoperative pathological diagnosis was IAC.
GGN 的大小和密度是其基本的属性,有学者研究认为这两个指标可以用来预测GGN 病变的性质和发展趋势[8-10]。本研究结果显示:随着GGN 病变恶性程度的增高,其病变的大小也随着增加,3 组之间的差异具有显著的统计学意义。因此,本研究认为GGN 的大小是预测病变恶性程度的一个重要指标,尤其是在GGN 的随访过程中,应该密切关注这个指标,以帮助准确判断病变的性质。随着GGN 病变恶性程度的增高,其密度一般也随之增高,但本研究统计结果显示3 组之间比较无显著差异,考虑与本研究对象没有区分pGGN 和mGGN 有关,尤其是对mGGN 的密度测量仍有差异。对于pGGN 病变,有学者认为结节密度有助区分其恶性程度[11]。而对于mGGN 病变,有研究显示其实性成分的大小和实性成分面积占比总面积这两个指标更有助于判断病变的恶性程度[12-13]。但对于实性成分的测量目前仍存在较多争议,尚无统一认可的方法,因此本研究未做相关的统计分析。
毛刺征、分叶征和胸膜牵拉征是肺癌常见的CT影像特征,我们将之用于判断GGN 这种早期肿瘤病变中,结果显示毛刺征和分叶征在浸润前组、MIA组和IAC 组之间的差异有统计学意义,表明这两个影像征象对于判断GGN 病变的浸润程度和发展阶段具有很高的价值。而胸膜牵拉征对于判断GGN 的浸润性和发展程度则有不同观点[8,14]。本研究显示胸膜牵拉征在浸润前组和MIA 组间比较无差异,而这两组分别与IAC 组间比较则有显著差异,表明胸膜牵拉征在浸润轻的病变阶段中不明显,而在浸润较重的病变阶段中更多的出现,因此有助于判断病变是否达到IAC 的阶段。
血管集束征是指有单支及以上血管进入GGN病灶,且病灶血管段走行扭曲、僵直、截断[15]。其形成的机制尚不明确,可能为肿瘤细胞产生的生长因子诱发新生血管形成,并使其代偿性增粗,肿瘤细胞的浸润生长,刺激纤维成分的增加,导致血管走行扭曲、僵直,甚至瘤栓形成。因此,血管集束征能够反映GGN 病变的侵袭性,本研究显示MIA 组、IAC 组均明显高于浸润前组,差异具有统计学意义,但在MIA 组和IAC 组之间比较无显著差异,有助于判别浸润前病变和浸润性病变。病变内部的征象还包括空泡征和支气管充气征。空泡征指GGN 结节内出现小圆形空泡。支气管充气征指CT 肺窗显示含有气体的细支气管横贯GGN 结节的征象。本研究显示空泡征和支气管充气征在不同组间比较并无显著差异。
本研究存在一定局限性:首先这是一项回顾性研究,入组的患者较少,且均为手术患者,因此会存在选择性偏倚。其次,由于观察者不同,对病灶大小、密度的测量以及对病变特征的评估存在一定差异。
综上所述,尽管GGN 的影像诊断仍有一定难度,但通过综合分析病灶大小、密度、分叶征、毛刺征、胸膜牵拉征、血管集束征等影像学特征,能够早期对肿瘤性GGN 病变的病理阶段做出评估,为临床医生制定合适的治疗方案提供重要的依据。
