甘蓝型油菜开花时间的遗传分析及相关分子标记
2020-01-07张冰冰秦梦凡梁峰豪左凯峰徐爱遐
张冰冰,刘 霞,秦梦凡,梁峰豪,张 燕,左凯峰, 郭 娜,马 宁,黄 镇,徐爱遐
(1.西北农林科技大学 农学院,陕西 杨凌 712100;2.吴忠市盐池县市场监督管理局,宁夏 吴忠 751100)
甘蓝型油菜开花时间与其成熟早晚密切相关,同时也是影响油菜产量与品质的重要因素。开花时间既是数量性状,又是复合性状,受遗传、栽培条件与环境的共同影响,导致开花时间的遗传研究相对滞后[1]。深入研究甘蓝型油菜开花时间遗传规律,对选育甘蓝型油菜早熟品种具有重要理论和实践意义。目前,有关油菜开花期遗传模型的研究,一直受到国内外学者的普遍关注。郭志刚[2]发现,油菜开花主要受多基因调控,但存在主基因加显性效应,蔡长春[3]认为,开花期主要由2对或2对以上主基因及多基因控制,罗玉秀等[4]认为,开花期受2对加性基因控制。不同研究者的研究结果不尽一致,试验材料不同可能是导致结果不一致的主要原因。甘蓝型油菜72-27-1-2(P2)具有早花、早熟等优良特性,为明确其早花性状的遗传,以晚开花甘蓝型油菜YG-1(P1)与其杂交构建6世代遗传群体(P1、P2、F1、B1、B2和F2),应用数量性状主基因+多基因混合遗传模型联合分析法对开花时间进行遗传分析,研究结果可进一步明确甘蓝型油菜开花时间的遗传规律,指导早熟品种选育。
分子标记辅助育种是利用分子标记与决定目标性状基因紧密连锁的特点,通过检测分子标记,即可检测到目的基因的存在,具有快速、准确、不受环境条件干扰的优点。SSR分子标记技术由于其操作简单方便、要求不高等优点,是目前最常用的微卫星标记之一。近年来,已有学者在甘蓝型油菜中利用分子标记技术进行了大量关于开花相关基因QTL定位的研究。石鹏[5]检测到28个开花期 QTLs,解释的表型贡献率介于0.55%~16.33%。Raman等[6]检测到20个控制开花时间的 QTL位点,可解释表型变异的2.4%~28.6%。傅鹰[7]检测到19个开花期QTLs,揭示了2.35%~47.68%的表型变异。柳海东[8]检测到 48个QTLs,解释表型变异的3.2%~46.5%。本研究利用SSR分子标记技术,开发与开花时间相关的分子标记,对油菜开花时间基因的定位及标记辅助育种具有重要意义。
1 材料和方法
1.1 试验材料及性状考查
以晚开花甘蓝型油菜YG-1(P1)与早开花甘蓝型油菜72-27-1-2(P2)及其配制的F1、B1、B2、F2为遗传分析材料,其中YG-1平均开花时间(播种到开花的天数,同d表示)197 d左右,72-27-1-2平均开花时间180 d左右。以F2群体(127个单株)为分子标记筛选群体,上述材料均由西北农林科技大学农学院油菜遗传及分子育种实验室提供。分别于2017年9月18日和9月20日种植于西北农林科技大学三原斗口试验站和杨凌曹新庄试验田,常规栽培管理。2018年4月避开行两端的边株逐株挂牌并记录6世代各单株开花日期。油菜开花标准参考伍晓明等[9]以油菜主茎第一朵花开为标准。
1.2 性状遗传分析
利用Microsoft Excel 2007绘制开花时间次数分布图,SPSS 19.0进行基本统计量、正态性检验及亲本显著性分析。利用SEA 1.0软件进行开花时间遗传分析(软件由华中农业大学植物科技学院章元明教授提供网址:https://cran.r-project.org/web/packages/SEA/index.html)。依据AIC值最小和适合性检验(均匀性、Smirnov和Kolmogorov检验)确定最优遗传模型;最小二乘法进行最优遗传模型遗传参数估算。
1.3 DNA提取及SSR分子标记
在幼苗四-五叶期,取双亲及F2群体单株幼嫩叶片0.5 g,采用改良的CTAB法[10]提取DNA,利用Lab Tech紫外可见分光光度计测定DNA浓度,最终将样品DNA浓度稀释至50 ng/μL使用。
SSR分子标记引物来源于http://ukcrop.net/perl/ace/search/BrassicaDB与http://www.brassica.info/ssr/SSRinfo.htm,均由上海生工试剂公司合成。SSR反应体系:总体积10 μL,包括:DNA模板3.0 μL、引物1.5 μL、10×Buffer 1.0 μL、25 mmol/L MgCl20.8 μL、10 mmol/L dNTPs 0.2 μL、Taq酶0.1 μL、ddH2O 3.4 μL。PCR反应程序设定为:94 ℃预变性5 min;94 ℃ 变性30 s,Tm退火30 s,72 ℃延伸75 s,35个循环;72 ℃再延伸5 min,4 ℃保存。扩增产物利用6%聚丙烯酰胺凝胶电泳,银染程序参考陆光远等[11]的方法。
带型记录依据群体在亲本间具有的差异性条带,清晰的带记为“1”,未出现条带记为“0”,符号“-”表示整体带型缺失或模糊难以判读。选取群体极端早开花20株与极端晚开花20株,参照张发[12]的方法,利用SPASS 19.0对开花时间与分子标记进行相关性分析。
2 结果与分析
2.1 各世代开花时间数据分析
杨凌和三原两地各世代开花时间见表1。结果表明,亲本间开花时间具有明显差异,YG-1(P1)的开花时间明显晚于72-27-1-29(P2),同一环境下双亲间开花时间存在极显著差异,不同环境下同一亲本间无显著性差异;两地F1开花时间平均值均介于双亲之间,且略偏向于早花亲本P2,两地B1、B2和F2世代开花时间的平均值也介于双亲之间;B2群体均有超早亲分离,杨凌B1、F2群体发现超晚亲分离;由表2知:两环境中杨凌点B2、F2群体及三原B1群体的K-S正态检验P值大于0.05,符合正态分布,而其他分离世代P值均小于0.05,但偏度或峰度基本都介于-1与1,呈偏离正态分布,各分离世代中开花时间性状均表现单峰分布(图1,2),表明甘蓝型油菜开花时间遗传可能存在主基因作用并有多基因修饰效应。

表1 各世代开花时间统计及亲本差异显著性检验Tab.1 Performance of flowering time in six generations and significance test of difference between the parents
注:YL.杨凌;SY.三原;表2-4、图1-2同。标以不同字母的数值在0.01水平下差异显著,相同字母的数值在0.01水平下无显著性差异。
Note:YL.Yangling;SY.Sanyuan;The same as Tab.2-4,Fig.1-2.Values followed by different letters are significantly different at the 0.01 probability level, values followed by same letters are not significantly different at the 0.01 probability level.

表2 B1、B2和F2开花时间的统计分布和正态性检验Tab.2 Statistic analysis and normal distribution test for flowering time in B1,B2 and F2 generations
2.2 开花时间主基因+多基因遗传分析
2.2.1 遗传模型分析 利用主基因+多基因混合遗传模型的多世代联合分析方法,以SEA 1.0软件对两地6世代开花时间进行遗传分析,获得5类24种模型。依据AIC数值最小选取准则,选取最小AIC值及与之比较接近的一组共2个模型作为开花时间性状的备选模型(表3)。通过适合性检验(0.05水平)进一步确定比较适合的遗传模型,结果表明:共30个统计量中,杨凌点C-0和E-0模型均有5个统计量有显著性差异(P<0.05),但E-0模型AIC值较小,依据AIC值最小和显著差异个数最少的选取准则,确定杨凌开花时间性状最适遗传模型为E-0(2对加性-显性-上位性主基因+加性-显性-上位性多基因模型)。三原点E-1模型有4个达到显著差异而E-3模型有8个达到显著差异,所以确定三原开花时间性状最适遗传模型为E-1(2对加性-显性-上位性主基因+加性-显性多基因模型)。

图1 杨凌点B1、B2和F2群体开花时间次数分布Fig.1 Frequency distribution of flowering time traits in B1,B2 and F2 populations of Yangling

图2 三原点B1、B2和F2群体开花时间次数分布Fig.2 Frequency distribution of flowering time traits in B1,B2 and F2 populations of Sanyuan
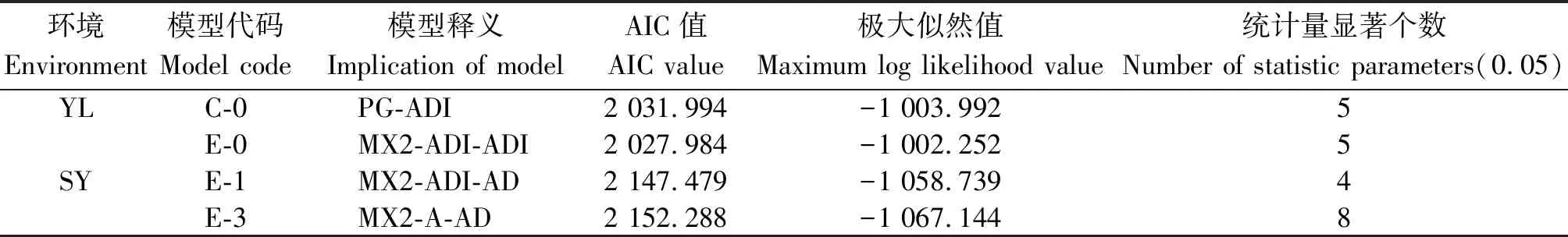
表3 备选模型相关参数Tab.3 Estimates on candidate models
注:MG、PG和MX分别表示主基因、多基因及主基因+多基因模型;A、D和I分别代表加性、显性和上位性效应。
Note:MG,PG and MX represent major gene, polygene and mixed major gene and polygene model;A,D and I represent additive,dominant and epistatic.
2.2.2 最适遗传模型遗传参数估算 按最小二乘法计算出成分分布参数,由成分分布参数估计遗传参数(表4)。由表4知,同一环境下2对主基因加性效应值(|da|=|db|)相等,说明双亲中控制开花的2对主基因加性效应相同,但地区间差异较大,分别为0.68和1.64。两地2对主基因显性效应值均表现|hb|>|ha|,即第2个主基因的显性效应大于第一个主基因的显性效应,显性与加性的比值(|ha/da|和|hb/db|)多大于1,说明控制开花的2对主基因以显性效应为主,结合表1双亲杂交F1开花时间偏向于早花亲本,说明早花性状对晚花性状为部分显性。同时从表4还可以看出,控制开花时间的2对基因存在一定程度的基因互作效应(i、jab、jba和l)。

表4 E-0与E-1模型最适模型遗传参数估计Tab.4 Estimates of genetic parameters under the E-0 and E-1 models



2.3 开花时间分子标记
2.3.1 分子标记筛选 利用507对SSR引物对双亲YG-1和72-27-1-2进行多态性筛选,结果105对引物在双亲间存在多态性,占引物总数的20.7%,部分引物的筛选结果见图3。利用在亲本间存在差异的引物进行F2群体(127个单株)的多态性筛选,在50对引物中重复检测出多态性,多态率为47.6%,获得带型清晰的标记位点54个。图4显示了SSR引物BnGMS148在前60个F2单株中的扩增结果。

图3 部分SSR引物在亲本间扩增的结果Fig.3 The amplification results of SSR primers between two parents

图4 引物BnGMS148在前60个F2单株中的扩增结果Fig.4 The amplification results of the primer BnGMS148 in F2 population with first 60 lines
2.3.2 开花时间与分子标记的相关性分析 对挑选的F2极端类型单株(极端早20株、极端晚20株)的开花时间与54个标记位点进行相关性分析,并将各标记引物序列在甘蓝型油菜数据库进行Blast比对,相关分析结果及引物所在染色体位置见表5,在54个SSR标记位点中,有7个SSR标记位点与开花时间呈显著(P<0.05)或极显著(P<0.01)相关,分别为cnu_m157a、BrgMS351、BnGMS148、BnGMS256-1、BnGMS256-2、BnGMS327及BnGMS370-2,其中,BnGMS256-2、BnGMS327、BnGMS370-23个位点与开花时间呈极显著(P<0.01)相关。通过序列比对,BrgMS351和BnGMS148位于A7上,cnu_m157a、BnGMS256-1、BnGMS256-2、BnGMS327和BnGMS370-2位于A9上。说明本研究中控制开花相关的位点可能位于A7和A9染色体上,且其开花时间可能是由2个QTLs共同控制,与上述数量模型遗传分析开花时间由2对主基因控制结果一致。

表5 F2群体开花时间与SSR 分子标记相关性Tab.5 The correlation between flower time of F2population and SSR molecular markers
3 结论与讨论
前人对植物数量性状的遗传研究,主要采用双亲本杂种或双列杂交的世代杂种优势,运用遗传方差、均值、配合力等分析其性状的整体基因效应,但这些方法其结果仅能分析一组基因的综合效应,并不能分析其单个基因的效应[13]。盖钧镒[14]将混合分布理论与数量遗传相结合,建立了主基因+多基因混合遗传模型,并提出了一套鉴定主基因与多基因存在且量化其效应值的方法,克服传统经典数量遗传方法的缺点。近年已应用到各类作物的不同性状上, 如甘蓝型油菜茎秆强度[15]、株高[16]、分枝角度[17]、角果长度[18]、氮素营养效率[19]、黄瓜节间长[20]、胡麻粗脂肪[21]、高粱株型[22]、小菊分枝[23]等都获得了很好的研究进展。
郭志刚[2]发现,油菜开花主要受多基因调控,但存在主基因加显性效应,蔡长春[3]利用DH群体在和政、武汉和肇庆三点研究认为油菜开花遗传模型为G-1(3对加性-上位性主基因+多基因)和E-1(2对加性-上位性主基因+多基因),即开花时间受2对以上主基因控制,并受多对基因修饰效应,三点主基因遗传率分别为91.13%,63.05%和62.02%,多基因遗传率分别为4.43%,1.58%和22.71%。罗玉秀等[4]应用传统遗传分析方法研究DH群体认为开花期受2对加性基因控制,狭义遗传率(h2G)为0.68。至此,甘蓝型油菜开花时间未见更多报道。随着章元明教授对数量遗传模型软件的不断优化,对分析过程中遗传参数的估算更加精确。本研究应用最新分析软件(更新于2018年5月22日),对6世代群体开花时间进行遗传分析,两地试验结果表明,甘蓝型油菜开花时间适应E-0与E-1模型,即主要受2对主基因控制,主基因遗传率大于相应世代多基因遗传率,表明大田育种中开花时间性状适宜进行早代选择。本研究杨凌点开花时间最适遗传模型E-1与蔡长春[3]研究结果保持一致,两点开花时间受2对主基因控制与罗玉秀等[4]2对主基因研究结果一致,只是加显性效应不同,究其原因可能与试验材料不同有关。这表明不同试验材料,控制油菜开花的基因数目与效应可能不同。
本试验构建了可用于QTL与相关性分析的F2群体,并利用127个单株进行研究,排除了遗传背景不同和群体大小对相关性分析的影响,进行标记与性状之间的相关性分析。而标记与性状的相关性分析是以多态性标记位点与目标数量性状的表型进行分析,若相关性显著或极显著则说明标记与性状存在相关性。所以,若一个群体的性状差异明显,就可以通过标记与性状的相关性找出性状与1个或多个标记的遗传相关性,若存在显著相关,就可以认为存在1个数量性状位点,从而实现表型到基因型的转变[24]。本试验中共关联到7个SSR标记位点与开花时间具有显著或极显著相关。标记引物序列在甘蓝型油菜数据库进行比对,分别位于A7和A9上,这表明本研究材料控制开花相关位点可能位于A7和A9染色体,也说明开花时间可能是由2个QTL共同控制。Butruille等[25]利用冬油菜与春油菜杂交和回交群体,在A2、A3、A7、A8、A9、C2和C5染色体上定位到开花期QTL,Lou等[26]利用IBM211与R500杂交创制的RILs群体,在A2、A3、A7、A9和A10定位到6个QTLs,柳海东[8]利用DH系在5个环境中共检测到48个QTLs与开花时间有关,分别位于染色体A2、A3、A5、A6、A7、A10、C2、C8上,本试验所得的与开花时间相关的遗传标记分别位于A7和A9上,与前人研究结果比较找到的标记较少,其原因可能主要是所用的SSR标记数量较少,进一步深入研究还需扩大群体,采用更多的标记引物,获得更多距离目标基因更近的分子标记或主效QTL。
