饲喂钩虾粉对凡纳滨对虾低盐度胁迫适应性调节的影响❋
2020-01-07耿泽星单洪伟左孝文
耿泽星, 单洪伟, 马 甡, 左孝文, 王 腾
(海水养殖教育部重点实验室(中国海洋大学), 山东 青岛 266003)
凡纳滨对虾(Litopenaeusvannamei)因其生长速度快、可高密度养殖,味道鲜美,且含有丰富的蛋白质而在中国迅速推广。凡纳滨对虾也是全球最主要的甲壳经济品种之一,占甲壳类动物总产量的53%,且其养殖规模及产量在逐年提高[1]。近年来,随着人们对高产量的追求,凡纳滨对虾集约化程度不断提高,引起养殖环境的日趋恶化,致使对虾处于各种环境胁迫之中。环境胁迫往往会引起对虾机体能量供应和利用途径的改变[2]。已有研究表明,盐度的变化会改变凡纳滨对虾的渗透压调节状态,造成对虾调节耗能的增加[3-4],进而影响对虾体内营养物质的消耗及其对营养物质的需求[5]。
通过营养强化可以提高对虾抗环境胁迫能力[6]。Palacios等研究发现,改善营养条件可以提高凡纳滨对虾仔虾在低盐度胁迫下的成活率[7],然而,目前关于营养强化作用机制的研究较少。生物饵料是经过筛选的优质饵料生物,其富含营养物质以及多种活性物质,对虾摄食生物饵料后,能够显著提高对虾免疫力和抗环境胁迫能力[8-10]。藻钩虾属于节肢动物门(Arthropoda)甲壳纲(Crustacea)端足目(Gammarid)钩虾亚目(Gammaridea),多分布于温带和热带海域,并且具有广盐性,个体较大最大可长至28 mm,身体头部前缘圆拱,体光滑且两侧较扁平,眼呈卵圆形,额角不明显,侧叶突出,藻钩虾大多栖息于潮间带或潮下带海藻[11]。藻钩虾是一种优质的生物饵料,饲喂藻钩虾不仅能够提高对虾养成过程中成活率,并且能显著提高对虾抗环境胁迫能力[12-13]。
在对虾养殖过程中,由于降雨、换水或干旱等原因,养殖水体的盐度会发生突变,从而影响对虾的生长及成活率。本研究以凡纳滨对虾为研究对象,以低盐度为胁迫因子,通过分析对虾体内生化指标及呼吸代谢和渗透压调节关键酶活性变化,探究饲料中添加钩虾粉对凡纳滨对虾低盐度胁迫适应性调节的影响。本研究结果将为生物饵料在对虾养殖中的应用及作用机制的研究提供参考资料。
1 材料与方法
1.1 实验饲料的制备
配制3种等氮等能饲料,其中钩虾粉在饲料中比例分别为0%、8.25%和33%(记为D0、D8.25和D33)。饲料制备过程如下:饲料原料经粉碎后过80目筛,采用逐级扩大法混合均匀,随后添加鱼油、卵磷脂,再添加水和氯化胆碱,混匀,压制成粒径为1.0 mm的颗粒饲料,于55 ℃烘干,自然冷却后放入密封袋中,置于-20 ℃冰箱中保存备用。配制成的3种饲料配方及营养成分见表1,饲料中粗蛋白水平约为36.04%,总能约为16.79 MJ/kg。本实验中所使用的钩虾粉制作过程如下:将藻钩虾(购买于山东省潍坊市昌邑县王家庄子村,生长水域盐度35)清洗干净后使用冷冻干燥机进行冻干处理,粉碎后置于-20 ℃冰箱中保存备用。

表1 实验饲料配方(干物质基础)Table 1 Composition of the experimental diets(D.M. basis) /%
1.2 实验设计
1.2.1 营养强化 营养强化在室内水泥池(206 cm×137 cm×97 cm,水体积约为2.25 m3)中进行,每个水泥池放置(753±36)尾凡纳滨对虾(体长(5.32±0.69)cm,体重(1.80±0.72)g),持续48 d,营养强化过程中,每天投喂4餐(6:00、10:00、18:00和22:00),每餐投喂后查看残饵情况,以便调整投喂量。
D0组、D8.25组和D33组分别投喂含钩虾粉为0%、8.25%和33%的实验饲料。营养强化过程中,养殖水质参数如下:DO>6 mg/L,水温(24.7±3.5) ℃,盐度30±0.5,pH 7.65~7.97。
1.2.2 低盐度胁迫 营养强化结束后,对虾停食24 h开始低盐度胁迫实验,胁迫盐度为5,胁迫持续8 d。各组实验用虾规格见表2。低盐度胁迫在泡沫箱中进行(66 cm ×35 cm×27 cm,水体积为50 L),每个泡沫箱为一个平行,放置15尾对虾。每个实验组设置6个平行,其中3个用于取样,3个用于记录死亡率。

表2 各组盐度胁迫实验用虾规格Table 2 The shrimp size used in salinity lstress in different groups
1.3 样品的采集与分析
在低盐度胁迫后的0、6、12、24、48、96和192 h取样,随机从各组中选取3尾对虾,用针管从对虾血窦处按血淋巴与抗凝剂(450 mmol/L NaCl,10 mmol/L KCl,10 mmol/L Na2-EDTA,10 mmol/L HEPES,pH 7.3)[14]体积比为1∶3的比例抽血,抽出的血淋巴立即离心(4 000 r/min,10 min),取上清置于-20℃冰箱内保存待测。取对虾肝胰腺、腮置于-20℃冰箱内保存待测。
实验测定的指标包括甘油三酯(TG)含量、总胆固醇(T-CHO)含量、蛋白质(Protein)含量、葡萄糖(Glu)含量、乳酸(LD)、己糖激酶(HK)活性、果糖-6-磷酸激酶(PFK)活性、乳酸脱氢酶(LDH)活性、琥珀酸脱氢酶(SDH)活性、Na+/K+-ATP酶活性,均使用试剂盒(南京建成)按照说明书完成测定。
1.4 数据处理与分析
实验数据采用spss22.0软件进行单因素方差分析(ANOVA),采用Tukey检验进行组间差异显著性分析,显著水平为0.05,实验结果用平均数±标准差(Mean±SD)表示。
2 实验结果
2.1 低盐度胁迫阶段对虾累积死亡率
低盐度胁迫对虾累积死亡率如图1所示。胁迫期间,D0组出现死亡的时间较D8.25组和D33早,在胁迫6 h出现了死亡,而D8.25组和D33组在12 h出现死亡。在胁迫192 h,D0组对虾累积死亡率最高,达到60%,D8.25组和D33组对虾累积死亡率均为23.33%。胁迫结束时,D8.25组和D33组对虾的累积死亡率较D0组低61.11%。
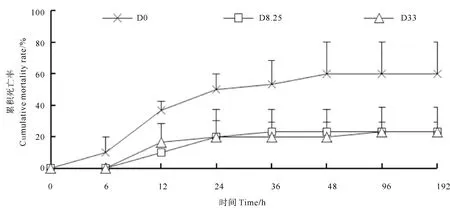
图1 低盐度胁迫阶段各组对虾累计死亡率Fig.1 Cumulative mortality rate of shrimps in different groups at low-salinity stress period
2.2 对虾血淋巴中生化物质水平的变化
各组对虾血淋巴中生化物质水平变化如图2所示。各组对虾血淋巴中蛋白含量随胁迫时间的延长呈现下降趋势,在胁迫96~192 h,D0组下降更加明显,显著低于D8.25组和D33组(P<0.05)(见图2(A))。D8.25组和D33组对虾蛋白含量差异不显著(P>0.05)。
各组对虾血淋巴中葡萄糖含量整体呈现下降趋势,下降速度与钩虾粉的添加量呈负相关(见图2(B))。在胁迫0~12 h,D33组对虾血淋巴中葡萄糖含量显著低于D0组和D8.25组(P<0.05)。在胁迫24~192 h,D33组对虾血淋巴中葡萄糖含量显著高于D0组(P<0.05)。各组对虾血淋巴中乳酸含量在胁迫6 h内急剧下降,然后趋于平稳状态,各组之间无明显差异(见图2(C))。
各组对虾血淋巴中甘油三酯含量随着胁迫时间的延长呈现下降趋势,且D0组下降更明显(见图2(D))。在胁迫0~12 h、48 h,D33组对虾血淋巴中的甘油三酯含量显著低于D0组(P<0.05);在胁迫24 h、96~192 h,D33组与D0组对虾血淋巴中的甘油三酯含量差异不显著(P>0.05);在胁迫6~24 h,D8.25组对虾血淋巴中的甘油三酯含量显著低于D0组(P<0.05);在胁迫48~96 h,D8.25组对虾血淋巴中的甘油三酯含量显著高于D0组(P<0.05)。对虾血淋巴中总胆固醇含量与对虾血淋巴中甘油三酯含量变化趋势类似(图2(E))。

(同一时间点,不同字母表示处理组间存在显著性差异(P<0.05)。At each time-point, means with different letters are significantly different (P<0.05).)
2.3 对虾肝胰腺中生化物质水平的变化
各组对虾肝胰腺中生化物质水平变化如图3所示。各组对虾肝胰腺中蛋白含量呈现缓慢下降趋势,且肝胰腺中蛋白质含量为D33组>D8.25组>D0组(见图3(A))。在胁迫6、12、48和96 h后,D33组对虾肝胰腺中蛋白质含量显著高于D0组和D8.25组(P<0.05)。在胁迫6和48 h后,D8.25组对虾肝胰腺中蛋白质含量显著高于D0组(P<0.05)。
各组对虾肝胰腺中乳酸含量在胁迫6 h内时急剧上升(见图3(B))。在胁迫24 h后, D0组和D8.25组对虾肝胰腺乳酸含量急剧下降且处于较低水平,而D33组对虾肝胰腺乳酸含量依然处于较高水平,且显著高于D0组和D8.25组(P<0.05),而D8.25组对虾肝胰腺中乳酸含量的变化趋势与D0组类似且无显著性差异(P>0.05)。
在胁迫0~12 h,D33组对虾肝胰腺中甘油三酯含量显著低于D0组(P<0.05)(见图3(C))。然而,在胁迫24、48和192 h,D33组对虾肝胰腺中甘油三酯含量与D0组无显著性差异(P>0.05)。胁迫24~192 h,D8.25组对虾肝胰腺中甘油三酯含量显著高于D0组(P<0.05)。整体上,D33组对虾肝胰腺中总胆固醇含量显著低于D0组和D8.25组(P<0.05)(见图3(D))。
2.4 对虾肝胰腺中呼吸代谢关键酶的变化
各组对虾肝胰腺中呼吸代谢关键酶的变化如图4所示。各组对虾肝胰腺中己糖激酶活性呈现出缓慢升高,然后再缓慢下降的趋势(见图4(A))。在胁迫0 和24 h,D33组对虾肝胰腺中己糖激酶活性显著高于D0组(P<0.05)。在胁迫12和48 h,D8.25组对虾肝胰腺中己糖激酶活性显著高于D0组(P<0.05)。
各组对虾肝胰腺中磷酸果糖激酶活性随胁迫时间的延长呈现上升趋势(见图4(B))。在胁迫前期,D8.25组和D33组上升更加明显,在12 h达到峰值后维持在稳定水平,而D0组在48 h达到峰值,随后呈现下降趋势。在胁迫96~192 h,D8.25组和D33组对虾肝胰腺中磷酸果糖激酶活性显著高于D0组(P<0.05)。
D8.25组和D33组对虾肝胰腺中乳酸脱氢酶活性在6 h出现急剧上升,然后维持在较高水平,而D0组对虾肝胰腺中乳酸脱氢酶活性一直处于较低水平(见图4(C))。整体上,D8.25组和D33组对虾肝胰腺中乳酸脱氢酶活性显著高于D0组(P<0.05),且D33组高于D8.25组。
各组对虾肝胰腺中琥珀酸脱氢酶活性均呈现缓慢上升趋势,但D0组、D8.25组和D33组之间差异不显著(P>0.05)(见图4(D))。

(同一时间点,不同字母表示处理组间存在显著性差异(P<0.05)。At each time-point, means with different letters are significantly different (P<0.05).)

(同一时间点,不同字母表示处理组间存在显著性差异(P<0.05)。At each time-point, means with different letters are significantly different (P<0.05).)
2.5 对虾鳃中Na+/K+-ATP酶活性变化
各组对虾鳃中Na+/K+-ATP酶活性变化如图5所示。各组对虾鳃中Na+/K+-ATP酶活性在胁迫6 h内急速上升,然后维持在一个较高的水平。然而,D0组、D8.25组和D33组对虾之间无显著性差异(P>0.05)。

(同一时间点,不同字母表示处理组间存在显著性差异(P<0.05)。At each time-point, means with different letters are significantly different (P<0.05).)
3 讨论
3.1 饲喂钩虾粉对对虾抗低盐度胁迫能力的影响
钩虾是一种优质的生物饵料,拥有丰富的营养物质和生物活性物质,已有研究证实饲喂钩虾可以提高对虾抗环境胁迫能力[12-13]。本研究结果表明,饲喂钩虾粉可以显著提高对虾抗低盐度胁迫能力,这可能与其对养殖对虾的营养补充有关,已有研究表明,营养强化可以提高对虾抗盐度胁迫能力[7]。钩虾含有丰富的虾青素以及其他类胡萝卜素[15],Yamada等[16]研究发现饲料中添加一定含量的虾青素可以显著提高对虾存活率,虾青素可以通过清除胁迫中产生的活性氧来减轻环境胁迫对对虾产生的危害。Chien等[17-18]研究发现,当对虾受到温度胁迫、盐度胁迫、缺氧胁迫或氨氮胁迫时,添加虾青素都可以显著提高对虾的存活率,因此,饲喂钩虾粉提高对虾抗低盐度胁迫能力可能是与钩虾粉中富含虾青素有关。
3.2 饲喂钩虾粉对对虾体内生化物质水平的影响
本研究结果显示,饲喂钩虾粉可以显著提高对虾血淋巴和肝胰腺中蛋白质含量。对虾血淋巴和肝胰腺中的蛋白质作为重要的能量储备物质,在低盐度胁迫时,会分解成氨基酸,一方面提供能量,另一方面提供游离氨基酸来调节渗透压[19-20]。因此,饲喂钩虾组对虾高水平的蛋白质含量可以提供更多的游离氨基酸以及能量以应对盐度胁迫,这有利于对虾盐度耐受性的提高。此外,本研究中发现各组对虾在低盐度胁迫下血淋巴和肝胰腺中蛋白质含量均呈现下降趋势,进一步证实了在低盐度胁迫下对虾体内蛋白质的变化。钩虾富含蛋白质,武云飞等研究了青海钩虾的营养作用,证明青海钩虾是一种优质的蛋白源[21],因此,饲喂钩虾粉提高对虾体内蛋白质含量与其蛋白质的补充作用有关。
糖类是生物体内的重要能源物质,Welcomme等[22]发现当甲壳动物进入低盐度环境时,其细胞线粒体数量会急剧上升,氧化代谢上升,耗能加大,同时血淋巴葡萄糖水平下降。本研究中,各组对虾血糖含量除了在12 h时上升外均呈现下降的趋势,说明对虾为了应对环境变化,可能通过增强糖代谢途径来增强机体供能,而胁迫6~12 h对虾血糖含量增加可能是因为当血糖含量下降至一定程度时启动糖再生作用,致使血糖含量上升。然而,伴随着对虾渗透压调节耗能的增加,对虾血糖含量总体呈现下降趋势。此外,各组对虾血糖浓度虽然均显著降低,然而投喂钩虾粉的对虾血糖浓度波动较小。对虾在饥饿、营养过剩等条件下,机体精准地调控自身的平衡状态,维持了复杂的生命活动正常进行[23]。因此,投喂钩虾粉能够维持血淋巴内环境的稳态,从而更好地维持低盐度胁迫下机体的供能状态。
乳酸是甲壳动物无氧代谢的最终产物,乳酸含量可以反映机体无氧代谢的强弱[24-25]。本研究中,在低盐度胁迫1~6 h时,各组对虾肝胰腺中乳酸浓度的增加说明对虾的无氧代谢水平增强。胁迫12 h后,D0组和D8.25组肝胰腺中乳酸含量呈下降趋势,而D33组对虾肝胰腺乳酸含量依然处于较高水平。由此推测,相比于其它各组,D33组对虾无氧代谢持续供能的能力更强。各组对虾血淋巴中乳酸含量在6 h时急剧下降,然后趋于平稳,这可能是血淋巴中的乳酸被转移到肝胰腺中进行代谢的原因。
甘油三酯与总胆固醇的含量变化可以反映出机体脂类代谢水平,并且甘油三酯的含量能够反映机体利用储存脂肪的能力[26-27],本实验中发现,饲喂钩虾粉降低了对虾血淋巴中甘油三酯和总胆固醇含量,表明饲喂钩虾粉影响了对虾的脂肪代谢水平。已有研究表明,水产动物摄入食物的脂质含量会影响机体脂质的含量,机体脂质含量与日粮脂质水平呈正相关[28-29]。并且,虾青素会减少生物体内脂肪沉积[30]。因此,饲喂钩虾粉影响对虾的脂肪代谢水平,可能是钩虾粉配合饲料中脂质含量较低以及钩虾粉中富含虾青素所引起的。
3.3 饲喂钩虾粉对对虾肝胰腺中呼吸代谢酶的影响
己糖激酶和磷酸果糖激酶是糖酵解途径中的两种关键酶,其活性的变化对维持机体血糖水平以及糖酵解速率具有重要作用[31-33]。在胁迫0~12 h时,各组对虾肝胰腺中己糖激酶活性以及磷酸果糖激酶活性的上升说明在胁迫前期对虾肝胰腺中糖酵解水平增强,而在胁迫24 h之后,己糖激酶活性以及磷酸果糖激酶活性缓慢下降可能是因为对虾适应了环境变化,这与郭彪等发现温度突变对对虾糖酵解途径关键酶的影响相似[34]。在无氧或者低氧环境下,糖酵解是对虾获取能量的主要方式之一[35-36],低盐度下凡纳滨对虾的耗氧率上升[37],机体会出现供氧不足的情况[38]。因此,饲喂钩虾粉增强了凡纳滨对虾低盐度胁迫下的糖酵解水平,这有利于对虾更好地适应低盐胁迫。
乳酸脱氢酶是葡萄糖无氧代谢过程中的关键酶[39],可以催化丙酮酸和乳酸之间的相互转化[40],其活性的大小可以在一定程度上反映机体无氧代谢水平的高低[41]。本研究中,饲喂钩虾粉的对虾肝胰腺中乳酸脱氢酶活性在胁迫6 h急剧上升,在胁迫6 h之后缓慢下降,但显著高于D0组。因此,以上研究结果表明饲喂钩虾粉可以增强对虾低盐度胁迫下无氧代谢水平,尤其在胁迫前期,从而为对虾提供更多能量以应对胁迫,这与糖酵解相关酶的研究结果一致。
琥珀酸脱氢酶是氧化磷酸化与电子传递之间的纽带之一,其活性可以反映机体的有氧代谢水平[42]。本研究中,对虾肝胰腺中琥珀酸脱氢酶活性呈现缓慢上升趋势,在192 h时达到最高,但是各组之间差异不显著。以上研究结果表明,随着胁迫时间的延长,对虾肝胰腺中有氧代谢水平虽然不断提高,但是有氧代谢水平的高低没有显著影响低盐胁迫下对虾的成活率。
3.4 对虾鳃中离子转运酶的变化
Na+/K+-ATP酶参与对虾渗透压的调节,在控制细胞体积、维持化学梯度方面起到重要作用[43]。许多研究已经证明在低盐度胁迫环境下,凡纳滨对虾鳃中Na+/K+-ATP酶活性会显著升高[44]。本研究中,各组对虾鳃中Na+/K+-ATP酶活性均在6 h内急速上升,然后维持在一个较高的水平,但各组之间差异不显著。对虾从高渗环境中转移到低渗环境中时,Na+/K+-ATP酶活性的急速上升可以有效的调节对虾机体渗透压,但本研究结果提示,Na+/K+-ATP酶的渗透调节作用不是影响低盐胁迫下对虾成活率的关键调控途径。
4 结论
饲喂钩虾粉能够显著提高对虾抗低盐度胁迫能力,并且影响了对虾机体代谢,具体表现为降低了脂肪代谢水平,而增强了无氧代谢水平。因此,饲喂钩虾粉对对虾代谢的影响可能是其提高对虾抗低盐度胁迫能力的原因之一。
